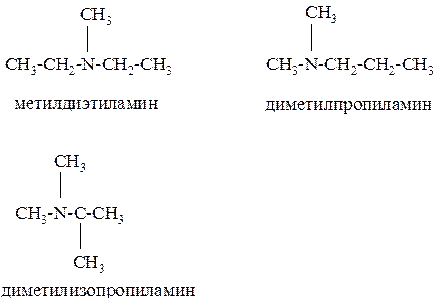НИТРОСОЕДИНЕНИЯ
НИТРОСОЕДИНЕНИЯ − производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на нитрогруппу ( NO2).
Строение
В зависимости от того, с какими атомами углерода связана нитрогруппа, различают первичные (I), вторичные (II) и третичные (III) нитросоединения.
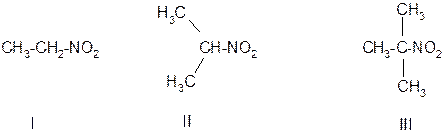
Номенклатура
По систематической номенклатуре нитросоединения называют, добавляя приставку нитро- к названию соответствующего углеводорода.
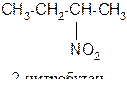
Получение
1. При действии азотистокислого серебра на галогеналканы
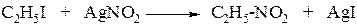
2. Нитрование алканов разбавленной азотной кислотой при нагревании до 250–500 оС и давлении (парофазное нитрование) – реакция Коновалова. Замещение водорода происходит у менее гидрогенизированного атома углерода
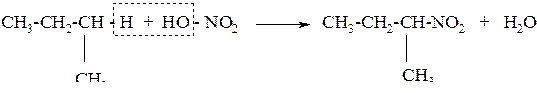
Механизм взаимодействия – радикальный. Нитрующий агент NO2 × – радикалоподобный оксид азота

Взаимодействие двух радикалов приводит к образованию нитросоединений:

Химические свойства
1. Восстановление нитросоединений с образованием первичных аминов

2. Действие щелочей на нитросоединения
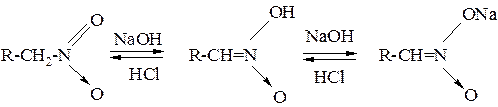
3. Взаимодействие с азотистой кислотой (является качественной реакцией на нитросоединения):
а) соли нитроловых кислот окрашены в ярко-красный цвет (с вторичными нитросоединениями):
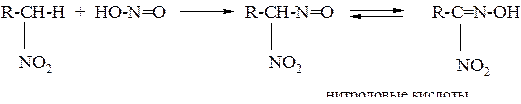
б) псевдонитрол имеет бирюзовое окрашивание (с третичныминитросоединениями):
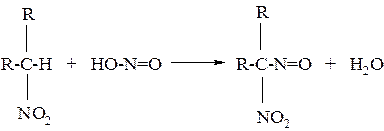
АМИНЫ
АМИНЫ − органические соединения, которые можно рассматривать как производные аммиака, в котором атомы водорода (один, два или три) замещены на углеводородные радикалы.
Амины могут быть первичными, вторичными и третичными (в зависимости от того, сколько атомов водорода при одном атоме углерода замещены на радикал)
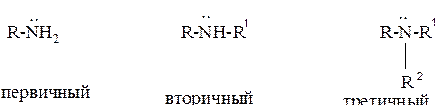
Изомерия
Изомерия аминов связана:
1. Со строением углеродного скелета и положением аминогруппы
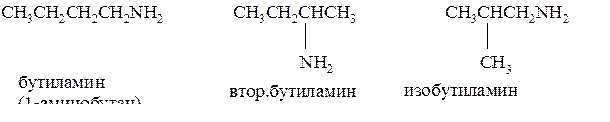
2. Первичные, вторичные и третичные амины, содержащие одинаковое число атомов углерода, являются изомерами друг друга

Номенклатура
По рациональной номенклатуре название строится следующим образом: в алфавитном порядке перечисляют названия углеводородных радикалов и добавляют окончание -амин.
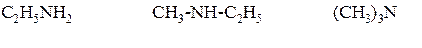
По систематической номенклатуре
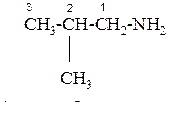
Получение
1. Алкилирование аммиака (при нагревании и при повышенном давлении)
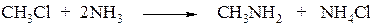
При избытке алкилгалогенида можно получить:
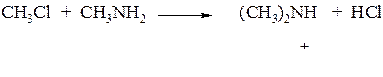
2. Первичные амины получают:
а) восстановлением нитросоединений

б) при восстановлении амидов сильными восстановителями
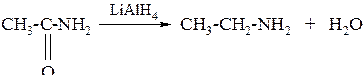
в) восстановлением нитрилов
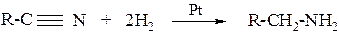
3. Взаимодействие амидов кислот со щелочными растворами бромноватистых или хлорноватистых солей (реакция Гофмана)
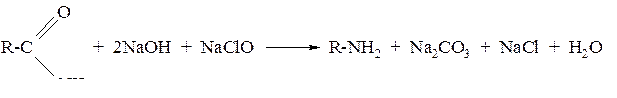
4. В биологических системах может происходить ферментативноедекарбоксилирование аминокислот
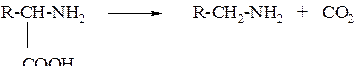
Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами. Причём, алифатические амины более сильные основания, чем аммиак.
Водные растворы аминов имеют щелочную реакцию (окрашивают красный лакмус в синий цвет)
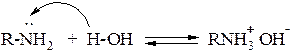
2. Амины взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония
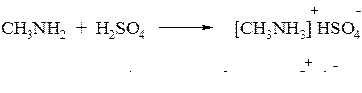
3. Щёлочи превращают соли аминов в свободные амины
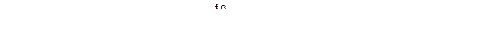
4. Амины – органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами
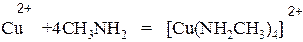
5. Взаимодействие с азотистой кислотой:
а) первичные амины
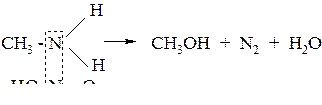
б) вторичные амины образуют нитрозоамины
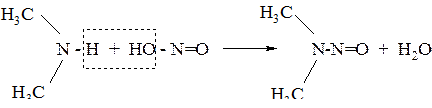
в) третичные амины устойчивы к действию кислоты.
6. Амины вступают в реакцию алкилирования

7. Амины вступают в реакцию ацилирования
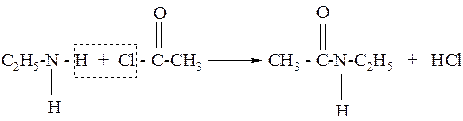
Примеры решения типовых задач
Пример № 1. Напишите структурные формулы всех третичных аминов состава C5H13N и назовите их по рациональной номенклатуре.
Решение: Общая формула третичных аминов:
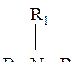
где R, R1, R2 – предельные углеродные радикалы.
Пять атомов углерода разбить на три радикала можно выделить двумя способами:
1) один радикал СН3 и два радикала С2Н5;
2) два радикала СН3 и один радикал С3Н7.
Последнему способу соответствуют два изомера, т.к. существует два радикала состава С3Н7: – СН2 – СН2 – СН3 (пропил) и – СН(СН3)2 (изопропил). Таким образом, всего существует три третичных амина состава C5H13N:
|
| |
Пример № 2. Каким образом можно осуществить превращения:
нитробензол ® анилин ® бромид фениламмония?
Приведите примеры.
Решение:
Нитробензол восстанавливается в анилин под действием различных восстановителей (реакция Зинина):
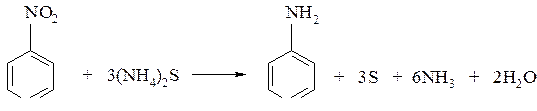
Анилин реагирует с бромоводородом с образованием бромида фениламмония:
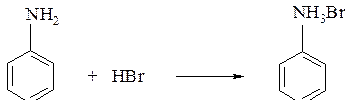
Пример № 3 . Определите формулу третичного амина, в котором массовые доли углерода, водорода и азота равны соответственно 65,75; 15,07; 19,18 %. Назовите этот амин.
Решение: Пусть формула амина CxHуNz, где z = 1.
Тогда имеем: x : у : z = 65,75/12 : 15,07/1 : 19,187/14 = 5,479 : 15,07 : 1,37 =
= 4 : 11: 1.
Формула амина – C4H11N. Этой формуле отвечают 8 изомеров, но третичный амин один – диметилэтиламин.
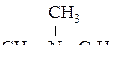
Пример № 4. Какая масса бензола потребуется для получения анилина массой 279 кг, если его выход составляет 75 %?
Решение: Анилин получают из бензола в две стадии. Сначала бензол подвергают нитрованию:
C6H6 + HNO3 ® C6H5NO2 + H2O (a)
Затем восстанавливают нитробензол до анилина, например, каталитическим гидрированием:
C6H5NO2 + 3H2 ® C6H5NH2 + 2H2O (б)
Определяем, какая масса анилина образовалась бы при количественном выходе, если реально получен продукт массой 279 кг:
m(C6H5NH2) = 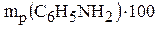 ;
;
m(C6H5NH2) = 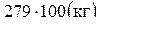
Находим количество вещества анилина:
n(C6H5NH2) = 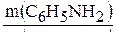 ;
;
n(C6H5NH2) = 
Из уравнений (а) и (б) следует:
n(C6H6) = n(C6H5NH2); n(C6H6) = 4 кмоль
Вычисляем требуемую массу бензола:
m(C6H6) = n(C6H6) × М(C6H6); m(C6H6) = 4 × 78 кг = 312 кг.
Упражнения и задачи для самостоятельной работы
281. Какой объём азота образуется при сгорании метиламина объёмом
20л, содержащего 2 % примесей?
282. Какие амины получаются при восстановлении:
| а) 2-нитробутана; | б) 4-нитротолуола; |
| в) 2- метил-2 нитропропана? | |
283. Объясните, почему анилин обладает более слабыми основными свойствами, чем метиламин.
284. Расположите в порядке возрастания основности следующие вещества:
а) метиламин; б) аммиак; в) анилин; г) диметиламин; д) дифениламин.
285. Каким образом можно осуществить превращения:
хлорид метиламмония ® метиламин ® азот?
Приведите уравнения реакций.
286. Напишите уравнения реакции диметиламина:
| а) серной кислотой; | б) с азотистой кислотой; |
| в) с раствором хлорида железа (III); | г) с кислородом; |
| д) с бромметаном. | |
287. Предложите схему получения изо-пропиламина из пропена и напишите уравнения соответствующих реакций.
288. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН4 ® С2Н2 ® С6Н6 ®C6H5NO2 ® C6H5NH2 ® C6H5NH3Cl
289. Закончите уравнения реакций:
| а) CH3NH2 + HCl ® | в) CH3NH2 + O2 ® |
| б) C6H5NO2 + HСl + Fe ® | г) C6H5NH2 + CH3J ® |
290. Напишите уравнения реакций, с помощью которых можно получить хлорид фениламмония исходя из бензола.
291. Напишите химические уравнения, соответствующие следующей схеме:
СаС2 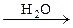 А
А 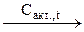 Б
Б 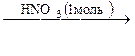 В
В 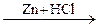 Г
Г
292. Закончите уравнения реакций:
| а) C6H5NO2 + (NH4)2S ® | в) C6H5NH2 + Br2 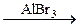
|
| б) C6H5NH3Cl + NaOH ® | г) (CH3)3N + CH3Cl ® |
293. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
CH3Cl ® C2H6 ® C2H4 ® А ® C2H5NO2 ® Б® (C2H5)2NH
Назовите вещества А и Б.
294. Предложите способ получения метиламина из неорганических соединений. Напишите уравнения реакций.
295. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот выход мононитропроизводного составил 70 %. Сколько граммов продукта получено?
296. Какая масса анилина была образована при пропускании водорода через раствор нитробензола, полученного при взаимодействии железа с 0,5 М раствором хлороводородной кислоты объемом 200 мл?
297. При действии избытка раствора гидроксида натрия на раствор хлорида фениламмония массой 500 г получили анилин, на бромирование которого затратили бром массой 144 г. Массовая доля хлорида фениламмония в растворе составляет 10 %. Определите выход анилина.
298. При нитровании бензола массой 21 г образовался нитробензол, выход которого составил 85 %. Какая масса анилина получится при восстановлении нитробензола, если выход анилина составляет 80 %?
299. Какая масса 2,4,6-триброманилина может быть получена при взаимодействии анилина массой 9,8 г с бромом массой 52 г.
300. Раствор хлорида фениламмония массой 129,5 г и массовой долей 10 % обработали избытком гидроксида натрия. На бромирование полученного анилина затратили 36 г брома. Определите выход анилина, если бромирование его прошло количественно.
301. Рассчитайте массу триметиламина, который образуется при взаимодействии аммиака объёмом 5,6 л с избытком метилбромида.
302. Определите массу 2,4,6-триброманилина, который может быть получен при взаимодействии анилина массой 37,2 г с бромом массой 208 г.
303. При нитровании 0,2 моль бензола смесью концентрированных азотной и серной кислот при 50–60 оС было получено с 90 %-ным выходом мононитропроизводное. Сколько миллилитров амина образовалось при восстановлении этого нитросоединения железом в разбавленной соляной кислоте, если выход амина при восстановлении составляет 75 % (плотность 1,022 г/мл)?
304. Сколько граммов анилина необходимо затратить на нейтрализацию раствора хлороводородной кислоты (плотность 1,19 г/мл) объемом 20 мл с массовой долей HCl 60 %?
305. В анилиновое производство поступил бензол объёмом 4 м3 с плотностью 0,88 кг/л. Рассчитайте массу анилина, который может быть получен, если его выход составил 80 %.
306. Нитробензол массой 30 г был полностью прогидрирован. Газообразные продукты горения полученного соединения заняли объем 15 л. Каков выход реакции гидрирования?
307. На нейтрализацию смеси массой 60 г, состоящей из бензола, фенола и анилина, пошло 99,4 мл 20 % соляной кислоты (плотность 1,08 г/мл). При взаимодействии такого же количества смеси с избытком бромной воды образовался осадок массой 200 г. Вычислите массовые доли веществ в исходной смеси.
308. При пропускании смеси метана и этиламина через раствор соляной кислоты, взятый в избытке, объем смеси сократился на 30 %. Рассчитайте массовые доли компонентов в исходной смеси.
309. Имеется раствор анилина в органическом растворителе массой 25 г. К раствору добавили избыток брома, при этом выпал осадок 16,5 г. Определите массовую долю анилина в исходном растворе.
310. В 200 г смеси анилина, бензола и фенола пропустили сухой хлороводород. При этом образовалось 103,6 г осадка, который отфильтровали. Фильтрат обработали бромной водой, при этом получили 40 г осадка. Определите массовые доли веществ в исходной смеси.
311. Анилин, полученный восстановлением нитробензола массой 17 г, был полностью прогидрирован. Газообразные продукты горения полученного соединения после приведения к нормальным условиям заняли объём 7 л. Каков выход реакции восстановления нитробензола, если выходы остальных реакций равны 100 %?
312. Смесь метиламина, аминоуксусной кислоты и этилацетата массой 20 г может прореагировать с 4,93 л (н.у.) хлороводорода, а 40 г той же смеси могут прореагировать с 300 мл 1,4М раствора гидроксида калия. Вычислите массовые доли веществ в исходной смеси.
313. Установите молекулярную формулу третичного амина, если известно, что при его сгорании выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота.
314. Определите молекулярную формулу вторичного амина, массовые доли углерода, водорода и азота в котором составляют 61, 15,3 и 23,7 % соответственно. Напишите его структурную формулу и название.
315. Рассчитайте массу 2,4,6-триброманилина, которая может быть получена при взаимодействии анилина массой 18,6 г с бромом массой 104 г.
Дата: 2018-12-21, просмотров: 693.