СПИРТЫ
СПИРТЫ – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу (ОН).
В зависимости от числа гидроксильных групп, спирты подразделяют на одно-, двух- и трёхатомные.
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов CnH2 n+1 OH.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты
Первичные – R-CH2-OH
Вторичные – R2-CH-OH
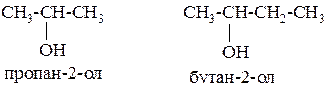
Третичные – R3-C-OH
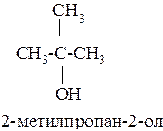
Номенклатура
Название спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа.
Например:
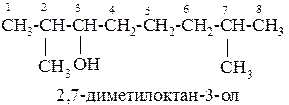
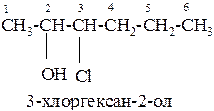
Изомерия одноатомных спиртов связана:
1) со строением углеродного скелета
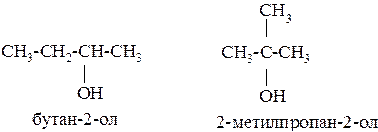
2) с положением гидроксильной группы
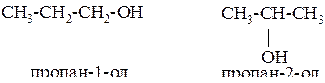
Получение
1. Гидратация алкенов
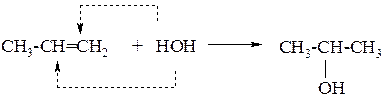
Реакция идёт при пропускании алкена с парами воды над фосфорнокислым катализатором и протекает по правилу Марковникова.
2. Гидролиз алкилгалогенидов под действием водных растворов щелочей
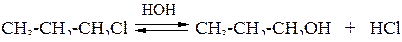
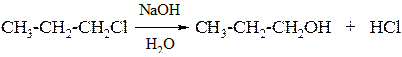
3. Брожение сахаров (получение этанола)
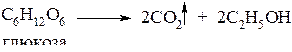
4. Гидрирование оксида углерода
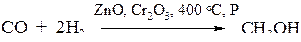
5. Восстановление карбонильных соединений:
а) при восстановлении альдегидов и сложных эфиров образуются первичные спирты
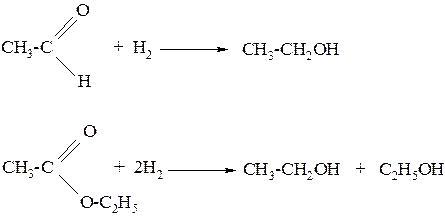
б) при восстановлении кетонов образуются вторичные спирты
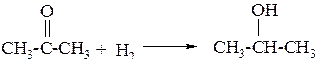
Химические свойства спиртов
Различают два основных типа реакций спиртов с участием функциональной группы ОН.
I. Реакции с разрывом О–Н связи
1. Взаимодействие спиртов со щёлочными и щёлочноземельными металлами

Кислотные свойства спиртов выражены слабо. Спирты реагируют с металлами, но не взаимодействуют со щелочами.
2. При действии на спирты органических кислот (в присутствии минеральных кислот) образуются сложные эфиры
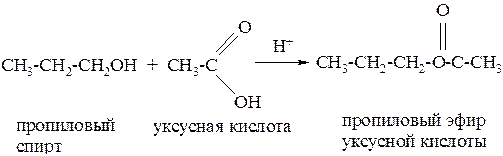
3. Спирты окисляются под действием окислителей (дихромата или перманганата калия) до карбонильных соединений:
а) первичные спирты окисляются до альдегидов, которые в свою очередь могут окисляться до карбоновых кислот
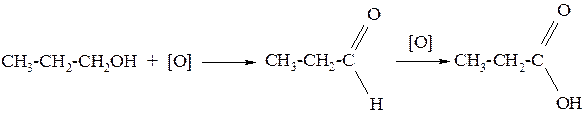
б) вторичные спирты окисляются до кетонов
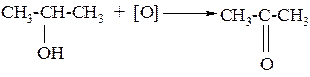
в) третичные спирты окисляются только с разрывом С – С связи
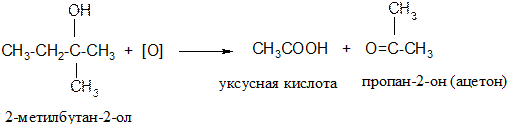
II. Реакции с разрывом С−О связи.
1. Реакция дегидратации:
а) при сильном нагревании ( >150 оС)
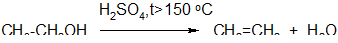
б) при более слабом нагревании (<150 оС)
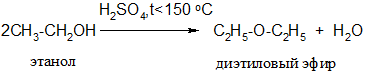
2. Обратимо реагируют с галогеноводородными кислотами (проявляют слабые основные свойства)

Многоатомные спирты
Двухатомные спирты (гликоли) содержат в молекуле две гидроксильные группы при разных углеродных атомах.
Первый представитель – этиленгликоль
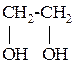
Трёхатомные спирты содержат три гидроксильные группы. Основной представитель – глицерин.
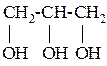
Получение
1. Гидролиз дигалогеналканов
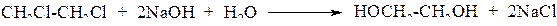
2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия
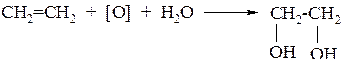
3. Гидролизом жиров получают глицерин
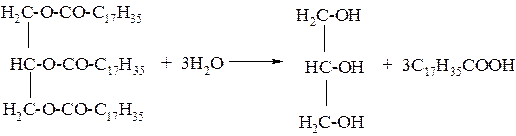
Химические свойства
Для двух- и трёхатомных спиртов характерны основные реакции одноатомных спиртов. Взаимное влияние гидроксильных групп проявляется в том, что они более сильные кислоты, чем одноатомные спирты.
Соли двухатомных спиртов называются гликолятами, а соли трёхатомных спиртов – глицератами.
Качественной реакцией на многоатомные спирты, в которых гидроксильные группы находятся при соседних атомах углерода, является ярко-синее окрашивание при взаимодействии их с гидроокисью меди за счет образования комплексного соединения
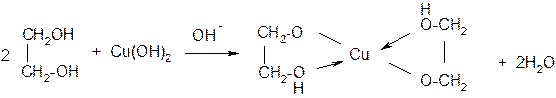
При нитровании глицерина получается тринитроглицерин
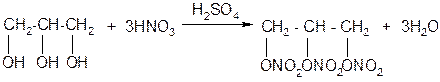
Примеры решения типовых задач
Пример № 1. В смесь этанола и пропанола массой 16,6 г поместили избыток натрия, при этом выделился водород объёмом 3,36 л. Каков состав исходной смеси спиртов?
Решение:
Обозначим массу этанола – х г, а массу пропанола (16,6 – х) г.
1. Объём водорода, выделившийся при действии натрия на этанол
2С2Н5ОН + 2Na ® 2С2Н5ОNa + Н2
Из 2 ∙ 46 л спирта образуется 22,4 л Н2
из х г спирта образуется А л Н2
А= 22,4 х /2 ∙46
2. Объём водорода, выделившийся при действии натрия на пропанол, 2С3Н7ОН + 2Na® 2С3Н7ОNa + Н2
Из 2 ∙ 60 г пропанола выделится 22,4 л Н2.
Из (16,6 – х) г пропанола выделится В л Н2
В = 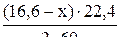
3. Зная, что общий объём А + В = 3,36 л, составляем уравнение с одним неизвестным:
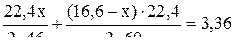
Отсюда х = 4,6 г. Таким образом, в смеси находится 4,6 г С2Н5ОН и
16,6 – 4,6 = 12 г С3Н7ОН.
Пример № 2. При сгорании органического вещества массой 4,8 г образовалось 3,36 л CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества.
Решение: Продукты сгорания вещества состоят из трёх элементов: углерода, водорода, кислорода. При этом очевидно, что в состав этого соединения входил весь углерод, содержащийся в CO2, и весь водород, перешедший в воду. А вот кислород мог присоединиться во время горения из воздуха, а мог и частично содержаться в самом веществе.
Для определения простейшей формулы соединения нам необходимо знать его элементный состав.
Найдём количество продуктов реакции (в моль):
n(CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль
n(H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль
Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H) = 2n(H2O), так как в одной молекуле воды содержатся два атома водорода.
Вычислим их массы по формуле:
m = n∙M
m(H) = 0,6 моль ∙ 1 г/моль = 0,6 г
m(С) = 0,15 моль ∙ 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного вещества:
m(O) = 4,8 (0,6 + 1,8) = 2,4 г
Найдем число моль атомов кислорода:
n(O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям:
n(CO2) : n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1,
самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на неё.
Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдём значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы:
x = M(CH4O)х / M(CH4O)
Зная относительную плотность исходного вещества по водороду, найдём молярную массу вещества
M(CH4O)х = M(H2) ∙D(H2) = 2 г/моль ∙ 16 = 32 г/моль
x = 32 г/моль : 32 г/моль = 1;
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x = 32; 32 x = 32; x = 1.
Ответ: Формула исходного органического вещества CH4O (метанол).
Пример № 3. Какой объём водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96 %-ным (по массе) раствором этанола в воде
(V = 100 мл, плотность d = 0,8 г/мл).
Решение: В условии задачи даны количества обоих реагентов − это верный признак того, что какой-нибудь из них находится в избытке. Найдём массу этанола, введённого в реакцию:
m(раствора) = V∙d = 100 мл ∙ 0,8 г/мл = 80 г
m(C2H5OH) = {m(раствора)∙w%} : 100% = 80 г ∙ 0,96 = 76,8 г.
(1) 2C2H5OH + 2Na = 2C2H5ONa + H2
на 2 моль этанола -- 2 моль натрия -- 1 моль водорода
Найдём заданное количество этанола в моль:
n(C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль.
Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объём выделенного водорода будет определяться количеством этанола:
n1(H2) = 1/2 n(C2H5OH) = 1/2 ∙ 1,67 моль = 0,835 моль
V1(H2) = n1(H2) ∙VM = 0,835 моль ∙ 22,4 л/моль = 18,7 л;
Но это ещё не окончательный ответ. Будьте внимательны!
Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
Найдём массу воды:
m(H2O) = {m(раствора)∙w%} : 100% = 80 г ∙ 0,04 = 3,2 г;
n(H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = 0,178 моль;
(2) 2H2O + 2Na = 2NaOH + H2
на 2 моль воды - 2 моль натрия - 1 моль водорода
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит:
n(Na, остаток) = 2 моль − 1,67 моль = 0,33 моль;
Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий всё равно оказывается в избытке.
Найдем количество и объём водорода, выделившегося по реакции (2):
n2(H2) = 1/2 n(H2O) = 1/2 ∙0,178 моль = 0,089 моль;
V2(H2) = n2(H2) ∙VM = 0,089 моль ∙ 22,4 л/моль = 1,99 л;
Общий объём водорода:
V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л.
Ответ: V (H2) = 20,69 л.
Пример № 4. При дегидратации одноатомного спирта получили углеводород этиленового ряда, 14 г которого способны реагировать с 40 г брома. Определите этот спирт.
Решение: В условии задачи указано, что исходное вещество представляет собой предельный одноатомный спирт.
Его общую формулу можно записать как CnH2n+1OH; тогда формула образующегося из него углеводорода CnH2n.
Запишем уравнения реакций и найдем молярную массу углеводорода:
CnH2nOH → CnH2n + H2O
Из 14 г CnH2n+1OH получается 40 г CnH2n
CnH2n + Br2→ CnH2nBr2
Из 1 моль CnH2nполучается 1 моль CnH2nBr2
n(CnH2n) = n(Br2) = m(Br2) / M(Br2) = 40 г : 160 г/моль = 0,025 моль
M(CnH2n) = m(CnH2n) / n(CnH2n) = 14 г : 0,025 моль = 56 г/моль
Найдем значение n: 12n + 2n = 56; 14 n = 56; n = 4.
Следовательно, исходный спирт − это C4H9OH, бутанол.
Формулы его изомеров таковы:
CH3 - CH2 - CH2 - CH2 - OH (бутанол-1)
CH3 - CH(OH) - CH2 - CH3 (бутанол-2)
Можно было бы записать ещё формулы:
CH3 - CH(CH3)2 - CH2 - OH и CH3 - CH(OH)(CH3) - CH3
Но при дегидратации этих изомеров углеводороды этиленового ряда не образуются.
Пример №5. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Решение: Запишем уравнения реакций:
СnН2n + НСl = СnН2n+1Сl,
CnH2n+1Cl + NaOH = CnH2n+1OH + NaCl.
n(HCl) = 6,72/22,4 = 0,3 моль. Согласно уравнениям реакций,
n(CnH2n+1OH) = n(CnH2n+1Cl) = n(HCl) = 0.3 моль. Молярная масса спирта равна: M(CnH2n+1OH) = 22,2/0,3 = 74 г/моль, откуда n = 4. Следовательно, молекулярная формула спирта − С4Н9ОН.
Из четырёх спиртов состава С4Н9ОН только третичный спирт −
(2-метилпропанол-2, или трет-бутиловый спирт) содержит три метильные группы. В состав молекулы этого спирта входит разветвлённый углеродный скелет, следовательно, исходный алкен состава С4Н8 тоже имел разветвлённый скелет. Это 2-метилпропен. Уравнения реакций:
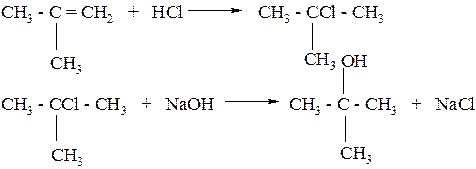
Ответ: 2-метилпропен; трет-бутанол.
Пример №6. Соединение неизвестного строения медленно реагирует с натрием, не окисляется раствором дихромата натрия, с концентрированной соляной кислотой реагирует быстро с образованием алкилхлорида, содержащего 33,3 % хлора по массе. Определите строение этого соединения.
Решение: Характер реакций с Na, с Na2Cr2O7 и с HCl свидетельствует о том, что неизвестное вещество − третичный спирт, при реакции с HCl образуется третичный алкилхлорид:
ROH + HCl = RCl + Н2О
Один моль RCl содержит один моль Cl массой 35,5 г, что составляет 33,3 % от общей массы, следовательно молярная масса алкилхлорида равна:
M(RCl) = 35,5/0,333 = 106,5 г/моль, а молярная масса углеводородного радикала равна: M(R) = 106,5 −35,5 = 71 г/моль. Единственный радикал с такой молярной массой − С5Н11.
Третичные спирты имеют общую формулу:
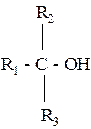
Один атом углерода из пяти соединён с гидроксильной группой, а четыре атома входят в состав трёх радикалов. Разбить четыре атома углерода на три радикала можно единственным способом: два радикала СН3 и один радикал С2Н5. Искомый спирт 2-метилбутанол-2:
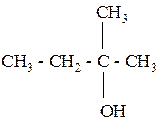
Ответ: 2-метилбутанол-2.
Упражнения и задачи для самостоятельной работы
141. Напишите структурные формулы всех вторичных одноатомных спиртов состава С5Н11ОН.
142. Напишите структурные формулы:
| а) 2,3-диметилбутанола-1; | б) 2-метил-3- этилпентанола-2; |
| в) 2,2 -диметилпропанола-1. | |
143. Напишите структурную формулу двухатомного спирта состава С5Н10(ОН)2, содержащего три метильные группы.
144. Как можно отличить этиловый спирт от глицерина? Ответ подтвердите уравнениями реакций.
145. Напишите уравнения реакций 2-метилпропанола-1 со следующими веществами:
| а) бромоводородной кислотой; | б) натрием; |
| в) концентрированной серной кислотой; д) бихроматом калия в присутствии серной кислоты. | г) оксидом меди (II); |
| 146. Сколько изомерных третичных спиртов могут иметь состав С6Н13ОН? Напишите формулы этих спиртов и назовите их. | |
147. Назовите по международной номенклатуре следующие соединения:
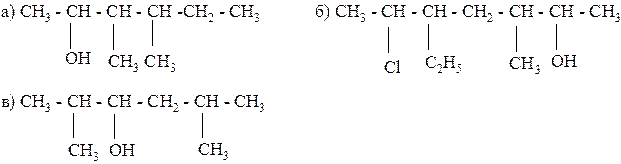
148. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) CH4 ® CH3Cl ® C2H6 ® CH2=CH2 ® CH3–CH2OH ® CH3–CH2–O–CH2–CH3
б) C2H4 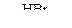 А
А 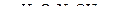 Б
Б 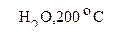 В
В 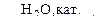 Г
Г
149. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) пропанол- 1 ® А ®пропанол- 2 ® 2-бромпропан;
б) этанол ® Б ® 1,2 – дихлорэтан ® ацетилен;
в) 2-метилпропанол- 1 ® В ® 2 -метилпропанол- 2.
Назовите вещества А, Б, В. Укажите условия протекания реакций.
150. Составьте уравнения реакций между 3-метилбутанолом- 2 и следующими веществами:
| а) натрием; | б) йодоводородом; |
| в) серной кислотой (каталитические количества) при нагревании до 140 о – 150 оС. | |
151. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) СH3Cl ® C2H6 ® C2H4 ® C2H5OH ® C2H5ONa
б) CaC2 ® C2H2 ® C2H4 ® C2H6 ® C2H5Cl ® C2H5OH ® C2H5 – O – C2H5
152.Закончить уравнения реакций:
| а) C2H5OH + Na ® | в) C2H5OH + CH3COOH 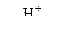
|
| б) C2H5OH + CuO ® | г) CH2OH – CH2OH + Cu(OH)2 ® |
| д) CH3 – CHCl – CH3 + KOH
| |
153.Закончить уравнения реакций:
а) С2Н5ОН 
| в) СН2 = СН2 + Н2О 
|
б) 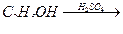
| г) CH2Cl – CH2Cl + KOH 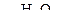
|
154.Закончить уравнения реакций:
| а) C2H5OH + HBr(газ) ® | в) С6Н12О6 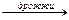
|
б) C2H5OH 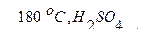
| г)CH2OH–CH2OH–CH2OH+НNO3 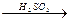
|
155. Напишите уравнения реакций, укажите условия их проведения:
С2Н6 ® С2H5Cl ® C2H4 ® CH2OH – CH2OH ® (CH2OH – CH2O)2Cu
156. Определить массу этилата натрия, которая может быть получена из этанола массой 13,8 г и натрия массой 9,2 г.
157. При нагревании предельного одноатомного спирта массой 12 г с концентрированной серной кислотой образовался алкен массой 6,72 г с выходом
80 %. Определите формулу исходного спирта.
158. Этанол массой 23 г нагрели с избытком бромида калия и серной кислотой и получили 43,6 г бромэтана. Определите выход продукта в этой реакции.
159. Сколько миллилитров азотной кислоты (плотность 1,45 г/мл) с массовой долей HNO3 80 % потребуется для получения тринитрата глицерина массой 22,7 г?
160. Сколько граммов этилбромида получится при нагревании этилового спирта с раствором бромоводородной кислоты (плотность 1,2 г/мл) объёмом 120 мл с массовой долей HBr 40 %?
161. При полном сгорании смеси метилового и этилового спиртов массой 1,74 г израсходовано 2,016 л кислорода. Определите массовую долю каждого спирта в растворе.
162. Сколько этандиола-1,2 получается при окислении этилена атомарным кислородом, выделившегося из перманганата калия массой 15,8 г?
163. Какой объём займет водород, полученный при действии натрия массой 3,45 г на этиловый спирт массой 46 г?
164. Сколько процентов от теоретического составляет выход этанола, если из хлорэтана массой 129 г получено 85 г этанола с содержанием этанола 90 %?
165. Метанол количеством 0,5 моль нагрели с избытком бромида калия и серной кислоты, получили бромметан массой 38 г. Определите выход бромметана.
166. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна
3,2 %. Определите массу пропанола-2, взятую для реакции.
167. Какая масса металлического натрия прореагирует с раствором пропанола-1 массой 200 г, массовая доля воды в котором 10 %? Какой объём водорода, измеренным при нормальных условиях, выделяется при этой реакции?
168. При каталитической дегидратации этанола массой 1,84 г получили газ, который прореагировал с бромом, содержащемся в растворе массой 50 г. Массовая доля брома в этом растворе 8 %. Определите выход продукта дегидратации спирта, если выход в реакции бромирования количественный.
169. При получении синтетического каучука по способу Лебедева в качестве исходного сырья используют этанол, пары которого пропускают над катализатором, получая бутадиен -1,3, водород и воду. Какую массу бутадиена-1,3 можно получить из спирта объёмом 230 л и плотностью 0,8кг/л, если массовая доля этанола в спирте равна 95 %? Учесть, что выход продукта составляет
60 %.
170. Метанол получают взаимодействием оксида углерода (II) с водородом. Для реакции взяты 2 м3 СО и 5 м3 водорода. В результате получили метанол массой 2,04 кг. Определите выход продукта.
171. Установите молекулярную формулу спирта, если при нагревании
274 г этого спирта с концентрированной серной кислотой образуется 133,4 г непредельного углеводорода с одной двойной связью. Выход в реакции равен 80 %.
172. К смеси этилового и пропилового спиртов массой 8,3 г прибавили избыток натрия. При этом выделилось 1, 68 л водорода (н.у.). Каков процентный состав исходной смеси?
173. Определите строение предельного одноатомного спирта, если известно, что при взаимодействии его с бромоводородом образуется вторичный алкилбромид, а при действии на 30 мл этого спирта (плотность 0,8 г/см3) избытком металлического натрия выделяется водород в количестве, достаточном для полного гидрирования 2,24 л (н.у.) дивинила.
174. Сколько литров пропилена (н.у.) получится при дегидрировании 60 кг пропанола, если практический выход составляет 70 %?
175. При окислении первичного спирта массой 12 г получено 14,8 г одноосновной карбоновой кислоты с тем же числом углеродных атомов, что и у исходного спирта. Какова формула этого спирта?
АЛЬДЕГИДЫ И КЕТОНЫ
АЛЬДЕГИДАМИ И КЕТОНАМИ называются производные углеводородов, содержащие карбоксильную группу C = O
Общая формула альдегидов:
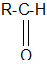
Общая формула кетонов:
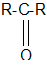
Изомерия альдегидов связана со строением радикалов. Для альдегида, имеющего брутто - формулу C5H10O, известно четыре изомера.
Название альдегидов образуется или по названию кислоты, в которую переходит углеводород с добавлением слова альдегид, или по названию углеводорода с добавлением суффикса – аль.
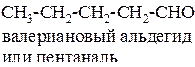
Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи. Название кетонов образуется из названия углеводорода с добавлением суффикса-он и указывается номер углерода, связанного с карбонильным кислородом. Нумерация углеродных атомов начинается с углерода, находящегося ближе к карбонильной группе.
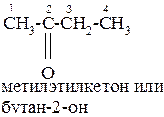
Получение
1. Окислением или каталитическим дегидрированием первичных спиртов получают альдегиды, вторичных спиртов – кетоны:
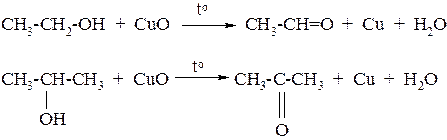
2. Пиролизом кислот и их смесей в виде паров над оксидами некоторых металлов (ThO2, MnO2, CaO, ZnO ) при температуре 400–450 оС:
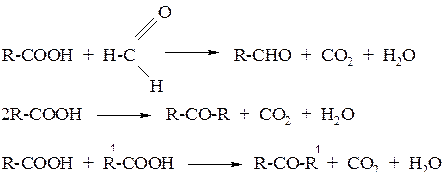
3. Гидратацией ацетилена и его гомологов в условиях реакции Кучерова. Присоединение воды ведут либо в присутствии сульфата ртути, либо над гетерогенным катализатором.
Из ацетилена получают уксусный альдегид:
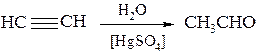
Из других ацетиленовых углеводородов – кетоны:
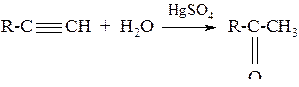
4. При щелочном гидролизе дигалогеналканов
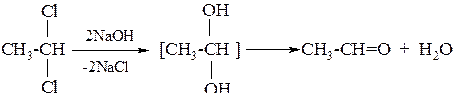
5. Дегидратацией спиртов (один из промышленных методов получения)
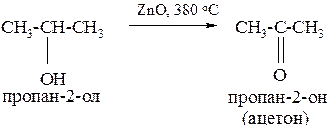
6. Окислением алкенов
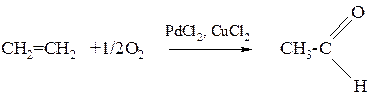
Химические свойства
Определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью. Такие соединения склонны к реакциям присоединения по связям С=О.
Важнейшими реакциями для них являются реакции присоединения.
1. Присоединение водорода (реакции восстановления)
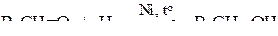
Из кетонов в аналогичных условиях получаются вторичные спирты
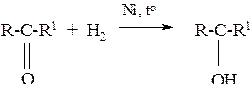
2. Присоединение цианводородной (синильной) кислоты
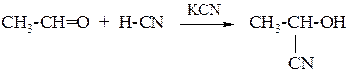
Образующиеся при этом соединения содержат на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используются для удлинения углеродной цепи.
3. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя, соответственно, полуацетали и ацетали:
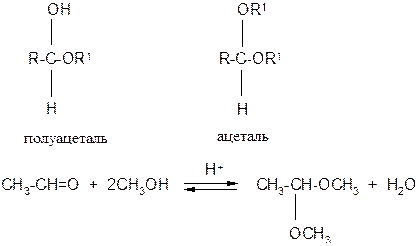
4. Присоединение гидросульфитов
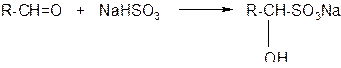
5. Присоединение реактива Гриньяра
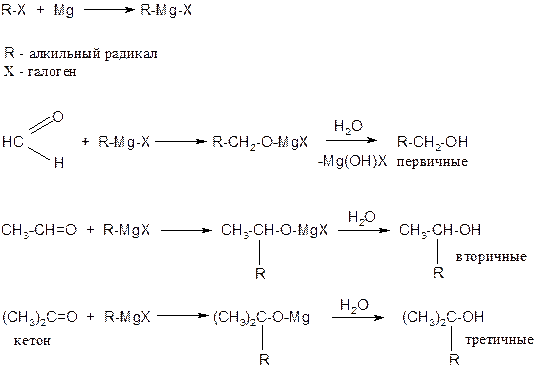
6. Окислительно-восстановительные реакции:
а) реакция ²серебряного зеркала²
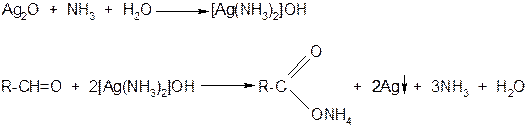
б) окисление альдегидов гидроксидом меди
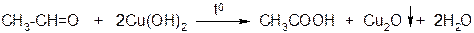
При окислении альдегидов гидроксидом меди (II), последний превращается в жёлтого цвета гидроксид меди (I), который при нагревании разлагается с образованием оксида меди (I) – продукта красного цвета.
 Альдегиды и кетоны содержат в своих молекулах карбонильную группу –C= O, наличие которой обусловливает ряд их общих свойств. При дифференцированной идентификации альдегидов и кетонов используют различия их химических свойств, чаще всего – более лёгкую окисляемость альдегидов и их большую склонность к реакциям конденсации.
Альдегиды и кетоны содержат в своих молекулах карбонильную группу –C= O, наличие которой обусловливает ряд их общих свойств. При дифференцированной идентификации альдегидов и кетонов используют различия их химических свойств, чаще всего – более лёгкую окисляемость альдегидов и их большую склонность к реакциям конденсации.
Примеры решения типовых задач
Пример № 1. Как две в стадии из уксусного альдегида получить бромэтан?
Решение:
Уксусный альдегид можно восстановить водородом до этанола:
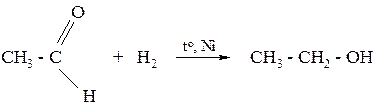
а этанол обработать избытком бромоводородной кислоты:
СН3-СН2ОН + HBr ® CH3 – CH2Br + H2O
Пример № 2. Определите массу технического карбида кальция с массовой долей СаС2 87 %, необходимую для получения ледяной уксусной кислоты массой 1 т при выходе продукта 100 %.
Решение:
Основные этапы производства включают следующие реакции:
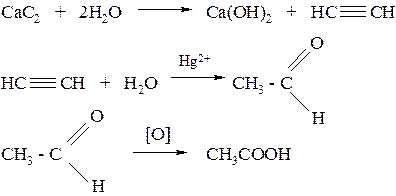
Из приведенных уравнений реакций следует, что из 1 моль СаС2 (64 г) можно получить 1 моль уксусной кислоты (60 г). Для производства уксусной кислоты массой 1 т нужно взять:
64 г СаС2 – 60 г СН3СООН
х г СаС2 – 1 т СН3СООН
х = 64 г ∙ 1 т/60 г =1,067 т СаС2
Поскольку содержание СаС2 в техническом препарате составляет 87 %, требуемая масса определяется из соотношения:
1,067 т – 87 %
х т – 100 %
х = 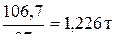
Ответ: 1,226 т карбида кальция.
Пример № 3. К 1,17 г смеси пропанола-1 и неизвестного альдегида добавили аммиачный раствор 5,80 г оксида серебра и слегка нагрели. Выпавший при этом осадок отфильтровали, а непрореагировавший оксид серебра перевели в хлорид серебра, масса которого оказалась равной 2,87 г. Определите строение взятого альдегида, если молярное отношение альдегида к спирту в исходной смеси равно 3:1.
Решение:
С оксидом серебра в аммиачном растворе реагирует только альдегид:
NН3
RCH=O + Ag2O → RCOOH + 2Ag
Непрореагировавший Ag2O перевели в AgCl действием избытка соляной кислоты:
Ag2O + 2HCl = 2АgСl + Н2О
n(AgCl) = 2,87/143,5 = 0,02 моль. В эту реакцию вступило 0.02/2 = 0,01 моль Аg2О, а всего было 5,8/232 = 0,025 моль Аg2О; следовательно, в реакцию с альдегидом вступило 0,025 – 0,01 = 0,015 моль Ag2O.
n(RCH=O) = n(Ag2O) = 0,015 моль.
Пропанола-1 в смеси было в 3 раза меньше, чем альдегида:
n(CH3CH2CH2OH) = 0,015/3 = 0,005 моль. Масса пропанола-1 равна
0,005∙60 = 0,3 г, а общая масса смеси – 1,17 г, следовательно масса альдегида равна 1,17 – 0,3=0,87 г.
Молярная масса альдегида: M(RCH=O) = 0,87/0,015 = 58 г/моль, что соответствует уксусному альдегиду СН3-СН=О.
Ответ: уксусный альдегид, СН3-СН=О.
Пример № 4. Для каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до соответствующих спиртов потребовалось 11,2 л водорода (н.у.). Определите массовые доли альдегидов в смеси.
Решение: Пусть в смеси находилось х моль НСНО и y моль СН3СНО, тогда масса смеси равна: 30х + 44y = 17,8 г. Для полного гидрирования смеси по уравнениям
НСНО + Н2 → СН3ОН
СН3СНО + Н2 →СН3СН2ОН
требуется (х + у) моль водорода, или 11,2/22,4 = 0,5 моль. Решая систему двух уравнений для х и у, находим: х = 0,3, у = 0,2.
Массовые доли альдегидов в смеси равны: w(НСНО) = 0,3∙30 / 17,8 = 0,506, или 50,6 %; w (СН3СНО) = 0,2∙44 / 17,8 = 0,494, или 49,4 %.
Ответ: 50,6 % муравьиного альдегида, 49,4 % уксусного альдегида.
Пример № 5. При окислении 10,8 г органического вещества аммиачным раствором оксида серебра выделилось 32,4 г серебра. Вычислите молярную массу продукта окисления и изобразите графические формулы всех возможных его изомеров.
Решение: Чтобы решить эту задачу, надо по крайней мере знать, какие вещества окисляются под действием аммиачного раствора оксида серебра и что при этом получается. Здесь идёт речь о реакции "серебряного зеркала" − качественной реакции на альдегиды. Вне зависимости от природы алкильного радикала R, входящего в молекулу альдегида, окисление 1 моль альдегида даёт 2 моль серебра:
RCHO + Ag2O → RCOOH + 2Ag↓
1 моль Ag2O − 2 моль Ag
n(Ag) = m(Ag) / M(Ag) = 32,4 г : 108 г/моль = 0,15 моль
M(RCHO) = m(RCHO) / n(RCHO) = 10,8 г : 0,15 моль = 72 г/моль
M(R) = M(RCHO) – M(CHO) = 72 г/моль – (12 + 16 + 1) г/моль = 43 г/моль
Этому значению M(R) отвечает алкильный радикал C3H7.
Следовательно, формула алкильного радикала R – C3H7, а искомые вещества − масляная и изомасляная кислоты:

Упражнения и задачи для самостоятельной работы
176. Предложите способ получения уксусного альдегида из неорганических соединений.
177. Как известно, если в реакции Кучерова участвует ацетилен, получается ацетальдегид. Можно ли с помощью этой реакции получить другие альдегиды (не содержащие иных функциональных групп)? Почему?
178. Какие спирты должны быть окислены, чтобы образовались альдегиды следующего строения:
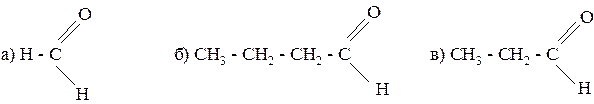
179. Напишите уравнения реакций взаимодействия с водородом в присутствии никелевого катализатора:
| а) этаналя; | б) формальдегида; | в) масляного альдегида |
180. Напишите уравнения реакции каталитического окисления кислородом воздуха при высокой температуре следующих спиртов:
| а) пропанола-1; | б) метанола; |
| в) этанола | |
181. Напишите структурные формулы следующих соединений:
| а) 2-метилпентаналь; | в) 3,3,4,4-тетраметилгексаналь; |
| б) 2,3-диметилбутаналь; | г) 4,4-диметилпентанон-2. |
182. Напишите уравнения реакций пентаналя со следующими веществами:
| а) циановодородной кислотой; | в) аммиачным раствором оксида серебра |
| б) хлором; | г) гидросульфитом натрия |
183. Составьте уравнения реакций, которые необходимо провести для осуществления следующих превращений:
пропен ® А ® ацетон
Назовите вещество А, укажите условия протекания реакций.
184. Напишите уравнения реакций, которые надо провести для осуществления следующих превращений:
уксусный альдегид ® этанол ® этилен ® ацетилен ® уксусный альдегид
185. Назовите следующие соединения по систематической номенклатуре:
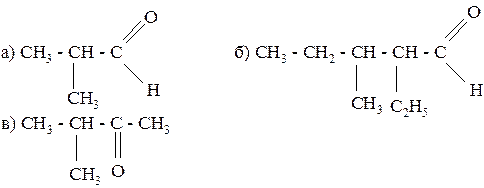
186. Предложите три способа получения ацетальдегида из этилена.
187. Закончите уравнения реакций:
| а) CH3 – CHO + HCN ® | б) CH3 – CCl3 + NaOH 
|
| в) CH3 – CHO + Cu(OH)2 ® | г) HCOOH + Ag2O 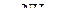
|
188. Закончить уравнения реакций:
189. Предложите реагенты для следующих реакций и напишите их уравнения (некоторые реакции могут требовать более одной стадии):
углерод ® ацетилен ® ацетальдегид ® изопропанол ® ацетон
190. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
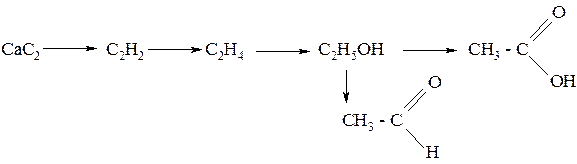
191. Ацетилен объёмом 448 мл был превращен в альдегид выходом 83 %. Определите массу серебра, образующуюся при действии полученного альдегида на избыток аммиачного раствора оксида серебра (I).
192. При взаимодействии этанола массой 9,2 г с оксидом меди (II) массой 20 г получен альдегид массой 7,04 г. Определить выход продукта реакции.
193. Определите массу серебра, образующегося в результате реакции раствора этаналя массой 50 г с массовой долей 88 % с избытком аммиачного раствора оксида серебра.
 194. Формалин представляет собой водный раствор формальдегида (массовая доля 40 %). Рассчитайте массу метанола, который необходимо окислить для получения формалина массой 600 г.
194. Формалин представляет собой водный раствор формальдегида (массовая доля 40 %). Рассчитайте массу метанола, который необходимо окислить для получения формалина массой 600 г.
195. При каталитическом окислении пентанола-3 массой 15,3 г получен кетон массой 9,03 г. Вычислить выход кетона от теоретически возможного.
196. Сколько мл раствора формальдегида с массовой долей НСНО 40 % (плотностью 1,1 г/мл) можно получить при окислении метилового спирта (плотностью 0,8 г/мл) объёмом 200 мл с массовой долей СН3ОН 60 %.
197. Из технического карбида кальция массой 40 кг можно получить уксусный альдегид массой 22 кг. Определите массовую долю примесей в техническом карбиде кальция.
198. Сколько граммов оксида меди (I) образуется при нагревании раствора этаналя массой 55 г с массовой долей СН3ОН 40 % с гидроксидом меди (II).
199. На смесь муравьиного и уксусного альдегида массой 37 г подействовали оксидом серебра (I). При этом образовалось серебро массой
216 г. Определите массовую долю смеси.
200. В промышленности ацетальдегид получают по способу Кучерова. Какую массу ацетальдегида можно получить исходя из технического карбида кальция массой 500 кг, массовая доля примесей в котором составляет 10,4 %? Выход ацетальдегида 75 %.
201. При каталитическом гидрировании формальдегида получили спирт, при взаимодействии которого с избытком металлического натрия образовался водород объёмом 8,96 л (н.у.). Выход продуктов на каждый из стадий синтеза составил 80 %. Определите исходную массу формальдегида.
202. Какая масса формалина с массовой долей формальдегида 40 % может образоваться, если использовать альдегид, полученный при каталитическом окислении метана объёмом 336 л (н.у.) кислородом воздуха? Выход продуктов в реакции окисления равен 60 %.
203. Какая масса раствора с массовой долей ацетальдегида 20 % образуется, если альдегид получили с выходом 75 % из ацетилена объёмом 6,72 л (н.у.) по реакции Кучерова?
204. Какое количество формальдегида содержится в растворе объёмом 3 л и плотностью 1,06 г/мл, массовая доля СН2О в котором равна 20 %.
205. Рассчитайте объём ацетальдегида (н.у.), который содержится в его растворе объёмом 6 л (плотность 1,06 г/мл, массовая доля СН2О 20 %).
206. Ацетальдегид, полученный из 11,3 л ацетилена (при н.у.), окислили до кислоты, которую затем подвергли этерификации в избытке этилового спирта. Найдите массу образовавшегося сложного эфира, если его практический выход составляет 80 %.
207. При взаимодействии этанола массой 9.2 г с оксидом меди получили альдегид, масса которого составила 7,2 г. Рассчитайте массовую долю выхода альдегида.
208. Какую массу уксусного альдегида можно получить из 11,2 л ацетилена по реакции Кучерова, если массовая доля выхода альдегида составляет
90 %?
209. Какую массу метанола можно получить из формальдегида массой
45 г, если массовая доля выхода составляет 95 %?
210. Какую массу уксусного альдегида можно получить при окислении этанола объёмом 80 см3 (плотностью 0,8 г/см3), если массовая доля его выхода составляет 90 %?
Дата: 2018-12-21, просмотров: 889.