Ориентация при замещении в бензольном кольце касается проведения электрофильного ароматического замещения в системе, уже имеющей заместители в цикле.
Имеются две группы заместителей – активирующие и дезактивирующие:
| орто, пара - Ориентанты | мета - Ориентанты |
| Активизирующие (электрон – донорные) | Дезактивирующие (электрон – акцепторные) |
| - OH | - CN |
| - NH2 | -COOH |
| - OR | - COOR |
| Алкил | - COOR |
| Акрил | - CHO |
| Дезактивирующие | - NO2 |
| Все галогены | - SO3H |
| - SO2OR |
Схема влияния заместителей на ориентацию замещения и реакционную способность:
| Активирующие заместители | Дезактивирующие заместители |
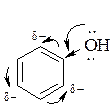 Появление избыточной электронной плотности в кольце. Облегчение электрофильной атаки - активирование ароматического кольца в целом и орто- и пара-положений в частности.
Появление избыточной электронной плотности в кольце. Облегчение электрофильной атаки - активирование ароматического кольца в целом и орто- и пара-положений в частности.
| 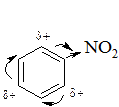 Оттягивание электронной плотности p-системы к электроноакцепторной группе. Дезактивация ароматического кольца. Затруднение электрофильной атаки. Меньшая дезактивация мета-положения.
Оттягивание электронной плотности p-системы к электроноакцепторной группе. Дезактивация ароматического кольца. Затруднение электрофильной атаки. Меньшая дезактивация мета-положения.
|
1. Реакция галогенирования:
а) в отсутствии катализатора
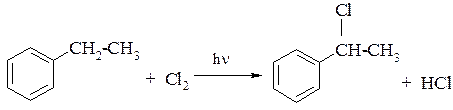
При облучении галоген вступает только в боковую цепь молекулы. Причём, замещается всегда атом водорода, непосредственно связанный с бензольным кольцом (a-атом углерода);
б) в присутствии катализатора замещение возможно только в кольцо
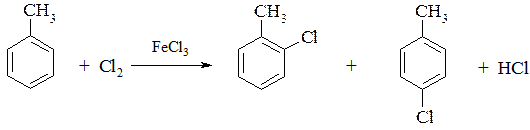
2. При действии на гомологи бензола перманганатом калия или другими сильными окислителями происходит окисление боковой цепи. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a-атома углерода, который окисляется в карбонильную группу.
Гомологи бензола с одной углеводородной боковой цепью окисляются до бензойной кислоты:
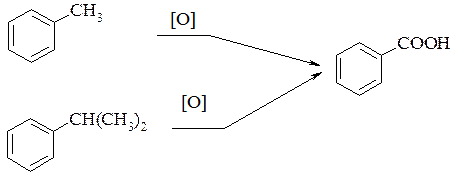
Гомологи, содержащие две боковые углеводородные цепи, окисляются до двухосновных кислот:
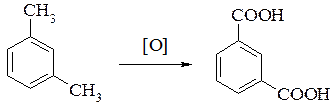
Фенол
Фенол имеет тривиальное название – карболовая кислота, её используют в медицине как дезинфицирующее и антисептическое средство.
Фенолам свойственны слабокислотные свойства. Это проявляется в их способности растворяться в щелочах с образованием фенолятов

В воде фенол растворим плохо, так как кислотные свойства выражены слабо.
Химические свойства
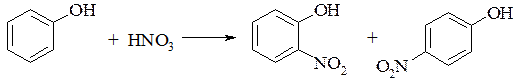
1. Фенолы легко вступают в реакцию нитрования:
а) при нитровании фенола разбавленной азотной кислотой может быть получена смесь 1,2- и 1,4-нитрофенолов
б) при нитровании фенола более концентрированной азотной кислотой получают 2,4,6-тринитрофенол (пикриновую кислоту)
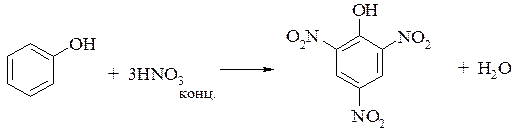
2. При бромировании фенола получают 2,4,6-трибромфенол. Эта реакция является качественной реакцией на фенол
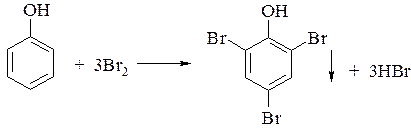
Нитробензол
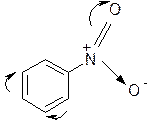
Нитробензол является нейтральным веществом (не растворяется ни в щелочах, ни в кислотах). Важнейшим его свойством (как и всех нитросоединений) является способность восстанавливаться в амины
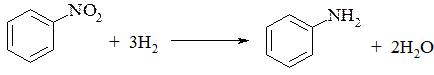
Анилин
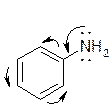
Анилин проявляет слабые основные свойства.
Химические свойства
1. Образует соли с кислотами
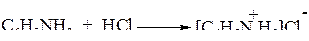
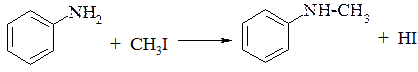
2. Замещает атом водорода в аминогруппе
3. Взаимодействует с бромом с образованием плохо растворимого осадка. Это качественная реакция на анилин:
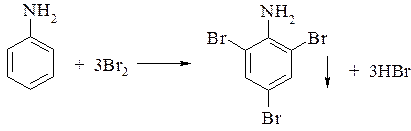
Примеры решения типовых задач
Пример № 1. Из ацетилена объёмом 6,72 л (н.у.) получен бензол объёмом 2,5 мл. Определите массовую долю выхода продукта, если плотность бензола равна 0,88 г/мл.
Решение:
1. Вычисляем количество вещества ацетилена, взятого для реакции:
n(C2H2) = 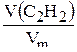 ; n(C2H2) =
; n(C2H2) = 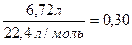 моль
моль
2. Бензол получают при пропускании ацетилена над раскалённым активным углем:
3С2Н2 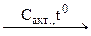 С6Н6
С6Н6
Из уравнения реакции следует, что:
n(C6H6) = 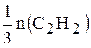 ; n(C6H6) =
; n(C6H6) = 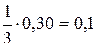 моль
моль
3. Определяем массу бензола, который образовался бы при количественном выходе:
m(C6H6) = n(C6H6) ×M(C6H6); m(C6H6) = 0,1моль × 78 г/моль = 7,8 г.
4. Рассчитываем массу бензола, который был реально получен:
mр(C6H6) = Vp(C6H6) ×r(C6H6); mр(C6H6) = 5 мл × 0,88 г/мл = 4,4 г.
5. Вычисляем массовую долю выхода бензола:
h(C6H6) = 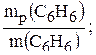 h(C6H6) =
h(C6H6) = 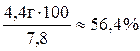
Ответ: 56,4 %.
Пример № 2.
Напишите уравнения реакций, которые надо провести для осуществления следующих превращений:
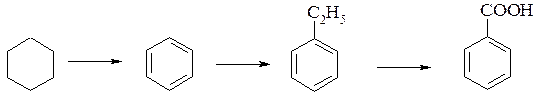
Решение:
1. Циклогексан превращается в бензол при пропускании его паров над нагретым платиновым катализатором:
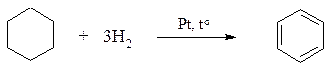
2. Ввести алкильную группу в бензольное кольцо можно действием галогенпроизводного алкана (или алкена) в присутствии хлорида алюминия:
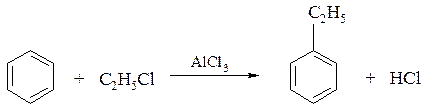
3. При действии раствора перманганата калия на этилбензол образуется бензойная кислота:

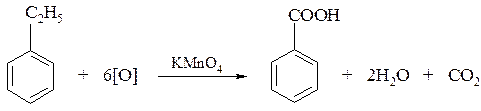
Пример № 3. Какое строение может иметь ароматический углеводород молекулярной формулы С8Н10? Назовите возможные изомеры.
Решение:
Для ароматического соединения С8Н10 возможны четыре изомера:
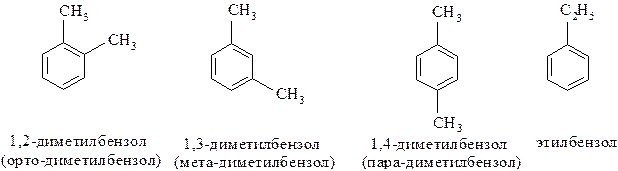
Пример № 4. В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола.
Решение:
3C2H2 → C6H6 (650 оС, активированный уголь);
n(C2H2) = V(C2H2)/ VM = 120 л : 22,4 л/моль = 5,35 моль;
n(C6H6)теор = 1/3 ∙n(C2H2) = 1/3 ∙ 5,35 моль = 1,785 моль;
n(C6H6)практ = m(C6H6)/ M(C6H6) = 60 г : 78 г/моль = 0,77 моль;
h = (nпракт : nтеор) ∙ 100% = (0,77 : 1,785) ∙ 100% = 43%.
Ответ: 43 %.
Пример №5. Напишите общую молекулярную формулу гомологического ряда нитрофенола. Приведите структурную формулу одного из членов ряда, содержащего 11 атомов водорода в молекуле.
Решение:
Молекулярная формула нитрофенола C6H4(OH)NO2. Гомологи нитрофенола отличаются от него на n групп СН2 и имеют общую формулу
Сn + 6Н2n + 5NО3. 11 атомов водорода (n = 3) имеет, например, 2-пропил-4-нитрофенол:
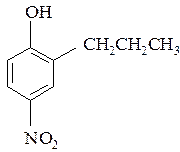
Пример № 6. Определите строение ароматического углеводорода состава С9Н12, если известно, что при его окислении перманганатом калия образуется бензолтрикарбоновая кислота, а при бромировании в присутствии FeBr3 − только одно монобромпроизводное.
Решение: Так как углеводород С9Н12 при окислении перманганатом калия образует трикарбоновую кислоту, то он должен иметь три метильные группы. По условию задачи, при бромировании образуется только одно монобромпроизводное. Следовательно, углеводород построен симметрично, это 1,3,5-три-метилбензол.
Схемы реакций:
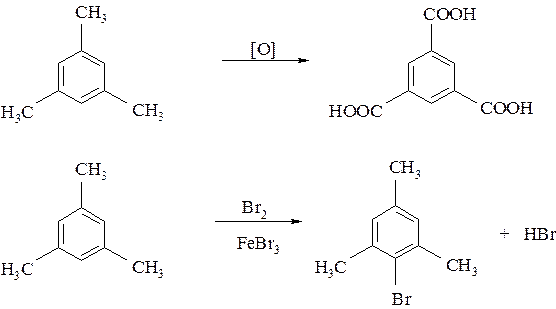
Пример № 7. При действии бромной воды на антраниловую
(2-аминобензойную) кислоту получена смесь моно- и дибромпроизводных. Напишите структурные формулы каждого из полученных изомеров.
Решение: Аминогруппа NH2 − ориентант 1-го рода (орто-пара-ориентант), а карбоксильная группа СООН − ориентант 2-го рода (мета-ориентант). В молекуле 2-аминобензойной кислоты оба эти заместителя действуют согласованно и направляют последующее замещение в одни и те же положения, которые обозначены стрелками:
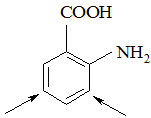
При бромировании атомы брома замещают атомы водорода в положениях, отмеченных стрелками. При этом образуются два монобромопроизводных и одно дибромопроизводное:
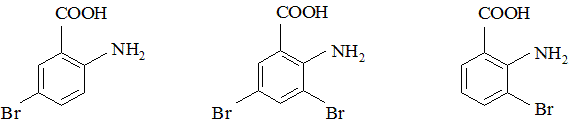
Пример № 8. Предложите схему получения 3-нитробензойной кислоты из этилбензола в две стадии. Укажите условия реакций.
Решение: Карбоксильная группа -СООН является мета-ориентантом, поэтому при нитровании бензойной кислоты образуется 3-нитробензойная кислота. Нитрование проводится концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
Бензойную кислоту можно получить из этилбензола действием подкисленного раствора перманганата калия. Схема указанных превращений
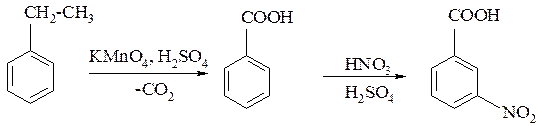
Пример № 9. При окислении смеси бензола и толуола подкислённым раствором перманганата калия при нагревании получено 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объём которого в 19 раз меньше объёма такого же газа, полученного при полном сгорании исходной смеси углеводородов. Определите массы веществ в исходной смеси.
Решение: Перманганатом калия окисляется только толуол, при этом образуется бензойная кислота:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5-СООН + 3K2SO4 + 6MnSO4 + 14Н2О
n(C6H5-COOH) = 8,54/122 = 0,07 моль = n(C6H5-CH3).
При взаимодействии бензойной кислоты с гидрокарбонатом натрия выделяется СО2:
С6Н5-СООН+ NaHCO3 → C6H5-COONa + СО2 + Н2О.
n(CO2) = n(C6H5-COOH) = 0,07 моль. При сгорании смеси углеводородов образуется 0,07∙19 = 1,33 моль СО2. Из этого количества при сгорании толуола по уравнению:
С6Н5-СН3 + 9О2 → 7СО2 + 4Н2О
образуется 0,07∙7 = 0,49 моль СО2.
Остальные 1,33−0,49 = 0,84 моль СО2 образуются при сгорании бензола:
С6Н6 + 7,5О2 → 6СО2 + 3Н2О.
nC6H6) = 0,84/6 = 0,14 моль.
Массы веществ в смеси равны:
m(С6Н6) = 0,14∙78 = 10,92 г; m(С6Н5-СН3) = 0,07∙92 = 6,48 г.
Ответ: 10,92 г бензола, 6,48 г толуола.
Пример № 10 . Через 10 г смеси бензола, фенола и анилина пропустили ток хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидроксида натрия. Верхний органический слой отделили, его масса уменьшилась на 4,7 г. Определите массы веществ в исходной смеси.
Решение: При пропускании через смесь хлороводорода выпадает осадок хлорида фениламмония, который нерастворим в органических растворителях:
C6H5NH2 + HCl → C6H5NH3Cl
n(C 6H 5NH 3Cl ) = 2,59/129,5 = 0,02 моль, следовательно
n(C6H5NH 2 ) = 0,02 моль, m (C6H5NH2) = 0,02.93 = 1,86 г.
Уменьшение массы органического слоя на 4,7 г произошло за счёт реакции фенола с гидроксидом натрия: С6Н5ОН + NaOH → C6H5ONa + Н2О
Фенол перешёл в водный раствор в виде фенолята натрия.
m (С6Н5ОН) = 4,7 г. Масса бензола в смеси составляет 10 − 4,7 − 1,86 = 3,44 г.
Ответ: 1,86 г анилина, 4,7 г фенола, 3,44 г бензола.
Пример № 11. При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40 %-ного раствора гидроксида калия (плотность
1,4 г/мл). Определите массовые доли веществ в исходной смеси.
Решение: С натрием реагируют и этанол, и фенол:
2С2Н5ОН + 2Na → 2C2H5ONa + Н2,
2С6Н5ОН + 2Na → 2C6H5ONa + Н2,
а с гидроксидом калия − только фенол:
С6Н5ОН + KОН → С6Н5ОK + Н2О.
n(KOH) = 25 ∙1,4∙0,4 / 56 = 0,25 моль = n(C6H5OH)
Из 0,25 моль фенола в реакции с натрием выделилось 0,25 : 2 = 0,125 моль Н2, а всего выделилось 6,72 : 22,4 = 0,3 моль Н2. Оставшиеся 0,3 − 0,125 = 0,175 моль Н2 выделились из этанола, которого израсходовано 0,175 ∙ 2 = 0,35 моль.
Массы веществ в исходной смеси: m(С6Н5ОН) = 0,25∙94 = 23,5 г,
m(С2Н5ОН) = 0,35 ∙ 46 = 16,1 г. Массовые доли:
w(С6Н5ОН) = 23,5 / (23,5+16,1) = 0,593, или 59,3 %,
w(С2Н5ОН)= 16,1 /(23,5+16,1) = 0,407, или 40,7 %.
Ответ: 59,3 % фенола, 40,7 % этанола.
Упражнения и задачи для самостоятельной работы
106. Напишите структурные формулы:
| а) 2-метил-3- этилбензола; | б) 1,3,5-триметилбензола; |
| в) 1-метил-4-изобутилбензола; | г) 1,4-диизопропилбензола. |
107. Как из метана можно получить бензол? Сколько литров метана необходимо затратить на получение бензола массой 15,6 г?
108. Приведите не менее трёх химических реакций, в результате которых может быть получен толуол. Укажите необходимые условия протекания реакции.
109. Приведите уравнения реакций, необходимых для превращений:
гексан ® бензол ® циклогексан
110. Закончите уравнения реакций:
а) С6Н6 + Br2 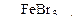
| б) С6Н5 – CH3 + [O] ® |
в) С6Н6 + CH3Cl 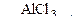
| г) С6Н5 – CH3 + Br2 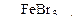
|
111. Напишите уравнения реакций, укажите условия их проведения:
С ® СаС2 ® С2Н2 ® С6Н6 ® С6Н5 – СН3 ® С6Н5 – СООН
112. Сколько изомерных гомологов бензола отвечает формуле С7Н7Cl? Напишите их структурные формулы и назовите их.
113. Напишите уравнения реакций, укажите условия их проведения:
н-С6Н14 ® С6Н6 ® С6Н12 ® С6Н6 ® С6Н5 – СН3 ® С6Н5 – СН2Cl
114. Закончите уравнения реакций:
а) С6Н6 + HNO3 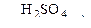
| в) C6H5 – CH3 + Cl2 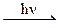
|
б) C6H12 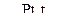
| г) н-С7Н16 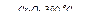
|
115. Напишите уравнения реакций следующих превращений:
С6Н6 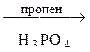 А
А 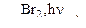 Б
Б 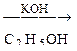 В
В 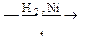 Г
Г 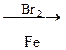

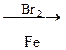 Д
Д 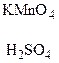 Е
Е
Назовите неизвестные вещества А – Е и напишите их структурные формулы.
116. Напишите уравнения реакций, соответствующие последовательности превращений:
С6Н6 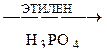 А
А 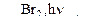 Б
Б 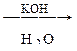 В
В 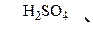 Г
Г 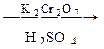
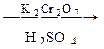 Д
Д 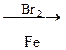 Е
Е
Назовите неизвестные вещества А – Е и напишите их структурные формулы.
117. Напишите уравнения реакций следующих превращений:
1,6-дибромгексан 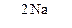 А
А 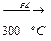 В
В 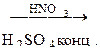 С
С
Назовите вещества А, В, С.
118. Закончите уравнения реакций:
а) С6Н5–С(СН3)3 +[O] ®
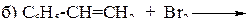
|
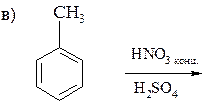 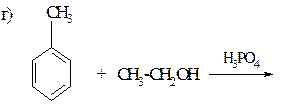 
|
119. Смесь фенола и стирола обесцвечивает 0,3 кг бромной воды, содержание брома в которой составляет 3,2 %. Найдите процентный состав исходной смеси, если такое же её количество может вступить в реакцию с 3,6 мл 10 %-ного раствора NaOH (плотность 1,11 г/мл).
120. Напишите схемы реакций, соответствующих следующим превращениям:
 С6Н6
С6Н6 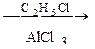 А
А 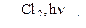 В
В 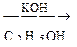 С
С 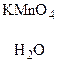 Д
Д
121. Бензол, полученный дегидрированием циклогексана объёмом 302 мл и плотностью 0,779 г/мл, подвергли хлорированию при освещении. Образовалось хлорпроизводное массой 600 г. Определите выход продукта реакции.
122. Какой объём водорода, измеренный при нормальных условиях, образуется при циклизации и дегидрировании н-гептана объёмом 200 мл и плотностью 0,66 г/мл? Реакция протекает с выходом 65 %.
123. Какой объём воздуха (н.у.) потребуется для полного сгорания
1,4-диметилбензола массой 10,6 г. Объемная доля кислорода в воздухе составляет 21 %.
124. При дегидрировании этилбензола массой 8,48 г получили стирол. Выход продукта реакции составил 80 %. Какую массу раствора брома в тетрахлориде углерода может обесцветить полученный стирол, если массовая доля брома в растворе составляет 4 %?
125. Какая масса фенолята натрия может быть получена при взаимодействии фенола массой 9,4 г с раствором гидроксида натрия объёмом 9,94 мл и плотностью 1,38 г/мл? Массовая доля гидроксида натрия в растворе составляет 35 %.
126. При взаимодействии раствора фенола в бензоле массой 200 г с избытком бромной воды получили бромпроизводное массой 66,2 г. Определите массовую долю фенола в растворе.
127. Определить объём воздуха (н.у.), необходимого для сжигания 31,2 г бензола, если объёмная доля кислорода в воздухе составляет 21 %.
128. Определить объём бензола плотностью 0,88 г/мл, который можно получить из 26,88 л (н.у.) ацетилена, если выход продуктов реакции равен 70 %.
129. Газ, полученный при взаимодействии 19,2 г бензола с избытком брома в присутствии катализатора с образованием бромбензола, растворили в воде. Определите объём раствора гидроксида калия с массовой долей 8 % и плотностью 1,092 г/мл, необходимый для нейтрализации полученного раствора.
130. При бромировании бензола в присутствии бромида железа (III) получен бромоводород, который пропустили через избыток раствора нитрата серебра. При этом образовался осадок массой 15 г. Вычислите массу полученного продукта бромирования бензола.
131. Газ, образовавшийся при сжигании бензола, пропустили через избыток раствора гидроксида бария. Образовался осадок массой 59,1 г. Рассчитайте массу сожжённого вещества.
132. Смесь бензола и стирола обесцветила бромную воду массой 1 л (массовая доля брома 3,5 %). При сгорании смеси той же массы выделился оксид углерода (IV) объёмом 89,6 л (н.у.). Определите массовую долю стирола в смеси.
133. Какая масса оксида марганца (IV) потребуется для получения хлора, необходимого для превращения 20 мл бензола (плотностью 0,8 г/мл) в гексахлорциклогексан?
134. Смесь бензола и циклогексена массой 3,98 г обесцвечивает 160 г бромной воды с массовой долей брома 2 %. Какой объём воздуха (н.у.) необходим для сжигания 20 г этой же смеси, если объёмная доля кислорода в воздухе равна 21 %.
135. Имеется смесь фенола с этанолом. К одной половине смеси добавили избыток металлического натрия, получив водород объёмом 672 мл (н.у.). К другой половине смеси добавили избыток раствора брома, при этом образовался осадок массой 6,62 г. Определите массовые доли фенола и этанола в смеси.
136. Какая масса (г) оксида марганца (IV) потребуется для получения хлора, который может превратить 39 г бензола в гексахлоран?
137. Смесь бензола с циклогексаном массой 4,39 г обесцвечивает бромную воду массой 125 г с массовой долей брома 3,2 %. Определите процентное содержание бензола в смеси.
138. Газ, выделившийся при действии 16 г брома на 25 мл бензола (плотность 0,78 г/см3) в присутствии соли железа (III), введён в реакцию с 2,24 л
1,3-бутадиена (н.у.). Какое количество бромбензола было получено в результате реакции?
139. Смесь толуола и н-гексана, защищённую от света, обработали бромом при нагревании в присутствии бромида железа (III). При этом образовалось
1,7 г смеси монобромпроизводных. Такое же количество исходной смеси обработали бромом при освещении. При этом получилось 3,3 г смеси других монобромпроизводных. Определите состав исходной смеси углеводородов.
140. 20 г бензольного раствора фенола обработали избытком водного раствора гидроксида натрия, после чего водный слой отделили. При обработке оставшегося вещества бромом (в присутствии железа) образовалось 15,7 г монобромида (выход 50 %). Определите содержание бензола и фенола в исходном растворе.
Дата: 2018-12-21, просмотров: 698.