Олеиновая кислота С17Н33–СООН
Алкадиеновая кислота
Линолевая кислота С17Н31–СООН
Алкатриеновая кислота
Линоленовая кислота С17Н29–СООН
Физические свойства
По агрегатному состоянию жиры подразделяются на жидкие и твёрдые (при комнатной температуре). Твёрдые жиры, как правило, образованы предельными кислотами. Жидкие жиры (их часто называют маслами) образованы непредельными кислотами.
Жиры растворимы в органических растворителях и нерастворимы в воде.
Химические свойства
1. Гидролиз или омыление жиров происходит под действием воды (обратимо) или под действием щелочей (необратимо):
а) кислотный гидролиз жиров
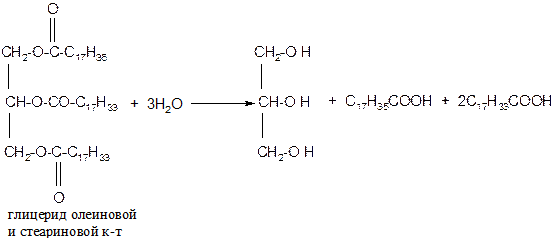
б) щелочной гидролиз жиров (омыление)
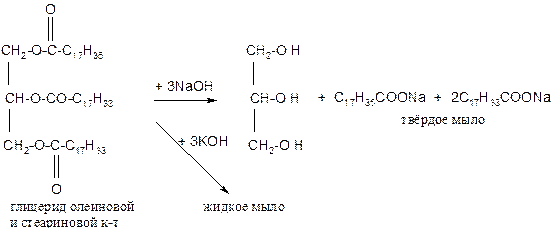
2. Гидрогенизация жиров – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жидкие жиры превращаются в твёрдые (эту реакцию проводят на маргариновых заводах)
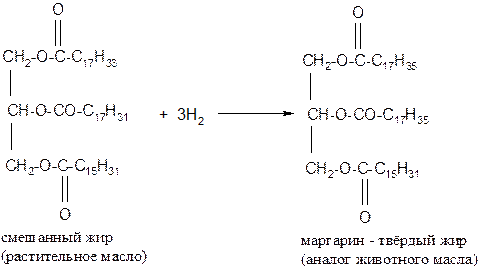
3. Жидкие жиры, взаимодействуя с кислородом воздуха, способны образовывать твёрдые плёнки – сшитые полимеры
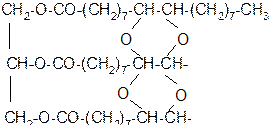
4. При длительном хранении под действием влаги, кислорода воздуха, света и тепла жиры приобретают неприятный запах и вкус. Этот процесс называется ²прогорканием². Неприятный запах и вкус обусловлены появлением в жирах продуктов их превращения – свободных жирных кислот, гидроксикислот, альдегидов и кетонов.
Мыла
Мылами называются соли высокомолекулярных органических кислот. Обыкновенные мыла состоят, в основном, из смеси натриевых солей пальмитиновой (C15H31COOH), стеариновой (C17H35COOH) и олеиновой (C17H33COOH). Калийное мыло имеет вид мази и носит название жидкого мыла. Обычное мыло получают с помощью реакции “омыления” жиров.
В жёсткой воде (содержащей ионы кальция и магния) моющая способность мыла уменьшается. Взаимодействуя с ионами кальция и магния, мыла образуют нерастворимые кальциевые и (или) магниевые соли
2C17H35COO- + 2Na+ + Ca2+ + 2HCO3- → (C17H35COO)2Ca +2Na+ + 2HCO3-
В результате этого мыло образует вместо пены плёнку на поверхности воды и расходуется бесполезно.
Примеры решения типовых задач
Пример № 1. Рассчитайте массы пропанола-1 и муравьиной кислоты, которые надо взять для получения пропилформиата объёмом 200 мл (плотность эфира 0,906 г/мл).
Решение: Вычисляем массу эфира НСООС3Н7, который требуется получить:
 1. m(эфира) = V(эфира) ×r(эфира);
1. m(эфира) = V(эфира) ×r(эфира);
m(эфира) = 200 мл × 0,906 г/мл = 181,2 г
2. Количество вещества эфира, который требуется получить:
n(эфира) = 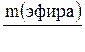 ; n(эфира) =
; n(эфира) = 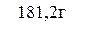 = 2,06 моль
= 2,06 моль
3. Составляем уравнение реакции этерификации:

| n(НСООН) = n(эфира); | n(НСООН) = 2,06 моль |
| n (С3Н7ОН) = n(эфира); | n(С3Н7ОН) = 2,06 моль |
4. Вычисляем массу требуемой кислоты:
m(НСООН) = n(НСООН) × М(НСООН)
m(НСООН) = 2,06 моль × 46 г/моль = 94,76 г.
5. Рассчитываем массу спирта, который потребуется для реакции:
m(С3Н7ОН) = n(С3Н7ОН) ×M(С3Н7ОН)
m(С3Н7ОН) = 2,06 моль × 60 г/моль = 123,6 г.
Пример № 2. Грушевая эссенция представляет собой сложный эфир уксусной кислоты с изоамиловым спиртом (с 3-метилбутанолом-1). Какую массу изоамилацетата можно получить при нагревании изоамилового спирта массой 4,4 г и раствора объёмом 3,54 мл с массовой долей уксусной кислоты
96 % и плотностью 1,06 г/мл в присутствии серной кислоты? Выход эфира составляет 80 %.
Решение: Записываем уравнение реакции этерификации:

Определяем количество веществ спирта и кислоты, которые взяты для реакции:
n(C5H11OH) = 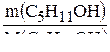 ; n(C5H11OH) =
; n(C5H11OH) = 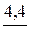 = 0,05 моль
= 0,05 моль
m(СН3СООН) = V×r; m(СН3СООН) = 3,54 × 1,06 г = 3,75 г
n(СН3СООН) = 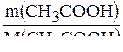 ; n(СН3СООН) =
; n(СН3СООН) = 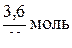 = 0,06 моль
= 0,06 моль
Следовательно, уксусная кислота взята в избытке. Из уравнения реакции следует:
n(эфира) = n (C5H11OH); n(эфира) = 0,05 моль
Определяем массу полученного эфира:
m(эфира) = n(эфира) × М(эфира);
m(эфира) = 0,05 × 130 г = 6,5 г
Учитывая выход продукта, находим массу реально полученного эфира:
mр(эфира) = 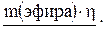 mр(эфира) =
mр(эфира) = 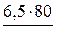 = 5,2 г
= 5,2 г
Пример № 3. На гидролиз смеси этиловых эфиров уксусной и муравьиной кислот массой 7,22 г было израсходовано 33,3 мл 10 %-ного раствора гидроксида натрия (d= 1,08 г/мл). Вычислите массовые доли эфиров в смеси.
Решение: Сначала найдём количество гидроксида натрия:
n(NaOH) = m(NaOH) / M(NaOH) = {m(раствора) ∙w} / M(NaOH) =
= {V(раствора) ∙d∙ w} / M(NaOH) = {33,3 мл ∙ 1,08 г/мл ∙ 0,1} : 40 г/моль = 0,09 моль.
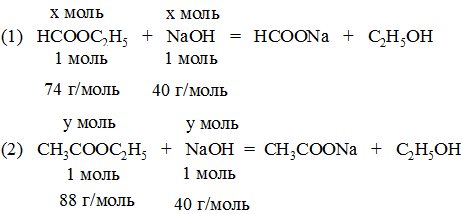
Введём обозначения:
n(HCOOC2H5) = x моль,
n(СH3COOC2H5) = y моль
Тогда для NaOH в реакциях (1) и (2) будут участвовать:
n1(NaOH) = x моль и n2(NaOH) = y моль
или суммарно: n(NaOH) = (x + y) моль.
Масса смеси исходных эфиров, участвовавших в реакции, равная 7,22 г, будет складываться из m(HCOOC2H5) и m(СH3COOC2H5):
m(HCOOC2H5) = n(HCOOC2H5) ∙M(HCOOC2H5) = x моль ∙ 74 г/моль
m(СH3COOC2H5) = n(СH3COOC2H5) ∙M(СH3COOC2H5) = y моль ∙ 88 г/моль
Составим, а затем решим систему уравнений:
74x + 88y = 7,22
x + y = 0,09
x = 0,05 моль; y = 0,04 моль
Отсюда рассчитаем сначала массу каждого из эфиров, а затем их содержание в смеси (массовую долю w1 и w2):
m(СH3COOC2H5) = n х M = 0,04 моль ∙ 88 г/моль = 3,52 г
w1 = m(HCOOC2H5) :m(смеси) = 3,7 : 7,22 = 0,512 (51,2%)
w2 = m(СH3COOC2H5) : m(смеси) = 3,52 : 7,22 = 0,488 (48,8%)
Ответ: w1 = 0,512 (51,2%); w2 = 0,488 (48,8%).
Упражнения и задачи для самостоятельной работы
246. Составьте уравнения реакций получения эфиров:
| а) метилформиата; | в) пропилпропионата; |
| б) этилпропионата; | г) пропилформиата. |
247. Какие продукты реакции образуются:
а) при гидролизе этилформиата;
б) при восстановлении водородом метилпропионата.
Напишите уравнения реакций.
248. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
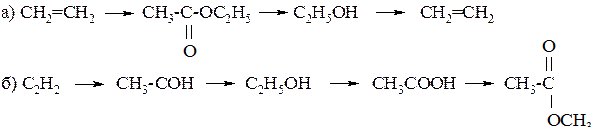
248. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
этилацетат ® ацетат натрия ® уксусная кислота ® метилацетат
При каких условиях протекают эти реакции?
249. Напишите уравнения реакций, при помощи которых из этилацетата можно получить этан.
250. Определите соединения А, В, С, Д. Напишите уравнения реакций:
СН4  А
А  В
В  С
С 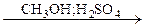 Д
Д
251. Напишите уравнения реакций, укажите условия их проведения:
CH4 ® X ® С6Н12О6 ® Y ® СН3СООС2Н5 ® Z ® СН4
252. Напишите уравнения реакций, укажите условия их проведения:
CH4 ® X ® СН3СНО ® Y® СН3СООСН3 ®Z® НСОН
253. Напишите уравнения реакций, укажите условия их проведения:
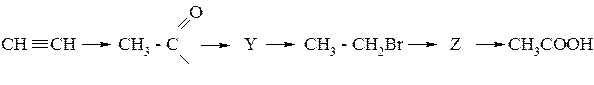
254. Определите соединения А, В, С, Д. Напишите уравнения реакций:
С2Н2  А
А 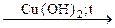 В
В 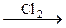 С
С 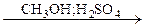 Д
Д
255. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:


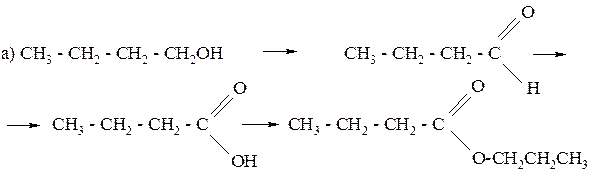
б) этилацетат ® ацетат натрия ® уксусная кислота ® метилацетат
256. Закончите уравнения реакций:
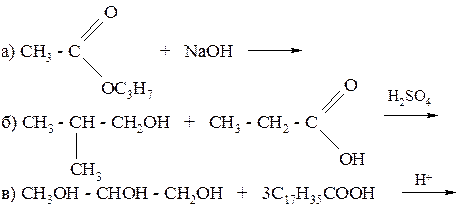
257. Проведите омыление жира:


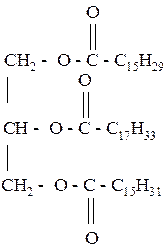
| а) гидроксидом калия | б) водой |
258. Напишите структурную формулу сложного эфира, образованного глицерином с пальмитиновой, стеариновой и масляной кислотами.
259. Сколько г метилформиата можно получить из раствора спирта массовой долей 80 % и раствора массой 20 г кислоты массой 57,5 г с массовой долей 40 %, если выход его составляет 90 %.
260. Сколько г этилового спирта необходимо взять для получения уксусноэтилового эфира массой 35,6 г, если выход продукта составляет 80 % от теоретического?
261. При гидролизе смеси этиловых эфиров уксусной и муравьиной кислот массой 5,6 г потребовался раствор гидроксида натрия (плотность 1,08 г/мл) объемом 25,96 мл с массовой долей NaOH 10 %. Определите массовую долю смеси.
262. Сколько г метилформиата можно получить из 40 г спирта с массовой долей 96 % и кислоты массой 60 г с массовой долей 40 %, если выход его 90 % от теоретического?
263. Сколько кг глицерина можно получить при гидролизе природного жира массой 17,8 кг (тристеарата глицерина), содержащего 3 % примесей?
264. Рассчитайте объём водорода, приведенный к нормальным условиям, который потребуется для гидрирования триолеата массой 132,6 г до предельного жира. Учтите, что водород берется в двукратном избытке (по объему).
265. Стеарат калия – важный компонент жидкого мыла. Рассчитывайте массы гидроксида калия и тристеарата, который потребуется для получения стеарата калия массой 805 г. Массовая доля выхода продукта составляет 80 % из–за производственных потерь.
266. При нагревании метанола массой 2,4 г и уксусной кислоты массой 3,6 г получен метилацетат массой 3,7 г. Определите массовую долю выхода эфира.
267. Рассчитайте массу этилацетата, который можно получить из этанола массой 1,61 г и уксусной кислоты массой 1,8 г (реакция этерификации), если выход продукта равен 75 %.
268. Образец жира, представляющий собой триолеат, подвергли гидролизу. Какая масса жира была взята, если на гидрирование полученной кислоты затратили 336 л водорода?
269. Сколько кг жира трибутирата получился при взаимодействии глицерина массой 27,6 г с масляной кислотой?
270. Какую массу триолеина необходимо подвергнуть гидролизу для образования олеиновой кислоты массой 169,2 г?
271. Сколько мл 2М раствора гидроксида натрия надо затратить при гидролизе тристеарата, чтобы получить стеарат натрия массой 15,3 г?
272. При взаимодействии смеси уксусной и муравьиной кислот с этиловым спиртом (плотность 0,8 г/мл) объёмом 23 мл (реакцию проводят в присутствии минеральной кислоты) образовалась смесь эфиров массой 32,4 г. Определите % содержание муравьиной и уксусной кислоты в смеси?
273. Какой объем 25 % - ного раствора гидроксида калия (плотность 1,23 г/мл) нужно затратить на проведение гидролиза смеси массой 15 г, состоящей из этилового эфира уксусной кислоты и метилового эфира пропионовой кислоты?
274. Какая масса жира потребуется для получения 36,8 г глицерина (путем щелочного омыления), если принять, что жир представляет собой чистый тристеарин и массовая доля омыления жира составляет 80 %?
275. При взаимодействии 4,8 г метанола и 7,2 г уксусной кислоты получили 7,4 г сложного эфира. Рассчитайте массовую долю выхода эфира.
276. Какой объём водорода расходуется на превращение жира (триолеата) массой 5 кг в твёрдый жир, если объёмная доля производственных потерь водорода составляет 8 %.
277. Найдите молекулярную формулу сложного эфира, содержащего (по массе) 54,4 % углерода, 36,4 % кислорода и 9,2 % водорода. Относительная плотность его паров по водороду равна 44. Напишите структурные формулы всех сложных эфиров, отвечающих этой молекулярной формуле.
278. Какой объём этанола плотностью 0,8 г/мл требуется для получения 120г этилового эфира масляной кислоты?
279. Сколько мл 2М раствора гидроксида калия надо затратить при гидролизе тристеарата, чтобы получить стеарат натрия массой 25,3 г?
Дата: 2018-12-21, просмотров: 648.