КАРБОНОВЫЕ КИСЛОТЫ – органические соединения, содержащие карбоксильную группу:
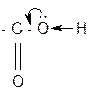
Карбоксильная группа –СООН состоит из карбонильной группы С=О и гидроксильной группы −ОН. В группе С=О атом углерода несёт частичный положительный заряд и притягивает к себе неподелённую электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О−Н ослабевает. В свою очередь, группа ОН ²гасит² положительный заряд на группе С=О, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Получение
1. Окисление альдегидов и первичных спиртов
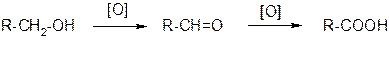
2. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода
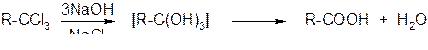
3. Из цианидов (нитрилов). Этот способ позволяет наращивать углеродную цепь

Метилцианид при нагревании легко гидролизуется с образованием ацетата аммония

При подкислении раствора выделяется кислота

4. Использование реакции Гриньяра по схеме

5. Гидролиз сложных эфиров
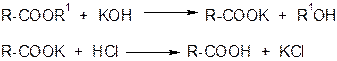
6. Гидролиз ангидридов кислот
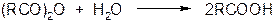
7. Для отдельных кислот существуют специальные способы получения:
а) муравьиную кислоту получают при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением с последующей обработкой формиата Na сильной кислотой

б) уксусную кислоту получают каталитическим окислением бутана кислородом воздуха

в) бензойную кислоту получают окислением алкилбензола
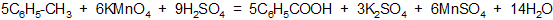
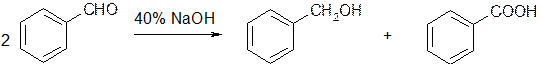
или из бензальдегида с помощью реакции Канниццаро
Химические свойства
Карбоновые кислоты более сильные кислоты, чем спирты, так как благодаря влиянию группы СО атом водорода в карбоксильной группе обладает большей подвижностью.
1. Монокарбоновые кислоты ведут себя как одноосновные кислоты. В водном растворе они диссоциируют

Тем не менее, карбоновые кислоты – это слабые кислоты.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на её кислотность из-за оказываемого ими индуктивного эффекта.
Хлор или фенильный радикал оттягивают на себя электронную плотность (вызывают отрицательный индуктивный эффект –I эф.). Это приводит к повышению кислотности.
Алкильные группы обладают электронодонорными свойствами и создают положительный индуктивный эффект +I эф. Эти группы понижают кислотность. Дикарбоновые кислоты более сильные, чем карбоновые из-за взаимного влияния атомов в дикарбоновых кислотах.

2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных (минеральных) кислот:
а) карбоновые кислоты реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
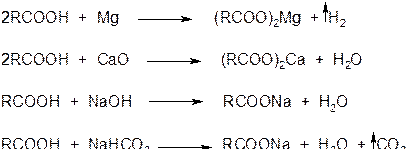
б) карбоновые кислоты – слабые кислоты, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:

в) соли карбоновых кислот в водных растворах гидролизованы

3. Образование функциональных производных карбоновых кислот:
а) хлорангидриды получают действием фосфора (V) на кислоты
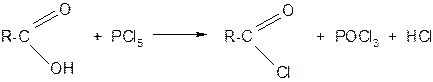
б) ангидриды образуются из карбоновых кислот при действии водоотнимающих средств
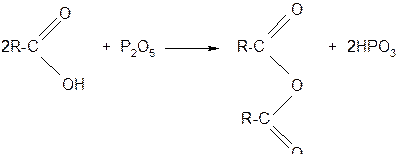
в) сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации)
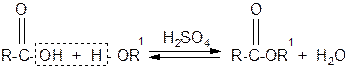
или при взаимодействии хлорангидридов кислот с алкоголятами щелочных металлов
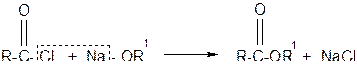
г) амиды кислот образуются при взаимодействии хлорангидридов карбоновых кислот с аммиаком
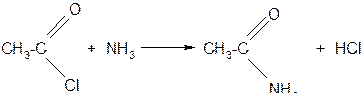
или при нагревании аммонийных солей
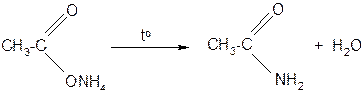
д) при нагревании амидов в присутствии водоотнимающих средств образуются нитрилы
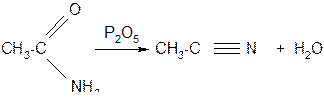
Функциональные производные низших кислот – летучие жидкости. Все они гидролизуются с образованием исходных кислот:
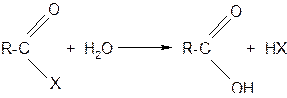
4. Ряд свойств карбоновых кислот обусловлен наличием у них углеводородного радикала:
а) при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещённые кислоты. На галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (a-углеродном атоме):
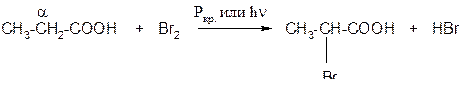
б) непредельные карбоновые кислоты способны к реакциям присоединения
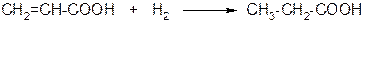
в) непредельные карбоновые кислоты могут вступать в реакции полимеризации
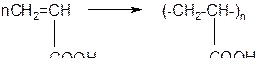
5. Окислительно-восстановительные реакции карбоновых кислот:
а) карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже в углеводороды
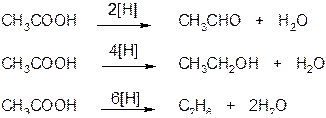
б) насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота.
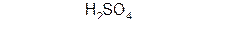
Муравьиная кислота отличается рядом особенностей, т. к. в её составе есть альдегидная группа
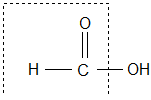
Муравьиная кислота – сильный восстановитель и легко окисляется до СО2. Она может вступать в реакцию ²серебряного зеркала²:
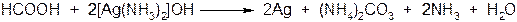
или
Муравьиная кислота окисляется хлором

в) в атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О

6. Реакции декарбоксилирования:
а) насыщенные незамещённые монокарбоновые кислоты из-за большой прочности связи С − С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление солей щелочных металлов карбоновой кислоты со щёлочью
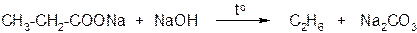
б) электронодонорные заместители в углеводородном радикале способствуют реакции декарбоксилирования
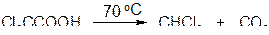
в) двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании
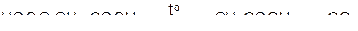
Примеры решения типовых задач
Пример № 1. Рассчитайте объём уксусной эссенции (плотность 1,07 г/см), которую надо разбавить водой для приготовления столового уксуса объёмом 500 мл (плотность 1,007 г/мл). Массовая доля уксусной кислоты в уксусной эссенции равна 80 %, а в уксусе – 6 %.
Решение.
1. Определяем массу раствора уксуса, который надо приготовить:
m2 = V2×r2; m2 = 500 × 1,007 = 503,5 г.
2. Вычисляем массу уксусной кислоты, которая содержится в уксусе:
m(СН3СООН) = 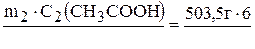 = 30,21 г.
= 30,21 г.
3. Рассчитываем массу уксусной эссенции, которая содержит уксусную кислоту массой 30,21 г:
m1= 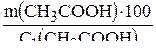 ; m1 =
; m1 = 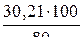 = 37,76 г.
= 37,76 г.
4. Находим объём уксусной эссенции, которую надо разбавить для приготовления уксуса:
V1 = 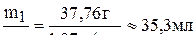
Ответ: 35,5 мл.
Пример № 2. На нейтрализацию предельной одноосновной кислоты массой 7,4 г затрачен раствор с массовой долей гидроксида калия 40 % объёмом
10 мл и плотностью 1,4 г/мл. Определите формулу кислоты.
Решение:
1. Вычисляем массу раствора гидроксида калия, затраченного на нейтрализацию кислоты:
m = V×r; m = 10 г × 1,4 г/мл = 14 г
2. Определяем массу гидроксида калия, содержащегося в растворе:
m(КОН) = 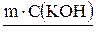 ; m(КОН) =
; m(КОН) = 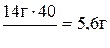
3. Количество вещества КОН составляет:
n(КОН) = 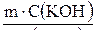 ; n(КОН) =
; n(КОН) = 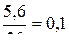 моль
моль
4. Молярную массу кислоты А можно представить в следующем виде:
М(А) = (х + 1)М(С) + (2х + 1 + 1)М(Н) + 2М(О);
М(А) = [(х + 1)12 + (2х + 2) × 1 + 2 × 16] г/моль = (14х + 46) г/моль
5. Рассчитываем количество вещества кислоты, взятой для реакции:
n(А) = 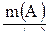 ; n(А) =
; n(А) = 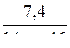 ;
;
6. Составляем уравнение реакции нейтрализации кислоты:
СхН2х+1СООН + КОН ® СхН2х+1СООК + Н2О
Из этого уравнения реакции следует, что n(КОН) = n(А), отсюда:
0,1 = 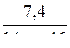 ;
;
Решая это уравнение, находим, что х = 2.
Таким образом, формула кислоты − С2Н5СООН (пропионовая кислота).
Пример № 3. Вычислите массу уксусной кислоты, которую можно получить из 44,8 л (н.у.) ацетилена, если потери на каждой стадии получения составляют в среднем 20 %.
Решение:
C2H2 + H2O → CH3CHO → CH3COOH
1моль 1 моль 1 моль
n(CH3COOH)теор = n(C2H2) = V(C2H2) / VM = 44,8 л : 22,4 л/моль = 2 моль
n(CH3COOH)практ = n(CH3COOH)теор∙h1∙∙h2 = 2 моль∙ 0,8 ∙ 0,8 = 1,28 моль
Масса уксусной кислоты с учетом всех потерь составит:
m(CH3COOH) = n(CH3COOH)практ∙ M(CH3COOH) = 1,28 моль∙ 60 г/моль = 76,8 г
Ответ: m(CH3COOH) = 76,8 г.
Пример № 4. При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Решение:
1. CnH2n+1COOH + NaHCO3 → CnH2n+1COONa + H2O + CO2
2. Найдем количество вещества СО2
n(CO2) = V/Vm = 5,6л : 22,4 л/моль = 0,25 моль
3. n(CO2) = n(кислоты) = 0,25 моль (из уравнения видно это соотношение 1:1), тогда молярная масса кислоты равна:
M(к-ты) = m/n = 25,5г : 0,25 моль = 102г/моль
М(к-ты) = 12n+2n+1+12+16+16 (из общей формулы),
М = Ar(C)∙ n + Ar(H)∙ n + Ar(O)∙ n = 12∙n + 1∙(2n+1)+ 12+16+16+1)
М(к-ты) = 12n +2n +46 = 102; n = 4; Формула кислоты С4Н9СООН.
Упражнения и задачи для самостоятельной работы
211. Предложите способ получения уксусной кислоты из неорганических веществ.
212. Расставьте по силе кислоты: уксусная кислота; хлоруксусная кислота; пропановая кислота; дихлоруксусная кислота.
213. Каков механизм образования хлоруксусной кислоты при действии хлора на уксусную кислоту? В каких условиях будет идти эта реакция?
214. Сколько изомерных одноосновных карбоновых кислот может соответствовать формуле С6Н12О2? Напишите структурные формулы этих кислот и назовите их по систематической номенклатуре.
215. Напишите структурные формулы следующих кислот:
а) 2-метилпропановая кислота; в) 2,3,4-трихлорбутановая кислота;
б) 3,4-диметилгептановая кислота.
216. С помощью каких реакций можно осуществить превращения по следующим схемам:
а) метанол ® Х ® формиат натрия;
б) уксусный альдегид ® Y ® ацетат кальция
217. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН4 ® СН3Cl ® СН3ОН ® НСОН ® НСООН ® СО2
Укажите условия протекания реакций.
218. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
СН4 ® Х ® Y ® уксусная кислота
Назовите вещества Х и Y.
219. Каким образом можно осуществить реакции: ацетат натрия ® уксусная кислота ® хлоруксусная кислота? Напишите уравнения реакции.
220. Как можно получить пропионовую кислоту из бромэтана?
221. Вычислите массу уксусной кислоты, затраченной на реакцию с раствором гидроксида натрия массой 120 г с массовой долей щёлочи 25 %.
222. Напишите структурные формулы следующих кислот:
| а) 3-метил-2-этилгексановая кислота; | б) 4,5-диметилоктановая кислота; |
| в) 2,2,3,3-тетраметилпентановая кислота. | |
223. С помощью каких химических реакций можно осуществить следующие превращения:
а) CH4 ® CH3Cl ® CH3OH ® HCOH ® HCOOH ® CO2
б) CH4 ® C2H2 ® CH3COH ® CH3 – COOH ® CH2Cl – COOH
224. Напишите уравнения реакции между следующими веществами:
| а) 2-метилпропановой кислотой и хлором; | б) уксусной кислотой и пропанолом-2; |
| в) 2-метилбутановой кислотой и PCl5. | |
225. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) СН4 ® С2Н6 ® С2Н4 ® СН3СОН ® С2Н5ОН ® СН3СООН
б) СаС2 ® С2Н2 ® С2Н6 ® СН3СОН ® СН3СООН ® СН3СООС2Н5
226. Сколько раствора этилового спирта (плотностью 0,8 г/мл) с массовой долей С2Н5ОН 96 % нужно взять для получения уксусной кислоты массой
30 кг?
227. Сколько литров водорода вступит в реакцию с уксусной кислотой для получения ацетальдегида массой 10 г?
228. Определите массу технической уксусной кислоты с массовой долей примесей 10 %, необходимой для получения уксусного альдегида массой 10,2 г.
229. Какой объём раствора гидроксида натрия плотностью 1,09 г/мл с массовой долей NaOH 20 % необходим для нейтрализации уксусной кислоты с массовой долей СН3СООН 20 % массой 500 г?
230. Какой объём водорода при нормальных условиях выделится при действии на уксусную кислоту магния массой 8 г?
231. В результате каталитического окисления пропана получена пропановая кислота массой 55,5 г. Массовая доля выхода продукта равна 60 %. Рассчитайте объём взятого пропана.
232. При пропускании хлора в раствор уксусной кислоты (массовая доля СН3СООН равна 75 %) получена хлоруксусная кислота. Определите её массовую долю в растворе, считая, что избыточный хлор и хлороводород удалены из него.
233. Уксусную кислоту получают окислением бутана кислородом воздуха в присутствии катализатора. Рассчитайте массу раствора кислоты (массовая доля СН3СООН 80 %), который можно получить из бутана объёмом 67,2 л (н.у.). Массовая доля выхода кислоты равна 75 %.
234. При окислении муравьиной кислоты получили газ, который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 20 г. Какая масса муравьиной кислоты взята для окисления?
235. Окислением пропанола-1 массой 7,2 г получили пропионовую кислоту, на нейтрализацию которой затратили раствор объемом 16,4 мл с массовой долей гидроксида натрия 20 % и плотностью 1,22 г/мл. Определите выход кислоты.
236. При каталитическом окислении ацетальдегида кислородом получили уксусную кислоту, выход которой составил 75 %. Эта кислота прореагировала с избытком карбоната натрия. Выделился газ, образовавший с гидроксидом натрия кислую соль массой 5,04 г. Определите объём кислорода (н.у.), вступившего в реакцию с альдегидом.
237. Объёмная доля метана в природном газе составляет 96 %. Какую массу муравьиной кислоты можно получить каталитическим окислением природного газа объёмом 420 л (н.у.), если выход кислоты составляет 70 %?
238. На нейтрализацию смеси муравьиной и уксусной кислот израсходовано 10 мл раствора гидроксида калия с массовой долей 0,4 и плотностью 1,4 г/мл. При взаимодействии такого же количества смеси с избытком аммиачного раствора оксида серебра образовалось 8,64 г серебра. Определите массовую долю уксусной кислоты в смеси.
239. Через раствор уксусной кислоты массой 150 г пропустили аммиак объёмом 4,48 л (н.у.). Определите массовую долю СН3СООН в полученном растворе, если в исходном растворе массовая доля кислоты составляла 20 %.
240. Для получения уксусной кислоты в качестве исходного вещества был использован технический карбид кальция с массовой долей примесей 4 %. Какая масса карбида кальция была израсходована, если известно, что на нейтрализацию полученной уксусной кислоты потребовалось 5,5 М раствора гидроксида калия (плотность 1,2 г/мл) массой 240 г?
241. На нейтрализацию 0,1 моль карбоновой кислоты с молярной массой 90 г/моль израсходовано 8 г едкого натра. Найдите молекулярную формулу кислоты и определите её основность.
242. При взаимодействии 71,15 мл 30 %-ного раствора (плотность
1,04 г/см3) неизвестной органической одноосновной кислоты с избытком гидрокарбоната натрия выделилось 6720 мл газа (н.у.). Определите, какая кислота находилась в растворе.
243. При нагревании 26,8 г смеси этилового спирта и уксусной кислоты с несколькими каплями концентрированной серной кислоты получено 14,08 г сложного эфира, а при сжигании того же количества смеси уксусной кислоты и спирта образовалось 23,4 г воды. Найдите процентный состав исходной смеси и рассчитайте выход эфира в процентах.
244. Какова структурная формула предельной одноосновной кислоты, если объём CO2, образующегося при сжигании некоторого её количества, в три раза больше объёма CO2, выделившегося при действии на такое же количество данной кислоты избытка водного раствора гидрокарбоната натрия?
245. При окислении 37 г первичного спирта получено 44 г одноосновной карбоновой кислоты алифатического ряда с тем же числом углеродных атомов в молекуле, что и у исходного спирта. Определите строение возможных продуктов реакции.
Дата: 2018-12-21, просмотров: 505.