Растворимость - способность веществ равномерно распределяться в виде атомов, молекул или ионов по всему объему растворителя. Количественно растворимость S выражается максимальным числом граммов вещества, которое растворяется в 100г Н2О при данной температуре. При этом получается насыщенный раствор.
Растворение кристаллических веществ в воде - процесс обратимый, протекающий одновременно в двух противоположных направлениях: переход вещества из твердой фазы в раствор (растворение) и выделение частиц растворенного вещества из раствора (кристаллизация). С течением времени скорости обоих процессов выравниваются и, при данной температуре, устанавливается динамическое равновесие осадок « раствор. При изменении температуры равновесие нарушается, т.к. растворимость веществ зависит от температуры (в большинстве случаев увеличивается с ростом температуры).
Равновесие осадок « насыщенный раствор малорастворимых соединений характеризуют величиной, называемой произведением растворимости (ПР).
Например, в насыщенном растворе ВаSO4 устанавливается равновесие:
ВаSO4 « Ва2+ + SO42-
осадок раствор
Применив к этому равновесию закон действующих масс, можно записать:
К=[Ва2+][SO42-] / [BaSO4] или
К[ВаSO4] = [Ba2+][SO42-] (1),
где К - константа равновесия.
Так как в насыщенном растворе концентрация молекул сульфата бария [ВаSO4] - величина постоянная, то постоянно и произведение величин, стоящих в левой и правой частях уравнения (1):
ПР=[Ва2+][SO42-].
Таким образом, ПР-постоянная величина, равная произведению концентраций ионов малорастворимого электролита в его насыщенном растворе.
Если при диссоциации молекулы электролита образуется несколько одинаковых ионов, то в выражении ПР их концентрации возводятся в соответствующую степень. Например:
Са3(РО4)2 «3Са2+ + 2РО43-
ПР =[Са2+]3×[РО43-]2
Са3(РО4)2
С помощью ПР решаются многие вопросы, связанные с образованием или растворением осадков. Из уравнения (1) видно, что при введении в насыщенный раствор ионов Ва2+ или SO42-, например, путем добавления другого электролита, содержащего либо ионы Ва2+, либо SO42-, равновесие сместится влево - в сторону образования осадка. И, наоборот, если один из ионов выводить из раствора, например, связав его в нерастворимое или малодиссоциированное соединение, то равновесие сместится вправо - осадок ВаSO4 будет растворяться. Таким образом,
- условием образования осадка малорастворимого электролита является превышение произведения концентраций ионов в растворе над его произведением растворимости,
- а условием растворения осадка - превышение значения ПР над произведением концентраций ионов.
Исходя из значений ПР можно также вычислить растворимость S (в моль/л) малорастворимых электролитов.
Примеры решения задач
Пример 1. Определить ПР фторида магния, если его растворимость в воде при некоторой температуре равна 0,001 моль/л.
Решение. В насыщенном растворе фторида магния устанавливается равновесие
MgF2 « Mg2+ + 2F-
осадок раствор
По уравнению видно, что при растворении какого-то числа молей MgF2 в жидкой фазе появляется такое же число молей ионов Mg2+ и вдвое большее число молей ионов F-. Значит, произведение растворимости данной соли можно выразить через ее растворимость следующим образом:
ПР= [Mg2+][F-]2 = S × (2S)2=4S3
Тогда
ПР=4× (0,001)3=4× 10-9
Пример 2. ПР иодида свинца при 200С равно 8 . 10-9. Вычислить растворимость соли. Сколько граммов ионов J- содержится в 200 мл насыщенного раствора ?
Решение
PbI2 « Pb2+ + 2I-
осадок раствор
Выразим ПР иодида свинца через растворимость. По уравнению: в насыщенном растворе содержится S моль/ л ионов Рb2+ и 2S моль/л I-. Отсюда
ПР PbI2 = [Pb2+][I-]2= S × (2S)2 =4S3
и
S= (ПР PbI2 /4)1/3 = (8×10-9/ 4)1/3 = 1,3×10-3 моль/л
Поскольку концентрация ионов I- в растворе 2S моль/ л, молярная масса ионов иода 127г/ моль, то в 0,2 л раствора содержится 2 . 1,3 . 10-3×127×0,2 = 0,066 г ионов I-.
Пример 3. Определить, выпадет ли осадок фосфата серебра при смешивании 200 мл раствора AgNO3 с концентрацией 5 . 10-5 моль/ л и 100 мл раствора фосфата калия с концентрацией 1,5×10-7 М. ПР Ag3PO4 = 1,3 . 10-20
Решение
Ag3PO4«3Ag+ + PO43-
Осадок выпадет, если произведение концентраций ионов [Ag+]3×[PO43-] в конечном растворе будет больше ПР Ag3PO4.
Концентрации ионов после смешения раствора составят:
[Ag+]= C Ag+ × V1 / (V1 + V2),
[PO43-]=C (PO4 )3- × V2 / (V1 + V2),
где С Ag+ - концентрация ионов серебра в растворе AgNO3;
C (PO4 )3- - концентрация фосфат-ионов в растворе К3РО4,
V1- объем раствора AgNO3, V2- объем раствора К3РО4.
Из уравнений диссоциации АgNO3 ®Ag+ + NO3- и К3РО4 ®3К++РО43- следует, что из одного моля каждой соли в раствор переходит по одному молю ионов Аg+ и РО43- соответственно. Значит, САg+= 5 . 10-5 моль/ л и СРО3-4=1,5.10-7 моль/ л. Тогда
[Ag+]3[PO43-] = (C Ag+. V1 / (V1 + V2))3. C (PO4 )3- . V2 / (V1 + V2) =
= (5.10-5. 0,2 / (0,2+0,1))3. (1,5.10-7.0,1)/( 0,2+0,1)=1,85.10-21
Найденное значение произведения концентраций ионов меньше значения
ПР Ag3PO4 , следовательно, раствор будет ненасыщенным относительно фосфата
серебра, и осадок не образуется.
Задачи
121. Произведение растворимости ПРZn(OH)2 = 5´10-17. Выпадает ли осадок, если смешать 20 мл 0,02 н раствора ZnSO4 с 80 мл 0,01 раствора NaOH?
122. Вычислить растворимость сульфата бария в 0,1 М растворе сульфата натрия, если ПРBaSO4 = 10-10.
123. Произведение растворимости ПРMg (OH)2 =3´10-11. Выпадает ли осадок, если к 2 л раствора Mg(NO3)2 , содержащего 1,48 г этой соли, добавить 1 л 0,05 н раствора NaOH.
124. Произведение растворимости ПРPbI2 = 1,35´10-8. Вычислить растворимость PbI2 и концентрацию ионов Pb2+ и I-.
125. Произведение растворимости ПРCаSO4 = 6.26´10-5. Выпадает ли осадок, если смешать 100 мл 0,04 и раствора CaCl2 со 100 мл 0,02 и раствора Na2SO4 ?.
126. Определить, во сколько раз растворимость CaSO4 в 0,01М растворе Na2SO4 меньше, чем в чистой воде, если ПРCaSO4 =6.26´10-5 .
127. К 1 л 0,1 М раствора HCl прибавили 1 мл 0,01 М раствора AgNO3 . Выпадет ли при этом осадок AgCl, если ПРAgCl = 1.6´10-10?
128. Сколько граммов ионов Ba2+ содержится в 200 мл насыщенного раствора карбоната бария, если ПРBaCO3 = 8*10-9?
129. Вычислить ПРMg (OH)2, если его растворимость равна 2´10-4 моль/л.
130. Произведение растворимости ПРCaCO3 = 1.7´10-8. Вычислите растворимость карбоната кальция и концентрацию ионов Ca2+ и CO2-3 .
ХIII. Гидролиз солей
Реакции гидролиза являются частным случаем ионообменных реакций между электролитами.
Ионообменные реакции в растворах электролитов протекают в том случае, если в качестве продуктов образуются:
а) малорастворимые соединения- осадки (AgJ, BaSO4, CaF2 и др.);
б) слабодиссоциирующие соединения (CH3COOH, NH4OH и др.),
ионы (HCO3-, HPO42-, MgOH+ и др.);
в) газы (СО2, H2S, NH3 и др.).
При выводе молекулярно-ионных уравнений сильные электролиты записываются в виде отдельных составляющих их ионов, так как именно в таком состоянии они находятся в растворе; слабодиссоциирующие соединения - молекулы или сложные ионы, а также малорастворимые соединения и газы - записываются в недиссоциированном состоянии.
Примеры ионообменных реакций:
а) CaCl2+2AgNO3=2AgCl¯+Ca(NO3)2
Ag+ +Cl-=AgCl;
б) CH3COONa+HCl=CH3COOH+NaCl
CH3COO-+H+=CH3COOH;
в) Na2SO3+2HCl=2NaCl+H2SO3(SO2 +H2O)
SO32-+2H+=SO2+H2O.
Гидролизом называется обменное взаимодействие вещества с водой. Один из важнейших его случаев - гидролиз солей - это обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением rH cреды.
Любую соль удобно рассматривать как продукт ионообменной реакции между соответствующими кислотами и основаниями (реакция нейтрализации).
Например,
2HCl+Zn(OH)2=ZnCl2+2H2O
H2S+2NaOH=Na2S+2H2O
Гидролиз – реакция, обратная реакции нейтрализации.
Гидролизу подвергаются соли, образованные: а) слабой кислотой и сильным основанием, среда при этом становится щелочной (rH>7); б) слабым основанием и сильной кислотой, среда при этом становится кислой (rH<7); в)слабой кислотой и слабым основанием, среда в этом случае слабокислая или слабощелочная, что зависит от соотношения констант диссоциации кислоты и основания, образующих соль.
Соли, образованные сильными кислотами и основаниями, не подверга-
ются гидролизу. В этом случае имеет место лишь диссоциация соли, rH среды не изменяется, оставаясь равным 7.
При обычных условиях гидролиз идет преимущественно по одной ступени, т.е. соотношение ионов соли и молекул воды, вступивших во взаимодействие 1:1. При повышении температуры или разбавлении раствора гидролиз усиливается и для солей, образованных многоосновными кислотами (например, Na3PO4) или многокислотными основаниями (например, FeCl3), в значительной степени возможен гидролиз по второй, третьей ступеням.
Примеры
Пример 1. Составьте ионные и молекулярные уравнения гидролиза солей: а) K2CO3; б) ZnSO4; в) CrCl3; г) BaCl2. Для случая в) принять, что имеет место две ступени гидролиза.
Решение
а) карбонат калия может быть получен взаимодействием KOH и H2CO3. Слабым электролитам является угольная кислота; значит, при гидролизе этой соли с водой будет взаимодействовать кислотный остаток (гидролиз по аниону), образуя слабодиссоциирующие ионы HCO3-:
CO32- + HOH « HCO3- + OH- - ионное уравнение.
Молекулярное уравнение получим, дополняя ионное уравнение катионами K+:
K2CO3 + HOH « KHCO3 + KOH
В растворе появляется избыток ионов OH-, поэтому раствор K2CO3 имеет щелочную реакцию (рН > 7);
б) сульфат цинка – соль сильной серной кислоты и слабого основания Zn(OH)2; значит, при гидролизе этой соли с водой будут взаимодействовать ионы Zn2+ (гидролиз по катиону), образуя слабодиссоциирующие ионы ZnOH+:
Zn2+ + HOH « ZnOH+ + H+ ионное уравнение .
Молекулярное уравнение получаем, дополняя ионное уравнение анионами SO42-:
2ZnSO4 + 2HOH « (ZnOH)2SO4 + H2SO4
В растворе появляется избыток ионов H+ , поэтому раствор ZnSO4 имеет кислую реакцию (pH < 7);
в) хлорид хрома (III) – соль сильной кислоты и слабого основания, т.е. гидролиз идет по катиону:
I ступень
Cr3+ + HOH « CrOH2+ + H+
CrCl3 + HOH « CrOHCl2 + HCl
II ступень
CrOH+ + HOH « Cr(OH)2+ + H+
CrOHCl2 + HOH « Cr(OH)2Cl + HCl
Раствор имеет кислую реакцию (pH< 7);
г) хлорид бария – соль сильной кислоты и сильного основания, гидролизу не подвергается, так как ни Ba2+, ни Cl- не способны взаимодействовать с водой с образованием слабого электролита.
Ионное равновесие воды HOH« H+ + OH- не нарушается, среда остается нейтральной (pH = 7).
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и K2CO3? Составьте ионное и молекулярное уравнение реакции.
Решение
Карбонат натрия гидролизуется по аниону, сульфат алюминия – по аниону, т.е. в растворах этих солей, взятых порознь, имеют место равновесия:
CO32- + HOH « HCO3- + OH-
Al3+ + HOH « AlOH+ + H+
и гидролиз практически ограничивается этой первой стадией. Если смешать эти растворы, то ионы OH- и H+ связываются, образуя молекулу слабого электролита – воды. Уход ионов из сферы реакции смещает оба равновесия вправо и активизирует последующие ступени гидролиза:
HCO3- + HOH « H2CO3 + OH-,
AlOH2+ + HOH « Al(OH)2+ + H+,
Al(OH)2+ + HOH « Al(OH)3 + H+,
т.е. гидролиз по катиону и аниону взаимно усиливают друг друга, что, в конечном счете, приводит к образованию кислоты и основания:
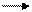 3CO2
3CO2
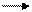 2Al3+ + 3CO32- + 6H2O ® 2Al(OH)3 + 3H2CO3
2Al3+ + 3CO32- + 6H2O ® 2Al(OH)3 + 3H2CO3
3H2O
Молекулярное уравнение:
2Al(NO3)3 + 3K2CO3 + 3H2O ® 2Al(OH)3 + 3CO2 + 6KNO3
Задачи
Составьте молекулярные и ионные уравнения реакции гидролиза и определите реакцию среды раствора:
131. NH4NO3 , Al(CH3COO)3*, Na2SO4
132. KCN, FeCl3*, KNO3
133. AlCl3*, CH3COONa, NaCl
134. CrCl3*, CH3COONH4, Ba(NO3)2
135. ZnCl2, K2S, CaBr2
136. NH4Cl, (NH4)2S, Sr(NO3)2
137. K3PO4*, Cu(NO3)2, KJ
138. FeCl3*, Pb(CH3COO)2, Li2SO4
139. Na2CO3, K2SiO3, KMnO4
140. Na3PO4*, NaCN, NaClO4
*Принять, что имеет место две ступени гидролиза.
Дата: 2018-12-21, просмотров: 435.