В периодической системе Д.И.Менделеева
Смысл периодического закона состоит в следующем:
возрастание положительного заряда ядер элементов приводит к периодическому повторению строения внешних электронных оболочек атомов, а следовательно, к периодическому повторению химических свойств элементов.
Деление элементов на периоды обусловленно числом энергетических уровней: в одном периоде объединены элементы, имеющие одинаковое число энергетических уровней (электронных слоев), равное номеру периода.
Деление на группы и подгруппы обусловленно порядком заполнения электронами уровней и подуровней:
элементы главных подгрупп состоят из S- или р-элементов (т.е. из элементов, у которых заполняются либо S-, либо р-подуровень);
элементы побочных подгрупп состоят из d- или f-элементов (т.е. из элементов, у которых заполняются либо d-, либо f-подуровень).
Номер группы, как правило, указывает максимальное число электронов, которые могут участвовать в образовании химических связей.
Многие свойства элементов (радиус атома, электроотрицательность, степень окисления и др.) связаны со строением электронных оболочек и поэтому, вместе с последними, обладают периодичностью.
В периоде при движении слева направо радиус атомов уменьшается, т.к. при одном и том же числе электронных слоев увеличивается заряд ядра и число электронов на внешнем уровне, а следовательно, увеличивается и сила притяжения электронов ядром, сжимающая атом.
В группах при движении сверху вниз радиус атомов увеличивается, т.к. в этом направлении увеличивается число электронных слоев.
Способность атомов удерживать валентные электроны характеризуется энергией ионизации, сродством к электрону и электроотрицательностью.
Энергия ионизации J - это энергия, которую необходимо затратить для отрыва от атома наиболее слабо связанного с ним электрона.
В периодах энергия ионизации увеличивается слева направо, а в подгруппах (в первую очередь главных)-снизу вверх.
Сродство к электрону Е - это энергия, которая выделяется при присоединении к атому одного электрона.
Сродство к электрону изменяется по периодической таблице, в целом, аналогично изменению энергии ионизации.
Энергия ионизации и сродство к электрону характеризуют металлические (способность отдавать электроны) и неметаллические (способность принимать электроны) свойства элементов.
Более полной и общей характеристикой этих свойств является электроотрицательность элемента (Х).
Х=J+E
Чем меньше электроотрицательность элемента, тем сильнее выражены его металлические свойства и слабее неметаллические.
Примеры решения задач
Пример 1. Какую высшую и низшую степень окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение
Высшую степень окисления элемента определяет номер группы периодической системы, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Данные элементы находятся соответственно в Va, VIa, VIIa группах и имеют структуру внешнего энергетического уровня s2p3, s2p4, s2p5. Низшие степени окисления -3, -2, -1. Примеры H3As-3, Na2Se-2, KBr-1. Высшие степени окисления элементов +5, +6, +7. Примеры соединений H3As+5O4, Se+6O3, KBr+7O4.
Пример 2. Какой из элементов четвертого периода седьмой группы- марганец или бром – проявляет металлические, а какой -неметаллические свойства?
Решение
Электронные формулы элементов
25Mn 1s22s22p63s23p63d54s2
35Br 1s22s22p63s23p63d104s24p5
Марганец -d-элемент VIIб группы, бром -р-элемент VIIa группы. На внешнем уровне марганца два электрона. Атомы элементов с небольшим (1-2) числом электронов на внешнем уровне обычно имеют низкие значения электроотрицательности, поэтому способны лишь к потере электронов, т.е. проявляют металлические свойства. У бора на внешнем уровне 7 электронов, до образования устойчивой восьмиэлектронной оболочки не хватает всего одного электрона, значение электроотрицательности высокое, поэтому более характерным является присоединение электронов, т.е. неметаллические свойства.
Для всех групп, содержащих p- и d-элементы, преобладание металлических свойств у d-элементов является общей закономерностью.
Задачи
51. Что такое энергия ионизации атома? Что она характеризует? Как она изменяется в периодах и в подгруппах с увеличением порядкого номера?
52. Как и почему изменяется энергия ионизации атома в главных и побочных подгруппах?
53. Как изменяются радиусы атомов и положительных ионов в периодах и подгруппах с увеличением порядкового номера? Что такое лантаноидное сжатие?
54. Что такое сродство к электрону? Как изменяется окислительная способность неметаллов в периодах и группах с увеличением порядкого номера?
55. Что такое электроотрицательность? Что она характеризует? Как изменяется электроотрицательность p- элементов в периодах и группах с увеличением порядкового номера?
56. Как изменяются свойства гидроксидов элементов в периодах и группах с увеличением порядкого номера? Почему?
57. С учетом положения элементов в периодической системе ответьте на вопрос: какой из двух гидроксидов является более сильным основанием:
Mg(OH)2 или Ba(OH)2 ; Ca(OH)2 или Fe(OH)2 ?
58. Составьте формулы оксидов и гидрооксидов элементов IIIА подгруппы. Как изменяются свойства этих соединений при переходе от Al к Tl ?
59. Составьте формулу оксидов и гидрооксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяются их свойства при переходе от натрия к сере?
60. Какова современная формулировка периодического закона? В чем причина периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов?
VI. Химическая связь
Образование химической связи между атомами происходит за счет электронов, расположенных на внешнем и предвнешнем (для d- и f-элементов) энергетических уровнях и связанных с ядром наименее прочно. Их называют валентными электронами.
В зависимости от характера распределения электронной плотности в молекуле различают три основных типа химической связи: ковалентную, ионную и металлическую.
Связь, осуществляемая за счет электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Существует два механизма образования ковалентной связи: обменный - за счет неспаренных электронов, находящихся в невозбужденном или возбужденном состоянии, и донорно-акцеторный.
Число связей за счет неспаренных электронов, которые может образовывать атом данного элемента с другими атомами, равно числу этих электронов в основном или возбужденном состоянии. Например, атом углерода в основном состоянии имеет 2 неспаренных электрона и может образовать 2 химические связи, например, с двумя неспаренными электронами атома кислорода (получается молекула С=О):
2р2 2р4



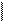


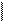
 2s2 2s2 ¯
2s2 2s2 ¯
C ¯ O ¯
В возбужденном состоянии атом углерода имеет на внешнем уровне четыре неспаренных электрона и может образовать 4 химические связи,



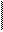
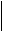
 2р2 2р3
2р2 2р3
2s2 DE 2s2 ¯

 C ¯ ¾® C*
C ¯ ¾® C*
½_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
например, с четырьмя неспаренными электронами двух атомов кислорода (получается молекула О=С=О).
Число образуемых атомом ковалентных связей называется ковалентностью элемента в соответствующем соединении.
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что один из атомов, участвующих в образовании химической связи, предоставляет неподеленную электронную пару (его называют донором), а второй (акцептор)-свободную орбиталь. Примером может служить образование иона аммония NH4+ из молекулы аммиака NH3 и иона водорода Н+:





 Н Н +
Н Н +
. . . .
 Н : N : + H+ ¾¾® Н:N:Н
Н : N : + H+ ¾¾® Н:N:Н
. . . .

 Н Н
Н Н
NH3 – донор, Н+- акцептор
Все связи N-H в ионе аммония равноценны.
Донорно-акцепторный механизм образования ковалентной связи особенно распространен в комплексных соединениях.
Для обоих механизмов образования ковалентной связи справедливо следующее: атом не может образовать ковалентных связей больше, чем число валентных орбиталей.
Ковалентная связь характеризуется длиной (это расстояние между ядрами атомов, образовавших связь), прочностью (она определяется энергией связи - это энергия, которую необходимо затратить для разрыва всех связей в молекулах, составляющих 1 моль вещества), направленностью (все орбитали, кроме S, имеют пространственную направленность, поэтому и связи, образованные за счет перекрывания таких орбиталей, обладают определенной направленностью), полярностью (если общая электронная пара расположена симметрично между ядрами атомов, то связь неполярная - это молекулы, состоящие из атомов одного элемента, если общая электронная пара смещена в сторону более электроотрицательного атома, то связь полярная - это молекулы, образованные атомами разных элементов).
Различают d- и p-ковалентные связи. d-связь – это связь, при образовании которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов. p-связь - это связь, при образовании которой перекрывание электронных облаков происходит вдоль линии, перпендикулярной прямой, соединяющей центры атомов.
Ковалентная связь, образованная одной парой электронов, называется одинарной (простой), двумя - двойной, тремя - тройной. Двойную и тройную связи называют кратными.
Ионной называется химическая связь, осуществляемая за счет сил электростатического притяжения противоположно заряженных ионов. К возникновению ионов приводит большая разница электроотрицательностей (> 1,7) атомов, образующих связь. Поэтому ионная связь возникает между атомами типичных металлов и неметаллов (CsF, BaCl2, Na2O). Например, образование молекулы NaCl можно представить следующим образом:
Na0 - 1e ¾®Na+ , Cl0 + 1e ¾® Cl-, Na+ + Cl- = NaCl
Ионы Na+ и Cl- имеют завершенные (8-электронные) внешние оболочки.
Молекул с чисто ионной связью нет. Даже в молекуле CsF электронная пара лишь на 89% принадлежит фтору, а на 11% - цезию. Поэтому говорят о степени ионности связи.
В отличие от ковалентной ионная связь является ненаправленной и ненасыщенной. Каждый ион способен притягивать, координировать вокруг себя равноценно по всем направлениям ионы противоположного знака. Например, координационное число в кристалле NaCl равно 6, т.е. каждый ион Na+ связан с 6 ионами Cl- и наоборот.
Металлической называется связь, осуществляемая между всеми атомами в кристаллической решетке металла совокупностью обобществленных валентных электронов.
Атомы металлов имеют на внешнем уровне много свободных орбиталей и мало валентных электронов. Валентные электроны имеют возможность беспрепятственно переходить от атома к атому, становятся общими для всех атомов, образующих кристаллическую решетку металла. Совокупность хаотически движущихся обобществленных валентных электронов называют электронным газом. Его высокой подвижностью объясняются такие характерные свойства металлов, как тепло - и электропроводность; отсутствием локализованных химических связей - пластичность и ковкость.
Энергия (прочность) металлической связи растет с увеличением числа валентных электронов и заряда ядра.
Примеры решения задач
Пример 1. Какую валентность, обусловленную неспаренными электронами, может проявлять фосфор в нормальном и возбужденном состояниях ?
Решение
Распределение электронов внешнего энергетического уровня фосфора 3s23p3:

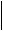


 3d0
3d0
3p3



 3s2
3s2
15P ¯
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного S-электрона на 3d-подуровень:

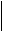
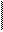

 3d1
3d1
3p3



 3s1
3s1
15P*
Следовательно, в соответствии с числом неспаренных электронов, валентность фосфора в нормальном состоянии равна трем (например, РН3), а в возбужденном - пяти (например, РСl5).
Пример 2. Как изменяется прочность связи Н-Э в ряду Н2О - Н2S - H2Se - H2Te ?
Решение
В указанном ряду размеры валентных электронных облаков элементов (O,S,Se,Te) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. ослабление связи. Таким образом, при переходе от кислорода к теллуру прочность связи Н-Э уменьшается.
Пример 3. Что такое гибридизация валентных орбиталей ? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-,sp2-,sp3-гибридизации орбиталей атома А?
Решение
Теория валентных связей предполагает участие в образовании ковалентных связей не только «чистых» атомных орбиталей, но и «смешанных», так называемых гибридных атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных.
Гибридизация орбиталей и пространственная
конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гиб- ридизации | Число гиб- ридных ор- биталей атома А | Пространствен-ная конфигу- рация молекул | Валентный угол* |
| АВ2 АВ3 АВ4 | S+P S+P+P S+P+P+P | SP SP2 SP3 | 2 3 4 | линейная треугольная тетраэдрическая | 1800 1200 109028¢ |
*Валентным называется угол между двумя ближайшими связями в молекуле.
Задачи
61. Какова современная формулировка периодического закона? В чем причина периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов?
62. Что такое ковалентность элементов? Напишите электронные формулы кислорода и серы, распределите электроны по энергетическим ячейкам в нормальном и возбужденном состояниях, определите возможные ковалентности этих элементов.
63. Какая химическая связь называется ковалентной? Как она образуется и каковы ее свойства?
64. Какая химическая связь называется ионной? Как она образуется и каковы ее свойства?
65. Что такое d- и p- связь? Напишите электронную формулу азота, распределите электроны по энергетическим ячейкам, определите его ковалентность. Какие связи в молекуле азота?
66. Определите характер связей в молекулах LiF, HF, F2 . Укажите смещение электронного облака связи с учетом величин электроотрицательностей (ЭО).
67. Что такое гибридизация? Определите тип гибридизации валентных орбиталей бериллия при образовании молекулы BeCl2 и ее форму.
68. Определите направление связей в молекуле аммиака и ее форму. Укажите смещение электронного облака связи с учетом величин ЭО.
69. Определите форму молекул H2O, H2Se. Как изменяется величина валентного угла в молекулах этих соединений?
70. Что такое допорно-акценторная связь? Объясните механизм образования ионов BF4- ; [Zn(NH3)4]2+.
Дата: 2018-12-21, просмотров: 420.