Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
При расчетах, связанных с газообразными веществами, удобно пользоваться понятием «эквивалентный объём» - это объём, занимаемый при данных условиях 1 эквивалентом вещества.
Для определения эквивалента (эквивалентной массы) элемента необязательно исходить из его соединения с водородом. Его можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.
Эквиваленты простых веществ можно определять по формуле
1
Э = —— (моль),
В × n
где В - валентность элемента, n - число атомов элемента в соединении.
Эквиваленты сложных веществ определяются аналогично.
1
Э = —— ( моль),
z × n
где z - заряд металла или, в случае кислот, заряд водорода, тогда z = 1;
n - число атомов металла или, в случае кислот, число атомов водорода.
Эквивалентная масса из определения равна:
ЭМ = Э × М,
где М - молекулярная масса вещества, г/моль.
Эквивалент сложного вещества так же, как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество.
Закон эквивалентов формулируется следующим образом: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Так, для реакции А + В = С + Д можно записать:
mА mВ mС mД
—— = —— = —— = ——
ЭМА ЭМВ ЭМС ЭМД
(здесь в числителе - массы веществ, в знаменателе - их эквивалентные массы), т. е., если по условию задачи известно число эквивалентов одного из веществ (реагента или продукта), то определено и число эквивалентов всех остальных веществ. В этом состоит преимущество проведения стехиометрических расчетов по закону эквивалентов.
Примеры решения задач
Пример 1. Определить эквивалент и эквивалентную массу:
- элементов в соединениях HCl, CH4;
- оксидов TiO и TiO2;
- серной кислоты в реакциях
H2SO4 + KOH = KHSO4 + H2O,
H2SO4 + Mg = MgSO4 + H2;
- эквивалент и эквивалентный объём О2, Н2.
Решение. В НСl с 1 молем атомов водорода соединяется 1 моль атомов хлора, следовательно, ЭCl = 1 моль, Э.М.Сl = 35,5 г. В СН4 с 1 моль атомов Н соединяется 1/4 моль атомов С, значит, ЭС =1/4 моль, Э.М.С = 12/4 = 3 г.
Эквивалент Ti2+O равен 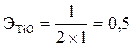 моль,
моль, 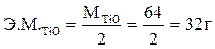 . Эквивалент Ti4+O2 –
. Эквивалент Ti4+O2 – 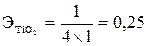 моль,
моль,
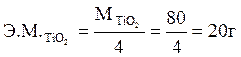 .
.
При нахождении эквивалентов О2 и Н2 учтем, что валентность кислорода равна 2, водорода -1.
1 1
ЭО2 = —— = 0,25 моль, ЭН2 = —— = 0,5 моль
2 ×2 2×1
Эквивалентные объемы соответственно VЭО2 = 22,4 × 0,25 = 5,6 л, VЭН2 = 22,4 × 0,5 = 11,2 л.
При нахождении эквивалента H2SO4 в приведенных реакциях примем во внимание, что число атомов Н, замещенных в первой реакции, равно 1, а во второй -2. Поэтому в формуле Э = 1 / (z × n) в первом случае n=1, а во втором n=2. Значит,
Э H2SO4=1 /(1×1) =1 моль и Э.М. H2SO4= М H2SO4=98 г - для реакции с КОН и
Э H2SO4=1/(1×2) =0,5 моль и Э.М. H2SO4= М H2SO4 /2= 98/2 = 49 г - для реакции с металлическим магнием.
Пример 2. При соединении 1,5 г натрия с избытком хлора образовалось 3,81 г хлорида натрия. Найти эквивалентную массу натрия и его эквивалент, если известно, что эквивалентная масса хлора равна 35,45 г.
Решение. Из условия следует, что в хлориде натрия на 1,5 г натрия приходится 3,81-1,50 =2,31 г хлора. Следовательно,
1,5 г натрия эквивалентны 2,31 г хлора.
Э.М.Na — “ — 35,45 г хлора.
Отсюда Э.М.Na = (1,5 × 35,45) / 2,31 = 23 г.
Молярная масса атомов натрия также равна 23 г/моль. Следовательно, эквивалент натрия равен 1 моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода при н.у. Вычислить эквивалент оксида и эквивалент металла. Чему равен атомный вес металла?
Решение. По закону эквивалентов:
mMeO m H2
——— = ———
Э.М.MeO Э.М. H2
Для газообразного вещества - водорода массовое отношение заменим равным ему объемным отношением V H2 : VЭ H2:
mMeO V H2 7,09 2,24 7,09 × 11,2
——— = ——— , —— = —— , Э.М.MeO = ———— = 35,45 г
Э.М.MeO VЭ H2 Э.М.MeO 11,2 2,24
По закону эквивалентов Э.М.MeO = Э.М.Me + Э.М. O2, отсюда Э.М.Me = Э.М.MeO - Э.М. O2 = 35,45 - 8 = 27,45 г.
Атомный вес металла определяем из соотношения Э.М. = А/В, где А - атомный вес, В - валентность элемента.
А = Э.М. × В = 27,45 × 2 = 54,9
Задачи
31. Сколько граммов металла, эквивалент которого 12,16, взаимодействует с 310 см3 кислорода, измеренного при н.у.?
32. При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды. Вычислите эквивалент оксида и эквивалент металла. Чему равен атомный вес металла?
33. В 2,48 г оксида одновалентного металла содержится 1,84 металла. Вычислите эквиваленты металла и его оксида.
34. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (условия нормальные).
35. Некоторое количество металла, эквивалентная масса которого равна
27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
36. Вычислите эквивалентную массу ортофосфорой кислоты, если при нейтра-
лизации 9,797 г израсходовано 7,998 гидроксида натрия.
37. На нейтрализацию 1,8 г кислоты идет 2,0 г гидроксида натрия. Определите
эквивалентную массу кислоты.
38. Вычислить эквивалентную массу Cu (OH)2 в реакциях:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O ; Cu (OH)2 + HCl = CuOHCl + H2O
39. На восстановление 1,80 г оксида металла израсходовано 0,838 л водорода,
измеренного при н.у. Вычислите эквивалентную массу металла.
40. Вычислите эквивалентную массу алюминия, если 0,5 г его вытесняют из
раствора кислоты 0,056 г водорода.
Дата: 2018-12-21, просмотров: 356.