Химические свойства элементов определяются электронным строением их атомов.
Электрон можно представить как некое “облако”, не имеющее четких границ, “размазанное” по всему объему атома и имеющее разную “плотность” на различном расстоянии от ядра.
Особенно важное значение для характеристики состояния электрона имеет волновая функция y. Чем больше значение y2 в данной области пространства, тем выше вероятность того, что электрон проявит здесь свое действие, т.е. что его существование будет обнаружено в каком-либо физическом процессе. Вероятность обнаружения электрона в некотором конкретном малом объеме DV выражается произведением y2DV.
Энергия электрона в атоме может принимать только определенные значения, т.е. она квантована. Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа n (n=1,2,3...¥). Принято говорить, что n характеризует определенный энергетический уровень электрона в атоме: при n=1 электрон находится на первом энергетическом уровне, при n=2 - на втором и т.д.
Главное квантовое число определяет и размеры электронного облака. Электроны, имеющие одно и то же значение n, образуют электронные облака приблизительно одинаковых размеров, поэтому можно говорить о существовании в атоме электронных слоев или оболочек, отвечающих определенным значениям главного квантового числа. Чем < n, тем < энергия e, тем ближе к ядру он находится, тем прочнее он с ним связан, и наоборот.
Форма электронного облака также не может быть произвольной. Она определяется орбитальным (побочным) квантовым числом L (L=0...n-1). Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным e- и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру, или, как принято говорить, экранируют внешний электрон от ядерного заряда. При этом для электронов, различающихся значением L, экранирование оказывается неодинаковым.
В многоэлектронных атомах энергия электрона зависит и от значения L. Поэтому состояния электрона, характеризующиеся различными значениями L, называются энергетическими подуровнями электрона в атоме. Им присвоены буквенные обозначения: L=0-s-подуровень(s-электрон), L=1-p-подуровень(p-электрон), L=2-d-подуровень(d-электрон), L=3-f-подуровень(f-электрон).
Ориентация электронного облака в пространстве определяется значением третьего квантового числа, называемого магнитным (m=-l...0..+l). Число значений m для данного l и есть число возможных пространственных ориентаций данного типа электрона. Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n, l, и m, т.е. определенными размерами, формой и ориентацией в пространстве, получило название атомной электронной орбитали. Электрон с вероятностью 90-95% находится внутри области пространства, охватываемого атомной орбиталью.
Электрон характеризуется еще одной квантовой величиной, не связанной с его движением вокруг ядра, а определяющей его собственное состояние. Она называется спиновым квантовым числом (S=±1/2). Упрощенно спин электрона можно рассматривать как результат его вращения вокруг собственной оси.
Принцип Паули: в атоме не может быть двух электронов, у которых все 4 квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь может быть занята не более чем двумя электронами с противоположными спинами (спаренные электроны).
Правило Гунда: устойчивому состоянию атома соответствует распределение электронов с максимальным абсолютным значением суммарного спина в пределах подуровня.
В любом атоме число орбиталей бесконечно. С увеличением заряда число электронов в атоме увеличивается , причем заполнение орбиталей электронами происходит в определенной последовательности по принципу наименьшего запаса энергии, согласно которому наиболее устойчиво такое состояние атома, при котором его электроны имеют наименьшую энергию, а наименьшей энергией обладают подуровни с самыми низкими значениями n и l. Таким образом, заполнение орбиталей идет в порядке возрастания суммы n+l ( первое
правило Клечковского). При одинаковых значениях суммы n+l в первую очередь заполняется орбиталь с меньшим значением n (второе правило Клечковского).
Примеры решения задач
Пример 1. Какой подуровень будет заполняться вслед за подуровнем 4s ?
Решение. Подуровню 4s соответствует сумма n+l=4+0=4. Такую же сумму имеет 3p подуровень, но он заполняется раньше, т.к. имеет меньшее значение главного квантового числа. Значит, после подуровня 4s будет заполняться подуровень с суммой n+l=5, причем из всех возможных комбинаций n+l, соответствующих этой сумме (3+2, 4+1, 5+0), первой будет реализовываться комбинация с наименьшим значением n, т.е. вслед за подуровнем 4s будет заполняться подуровень 3d.
Пример 2. Сколько электронов максимально может разместиться на 3 уровне?
Решение. По условию n=3, значит, l=0,1,2, т.е., на 3 уровне существует 3s, 3p и 3d подуровни. Определяем максимальное число электронов на каждом подуровне: для s-подуровня любого уровня l=0, значит, m=0, т.е. m имеет одно значение, следовательно, на s-подуровне только одна орбиталь с двумя электронами (3s2); для р-подуровня любого уровня l=1, значит, m=-1,0,1, т.е. m имеет три значения, следовательно, на р-подуровне три орбитали с шестью электронами (3р6); для d-подуровня любого уровня l=2, значит, m=-2,-1,0,1,2, т.е. m имеет пять значений, следовательно, на d-подуровне пять орбиталей с десятью электронами (3d10).
Итого, на третьем уровне может размещаться 2+6+10=18 электронов. Число орбиталей на подуровне можно определить по формуле 2l+1.
Максимальное число электронов на подуровне 2(2l+1). Максимальное число электронов на уровне 2n2.
Пример 3. Составить электронные формулы атомов элементов с порядковыми номерами 20 и 25 и графические схемы заполнения электронами валентных орбиталей. Определить число валентных электронов для каждого атома. Показать графические схемы заполнения валентных орбиталей атомов в возбужденном состоянии.
Решение. С учетом последовательности заполнения уровней и подуровней по правилам Клечковского (1s2s2p3s3p4s3d4p и т.д.) cоставляем электронные формулы элементов, распределяя по орбиталям соответственно 20 и 25 электронов.
№ 20 (Ca ) 1s22s22p63s23p63d04s2
№ 25 (Mn) 1s22s22p63s23p63d54s2
Графические схемы: 4s2
 Ca ¯ 2 валентных электрона
Ca ¯ 2 валентных электрона
4s2
 3d5 ¯
3d5 ¯

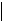


 Mn 7 валентных электронов
Mn 7 валентных электронов
Валентными являются электроны внешнего и предвнешнего заполняющегося (d и f) подуровня.
В возбужденном состоянии атома происходит «распаривание» валентных электронов путем их перехода на ближайший подуровень того же уровня:
 |


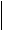
 4р1 4s1
4р1 4s1
4s1 3d5


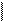
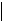

 Ca* Mn*
Ca* Mn*
Задачи
41. Какие четыре квантовых числа определяют состояние электрона в атоме. Какие значения может принимать каждое из них ?
*Составьте электронную формулу элементов с порядковыми номерами 12 и 21. Определите, к какому типу (s- , p- , d- и f-) относятся эти элементы и их положение в Периодической системе (период, подгруппа).
42. Какие квантовые числа определяют энергию электрона в атоме ? В чем сущность принципа минимума энергии ? Укажите последовательность заполнения уровней и подуровней.
* 13 и 22.
43. Какое квантовое число определяет форму атомных орбиталей ? Изобразите форму s-, p- и d- орбиталей.
* 16 и 24.
44. Какое квантовое число определяет количество орбиталей в данном подуровне атома? Чему равно число орбиталей на s- , p- , d- и f- подуровнях?
* 11 и 25.
45. Какие значения может принимать магнитное квантовое число m при l = 0; 1; 3?
* 18 и 24 .
46. Чему равно число орбиталей на p – подуровнях данного энергетического уровня? Изобразите форму p – орбиталей и расположение их в пространстве.
*30 и 36.
47. Какие электроны в атоме называются s- , p- , d- и f- электронами? Изобразите форму атомных орбиталей s- , p- , d- атомных орбиталей.
*31 и 42.
48. В чем сущность правила Гунда? Разместите три электрона по энергетичес-
ким ячейкам d – подуровня.
* 20 и 40.
49. Что такое электронное облако? Что характеризует вероятность нахождения электрона в данной точке пространства и в элементарном объеме? Что такое орбиталь?
* 54 и 56.
50. В чем сущность принципа Паули? Какое максимальное число электронов на
s- , p- , d- и f- подуровнях ?
* 23 и 52.
*См. условие задачи 41.
Дата: 2018-12-21, просмотров: 520.