Задание: Укажите один или несколько вариантов правильных ответов
1. Второй закон термодинамики позволяет
A. определить возможность самопроизвольного протекания процесса
B. количественно оценить энергетические характеристики процессов
C. определить направление самопроизвольного протекания процесса
D. определить температуру, при которой система находится в состоянии термодинамического равновесия
2. Термодинамическое равновесие – это такое состояние, при котором
A. скорость прямой реакции равна скорости обратной
B. суммы масс веществ, вступивших в реакцию и получившихся в результате реакции равны
C. суммы числа молей веществ, вступивших в реакцию и получившихся в результате реакции, равны
D. скорость выделения и поглощения теплоты одинакова
3. В случае идеального, обратимого процесса
A. систему можно вернуть в первоначальное состояние без затрат энергии извне
B. систему можно вернуть в первоначальное состояние при подводе энергии извне
C. систему нельзя вернуть в первоначальное состояние ни в коем случае
D. не происходит рассеивание энергии в виде тепла
4. Работа, совершаемая идеальным газом при изменении объема от V1 до V2 достигает максимума
A. при расширении газа в пустоту
B. когда все время процесса внешнее давление лишь на очень малую величину меньше собственного давления
C. когда все время процесса внешнее давление значительно превышает величину собственного давления
5. Выберете верные выражения для максимальной работы
A. Amax = p ΔV
B. Amax = p dV
V2
C. Аmax = ∫ p dV
V1
6. Максимальная работа в изотермическом процессе определяется по формуле
V2
A. Аmax = ∫ p dV
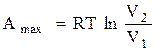 V1
V1
B.
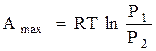 |
C.
7. Максимальная работа в изохорном процессе определяется по формуле
A. Аmax = Сv ΔT
V2
B. Аmax = RT ln ―
V1
C. Аmax = 0
8. Максимальная работа в адиабатическом процессе определяется по формуле
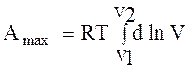
А.
|
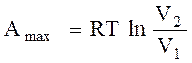 |
C.
9. Реально протекающие процессы
A. термодинамически обратимы
B. термодинамически не обратимы
C. самопроизвольно протекают в одном направлении
10. Для меры необратимого рассеивания энергии Р. Клаузиус ввел функцию состояния, называемую
A. энтальпия
B. энтропия
C. внутренняя энергия
D. кинетическая энергия
11. Энтропия – это функция состояния, приращение которой определяется по формуле
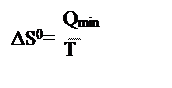 A. , если теплота подводится к системе в обратимом процессе;
A. , если теплота подводится к системе в обратимом процессе;
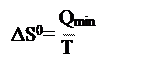 |
B. , если теплота подводится к системе необратимым путем;
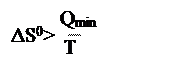
C. , если теплота подводится к системе в обратимом процессе
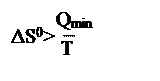
D. , если теплота подводится к системе необратимым путем.
12. Выберете правильные выражения
A. ΔS = Sкон – Sисх
B. ΔG = Gкон – Gисх
C. ΔA = Aкон – Aисх
D. ΔQ = Qкон – Qисх
13. Изменение энтропии реакции в стандартных условиях рассчитывают по формуле
A. ΔS0 р-ции = Σ(n*ΔH0обр)кон – Σ(n*ΔH0обр)исх
B. ΔS0 р-ции = Σ(n*ΔH0сгор)исх – Σ(n*ΔH0сгор)кон
Qmin
C. ΔS0 = ―
Т
D. ΔS0 р-ции = Σ(n*S0)кон – Σ(n*S0)исх
14. Можно вычислить абсолютное значение следующих термодинамических функций
A. внутренней энергии Е
B. энтальпии Н
C. энтропии S
D. энергии Гиббса G
15. При нагревании системы в пределах от Т1 до Т2 изменение энтропии ΔS рассчитывают
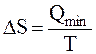 |
A.
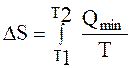 B.
B.
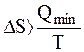 |
C.
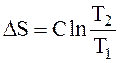 |
D.
16. Химические реакции в изолированных системах могут протекать самопроизвольно, если для реакции
A. изменение энтропии ΔS > 0
B. изменение энтропии ΔS < 0
C. изменение энтальпии ΔН > 0
D. изменение энтальпии ΔН < 0
17. Энтропия – это термодинамическая функция, характеризующая меру неупорядоченности расположения частиц в системе. Энтропия системы уменьшается при
A. повышение температуры
B. повышение давления для газов
C. фазовых переходах типа «кристаллическое вещество→аморфное вещество»
D. фазовых переходах типа «газообразное вещество → жидкое вещество → твердое вещество»
18. Самопроизвольность процесса зависит от
A. стремление к минимуму энергии
B. энтальпийного фактора ΔН
C. стремление к максимальной упорядоченности
D. стремление к максимальному беспорядку
E. энтропийного фактора ΔS
F. энтропийного фактора Т*ΔS
19. Значение следующих термодинамических функций для простых веществ считают равными нулю
A. стандартной энтальпии образования
B. стандартной энтальпии сгорания
C. стандартной энтропии
D. стандартной энергии Гиббса
20. Энергия Гиббса – это критерий возможности самопроизвольного протекания процесса при
A. С = const
B. Т = const
C. Р = const
D. V = const
21. В стандартных условиях изменение энергии Гиббса в реакции рассчитывают по формуле
A. ΔG0р-ции = ΔН0 – Т ΔS0
B. ΔG0 р-ции = Σ(n*ΔG0обр)кон – Σ(n*ΔG0обр)исх
C. ΔG0 р-ции = Σ(n*ΔG0обр)исх – Σ(n*ΔG0обр)кон
C Δδ
D. ΔG0 р-ции = - ― * ―
RT ΔC
22. В нестандартных условиях изменение энергии Гиббса в реакции рассчитывают по формуле
A. ΔG0р-ции = ΔН0 – Т ΔS0
B. ΔG0 р-ции = Σ(n*ΔG0обр)кон – Σ(n*ΔG0обр)исх
C. ΔG0 р-ции = Σ(n*ΔG0обр)исх – Σ(n*ΔG0обр)кон
C Δδ
D. ΔG0 р-ции = - ― * ―
RT ΔC
23. В условиях постоянных температуры и давления самопроизвольно могут протекать только такие процессы, для которых
A. ΔG < 0
B. ΔG > 0
C. ΔG = 0
24. В условиях постоянных температуры и давления реакция в прямом направлении самопроизвольно не идет, но идет самопроизвольно в обратном направлении, если
A. ΔG < 0
B. ΔG > 0
C. ΔG = 0
25. Реакция идет самопроизвольно при любой температуре, если
A. ΔH > 0, ΔS > 0
B. ΔH > 0, ΔS < 0
C. ΔH < 0, ΔS > 0
D. ΔH < 0, ΔS < 0
26. Реакция не идет ни при каких температурах, если
A. ΔH > 0, ΔS > 0
B. ΔH > 0, ΔS < 0
C. ΔH < 0, ΔS > 0
D. ΔH < 0, ΔS < 0
27. Реакция может идти самопроизвольно при низких температурах, если
A. ΔH > 0, ΔS > 0
B. ΔH > 0, ΔS < 0
C. ΔH < 0, ΔS > 0
D. ΔH < 0, ΔS < 0
28. Реакция может идти самопроизвольно только при высоких температурах, если
A. ΔH > 0, ΔS > 0
B. ΔH > 0, ΔS < 0
C. ΔH < 0, ΔS > 0
D. ΔH < 0, ΔS < 0
29. Эндэргоническими называют процессы, при которых
A. в условиях V = const и T = const энергия Гельмгольца возрастает
B. в условиях P = const и T = const энергия Гиббса возрастает
C. в условиях V = const и T = const энергия Гельмгольца убывает
D. в условиях P = const и T = const энергия Гиббса убывает
30. Экзоэргоническими называются процессы
A. при которых в условиях P = const и T = const энергия Гиббса убывает
B. при которых в условиях V = const и T = const энергия Гельмгольца убывает
C. которые протекают самопроизвольно
D. при которых внутренняя энергия не изменяется
Занятие № 3
Дата: 2018-12-21, просмотров: 544.