Учебные элементы модуля
| Тепловой эффект реакции в стандартных условиях по ΔН0обр. | 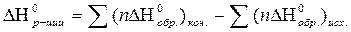 ΔН0обр. - стандартная теплота (энтальпия) образования конечных и исходных веществ
n – стехиометрический коэффициент
ΔН0обр. - стандартная теплота (энтальпия) образования конечных и исходных веществ
n – стехиометрический коэффициент
|
| Тепловой эффект реакции в стандартных условиях по ΔН0сгор. | 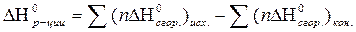 ΔН0сгор. - стандартная теплота (энтальпия) сгорания конечных и исходных веществ
n – стехиометрический коэффициент
ΔН0сгор. - стандартная теплота (энтальпия) сгорания конечных и исходных веществ
n – стехиометрический коэффициент
|
| Тепловой эффект реакции в стандартных условиях для реакции образования органического соединения из простых веществ | 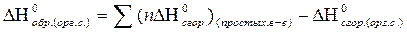 ΔН0сгор. - стандартная теплота (энтальпия) сгорания простых веществ и органического соединения
n – стехиометрический коэффициент
ΔН0сгор. - стандартная теплота (энтальпия) сгорания простых веществ и органического соединения
n – стехиометрический коэффициент
|
| Изменение молярных изобарных теплоемкостей | 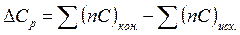 С – молярные теплоемкости продуктов реакции и исходных веществ
n – стехиометрический коэффициент
С – молярные теплоемкости продуктов реакции и исходных веществ
n – стехиометрический коэффициент
|
| Тепловой эффект реакции при заданной температуре | 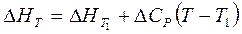
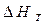 - тепловой эффект реакции при заданной температуре T - тепловой эффект реакции при заданной температуре T
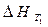 - тепловой эффект реакции при температуре T1 - тепловой эффект реакции при температуре T1
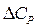 - разность сумм молярных изобарных теплоемкостей продуктов реакции и исходных веществ - разность сумм молярных изобарных теплоемкостей продуктов реакции и исходных веществ
|
| Изменение энтропии реакции в стандартных условиях | 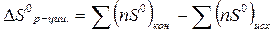 S0 - энтропия конечных и исходных веществ
n – стехиометрический коэффициент
S0 - энтропия конечных и исходных веществ
n – стехиометрический коэффициент
|
| Изменение энергии Гиббса в стандартных условиях | 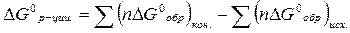 D G0обр. - стандартную энергию Гиббса образования конечных и исходных веществ
n – стехиометрический коэффициент
D G0обр. - стандартную энергию Гиббса образования конечных и исходных веществ
n – стехиометрический коэффициент
|
| Изменение энергии Гиббса в нестандартных условиях | 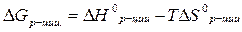 ΔН0 - тепловой эффект реакции в стандартных условиях
ΔS0 - изменение энтропии реакции в стандартных условиях
Т – абсолютная температура
ΔН0 - тепловой эффект реакции в стандартных условиях
ΔS0 - изменение энтропии реакции в стандартных условиях
Т – абсолютная температура
|
| Выражение изменения стандартной энергии Гиббса через константу равновесия | ΔG 0 р-ции = - RT lnKp Кр - константы химического равновесия R - универсальная газовая постоянная Т – абсолютная температура |
| Уравнением изотермы химической реакции | ΔG р-ции = RT ln 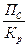 ПС - стехиометрическим соотношением концентраций веществ, участвующих в реакции
Кр - константы химического равновесия
R - универсальная газовая постоянная
Т – абсолютная температура
ПС - стехиометрическим соотношением концентраций веществ, участвующих в реакции
Кр - константы химического равновесия
R - универсальная газовая постоянная
Т – абсолютная температура
|
| Дифферен-циальная форма изобары химической реакции | 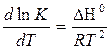 Кр - константы химического равновесия
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
Кр - константы химического равновесия
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
|
| Интегральная форма изобары химической реакции | ln 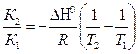 К1 - константы химического равновесия при Т1
К2 - константы химического равновесия при Т2
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
К1 - константы химического равновесия при Т1
К2 - константы химического равновесия при Т2
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
|
Занятие № 1
Химическая термодинамика. Первое начало термодинамики
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Лабораторная работа № 1
5. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Физическая химия – определение, предмет изучения.
2. Основные понятия термодинамики:
Ø система, термодинамическая система;
Ø системы: изолированные, закрытые и открытые (примеры);
Ø состояние системы - определение;
Ø процесс – определение;
Ø процессы: изотермические, изобарические, изохорические, адиабатические;
Ø функция состояния: внутренняя энергия, энтальпия, энтропия, энергия Гиббса.
3. 1-й закон термодинамики. Определение, математическое выражение 1-го закона для различных процессов.
4. Энтальпия. Функция состояния изобарного процесса.
5. Стандартная энтальпия образования и сгорания вещества, калорийность.
6. Закон Гесса. Следствия закона Гесса, их математическое выражение. Расчет стандартной теплоты химических реакций по стандартным теплотам образования и сгорания веществ.
7. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа.
8. Тепловые эффекты реакций. Термохимический и термодинамический способ записи химических уравнений.
9. Теплоемкость – удельная, молярная, истинная, средняя.
10. Теплота растворения, теплота нейтрализации, теплота фазовых переходов.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 21 – 47 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 19 – 22 c.
Дата: 2018-12-21, просмотров: 418.