План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Обоснование необходимости введения второго закона термодинамики.
2. Некоторые критерии возможности самопроизвольного протекания процессов.
3. Общая формулировка второго закона термодинамики.
4. Что называют обратимыми и необратимыми процессами в термодинамике?
5. Максимальная работа процесса.
6. Энтропия – мера рассеивания энергии.
7. Энтропия – функция состояния системы.
8. Абсолютная энтропия. Стандартная энтропия.
9. Изменение энтропии в стандартных условиях.
10. Определение энтропии с точки зрения статистической физики.
11. Энтропийная формулировка второго начала термодинамики для изолированных систем.
12. Энтропия и ее связь с вероятностью состояния системы. Формула Больцмана.
13. Изменение энтропии, связанное с повышением температуры, фазовыми переходами, изменением давления в системе.
14. Энтальпийный и энтропийный факторы и их влияние на самопроизвольность протекания процесса.
15. Энергия Гиббса, изменение энергии Гиббса в изобарно-изотермическом процессе. Формулировка второго закона термодинамики с точки зрения изменения энергии Гиббса.
16. Стандартная свободная энергия Гиббса образования вещества. Расчет изменения энергии Гиббса в химической реакции при стандартных условиях.
17. Как рассчитать изменение энергии Гиббса химической реакции при нестандартных условиях?
18. Энергия Гиббса, энергия Гельмгольца как критерий самопроизвольного протекания процесса.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 53 – 69 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 25 – 29 c.
Эталоны решения типовых задач
Расчет стандартной энтропии реакции по стандартным значениям энтропии реагентов.
Задача 1
Определите изменение энтропии в стандартных условиях для следующей химической реакции:
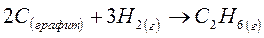
DS0(Сграфит) = 5,7 Дж/моль·К
DS0(H2)г. = 130,6 Дж/моль·К
DS0(C2H6)г. = 229,5 Дж/моль·К
Решение:
Изменение энтропии в химической реакции при стандартных условиях рассчитывается по формуле:
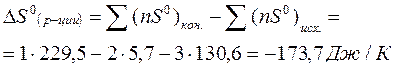
Ответ: - 173,7 Дж/К
Расчет изменения стандартной энергии Гиббса реакции по стандартным значениям энергии Гиббса образования реагентов и продуктов.
Задача 2
Определите возможность протекания реакции в стандартных условиях по величине изменения энергии Гиббса:
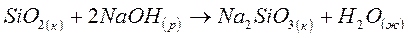
DG0обр.(SiO2)к= - 803,8 кДж/моль
DG0обр.(NaOH)р= - 419,5 кДж/моль
DG0обр.(Na2SiO3)к= -1427,8 кДж/моль
DG0обр.(H2O)ж= - 237,5 кДж/моль
Решение:
В стандартных условиях изменение энергии Гиббса в химической реакции подсчитывается по формуле:
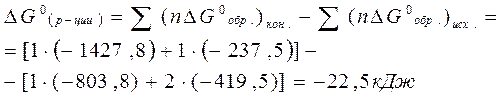 ,
,
т.е. протекание химической реакции возможно, т.к. DG0(реакции).<0
Ответ: протекание химической реакции возможно, т.к.DG0(р-ции)=-22,5 кДж.<0
Расчет изменения стандартной энергии Гиббса реакции по величинам стандартной энтальпии и стандартной энтропии. Анализ энтропийного и энтальпийного факторов.
Задача 3
Вычислите изменение энергии Гиббса при температуре 270С и определите возможность протекания химической реакции
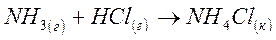
по значениям стандартных теплот образования и энтропий веществ, участвующих в реакции.
| Вещество | NH3 | HCl | NH4Cl |
| DH0обр., кДж/моль | -45,9 | -92,3 | -314,2 |
| S0,Дж/моль·К | 192,6 | 186,8 | 95,8 |
Решение:
Изменение энергии Гиббса в химической реакции при температуре T можно вычислить по уравнению: 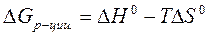
Тепловой эффект химической реакции DH0(р-ции) определяем по 1 следствию из закона Гесса:
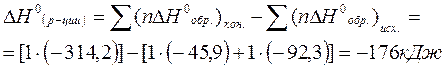
Изменение энтропии в химической реакции:
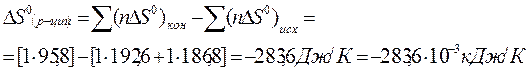
Температура в Кельвинах T = 27+273 = 300K
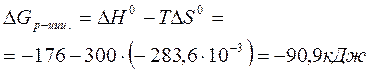 ,
,
т.е. < 0, протекание реакции в прямом направлении возможно.
Ответ: протекание химической реакции в прямом направлении возможно, т.к. DG0 (р-ции)= - 90,9 кДж,т.е.<0
Задачи для самостоятельной работы
1. Рассчитайте изменение энтропии в Дж/К для химической реакции при стандартных условиях

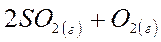
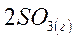
если стандартные энтропии SO2(г), O2(г) и SO3(г) равны 248; 205 и 257 Дж/моль·К, соответственно. Сделайте вывод о направлении самопроизвольного протекания реакции в этих условиях.
2. Для реакции 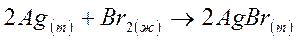 , протекающей при 298 К и 1 атм., DH0 = -199,2 кДж/моль и DG0= -191,6 кДж/моль. Вычислите стандартное изменение энтропии DS0 в кДж/К для этой реакции.
, протекающей при 298 К и 1 атм., DH0 = -199,2 кДж/моль и DG0= -191,6 кДж/моль. Вычислите стандартное изменение энтропии DS0 в кДж/К для этой реакции.
3. В организме человека в результате метаболизма образуется глицерин (CH2OH)2CHOH (ж), который далее превращается в CO2(г) и H2O(г):
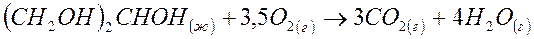
Вычислите DG0 этой реакции в кДж, если
| Вещество | Глицерин (ж) | CO2 (г) | H2O(г) |
| DG0обр., кДж/моль | - 480 | - 395 | - 230 |
4. Рассчитайте изменение свободной энергии Гиббса в кДж при T = 298 К и определите, в каком направлении следующая реакция будет протекать самопроизвольно в стандартных условиях:
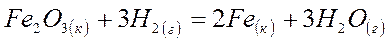
Если DG0обр. Fe2O3 (к) и H2O (г) равны – 741 и – 229 кДж/моль, соответственно, а водорода (г) и железа (к) равны нулю.
5. Рассчитайте изменение свободной энергии Гиббса в кДж при температуре 370С и определите, является ли самопроизвольным процесс окисления глюкозы:
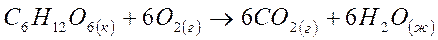
| Вещество | C6H12O6(к) | O2(г) | CO2(г) | H2O(ж) |
| DH0обр., кДж/моль | -1274 | 0 | -394 | -286 |
| S0,Дж/моль·К | 212 | 205 | 214 | 70 |
6. Рассчитайте температуру (в К), при которой в системе

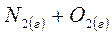
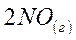
установится термодинамическое равновесие.
| Вещество | N2(г) | O2(г) | NO(г) |
| DH0обр., кДж/моль | 0 | 0 | 90 |
| S0,Дж/моль·К | 192 | 205 | 211 |
Задания в тестовой форме
« II ЗАКОН ТЕРМОДИНАМИКИ.
Дата: 2018-12-21, просмотров: 532.