План занятия
1. Проверка посещаемости и информация
2. Решение ситуационных задач
3. Защита лабораторных работ
4. Подведение итогов занятия
Ситуационные задачи
Задача 1.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для гидролиза сложноэфирной связи; ∆G0 = - 10,48 кДж/моль.
Задача 2.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для переноса ацетильной группы при гидролизе ацетилкофермента А, ∆G0 = - 34,36 кДж/моль.
Задача 3.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции:
АТФ + АМФ → 2 АДФ ∆G0 = - 2,10 кДж/моль.
Задача 4.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции:
креатин + фосфат → креатинфосфат + Н2О ∆G0 = 29,33 кДж/моль.
Задача 5.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции дегидратации лимонной кислоты с образованием цис-аконитовой кислоты ∆G0 = 8,36 кДж/моль.
Задача 6.
Сделайте заключение о практической обратимости реакции в стандартном состоянии рассчитав константу равновесия при 310 К для гидратации цис-аконитовой кислоты с образованием изолимонной кислоты ∆G0 = - 1,68 кДж/моль.
Задача 7.
Константа равновесия реакции N2O4 (г) → 2 NO2 (г) при 25ºС равна 4,64 ∙ 10-3. В каком направлении будет идти реакция при следующих концентрациях веществ:
a) С (NO2) = 0,05 моль/л; С (N2O4) = 0 моль/л;
b) С (NO2) = 0 моль/л; С (N2O4) = 0,05 моль/л;
c) С (NO2) = 0,0107 моль/л; С (N2O4) = 0,0246 моль/л;
d) С (NO2) = 0,0095 моль/л; С (N2O4) = 0,046 моль/л.
Задача 8.
Константа равновесия реакции:
PCl5 (г) → PCl3 (г) + Cl2 (г)
при 250ºС равна 2. В каком направлении идет реакция при следующих концентрациях С (PCl5) = С (PCl3) = 1 моль/л и С (Сl2) = 2 моль/л.
Задача 9.
В организме человека протекают реакции превращения глюкозы:
1) С6Н12О6 (к) ↔ 2 С2Н5ОН (ж) + 2 СО2 (г)
2) С6Н12О6 (к) + 6 О2 (г) ↔ 6 СО2 (г) + 6 Н2О (ж)
Какая из этих реакций поставляет организму больше энергии? Ответ обоснуйте.
Задача 10.
В организме человека протекают реакции:
1) АТФ + Н2О → АДФ + Н3РО4; ∆G = - 29,2 кДж/моль
2) глюкоза + Н3РО4 → глюкоза-6-фосфат + Н2О; ∆G = 13,1 кДж/моль
Чему равна ∆G суммарного процесса:
глюкоза + АТФ → глюкоза-6-фосфат + АДФ
и какой вывод о его самопроизвольности можно сделать? Ответ обоснуйте.
II . Термодинамика фазовых равновесий
Учебные элементы модуля
| Закон Вант-Гоффа для растворов неэлектролитов | Р = С R Т Р - осмотическое давление С - молярная концентрация вещества R - универсальная газовая постоянная Т - абсолютная температура |
| Закон Вант-Гоффа для растворов электролитов | Р = i CRT Р - осмотическое давление С - молярная концентрация вещества i - изотонический коэффициент R - универсальная газовая постоянная Т - абсолютная температура |
| Изотонический коэффициент | i = a ( n –1)+1 a - степень диссоциации или ассоциации, выраженная в долях единицы, n - число ионов, образующихся при диссоциации одной молекулы или число, обратное количеству молекул в одном ассоциате (полимерной молекуле) |
| 1-й закон Рауля для растворов неэлектролитов | 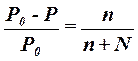 Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
|
| 1-й закон Рауля для растворов электролитов | 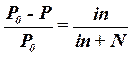 Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
i - изотонический коэффициент
Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
i - изотонический коэффициент
|
| 2-ой закон Рауля для растворов неэлектролитов | 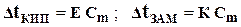 Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
Cm - моляльная концентрация
Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
Cm - моляльная концентрация
|
| 2-ой закон Рауля для растворов электролитов | 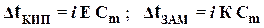 Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
i - изотонический коэффициент
Cm - моляльная концентрация
Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
i - изотонический коэффициент
Cm - моляльная концентрация
|
Занятие № 5
Термодинамика фазовых равновесий. Основные понятия. Правило фаз Гиббса. Диаграммы состояния однокомпонентных систем.
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Основные понятия: фаза, гомо- и гетерогенные системы.
2. Фазовый переход. Определение. Примеры фазовых переходов: парообразование, испарение, сжижение. Возгонка (сублимация), десублимация. Плавление, отвердевание.
3. Полиморфизм, аллотропия.
4. Число составляющих веществ. Компоненты системы. Правило фаз Гиббса. Системы моно-, би- и безвариантные.
5. Фазовое равновесие. Определение. Понятие о динамическом равновесии. Условия фазового равновесия.
6. Однокомпонентные системы. Правило фаз Гиббса для однокомпонентных систем.
7. Диаграмма состояния. Определение.
8. Диаграмма состояния воды. Анализ диаграммы.
9. Диаграмма состояния серы. Анализ диаграммы. Понятие энантиотропных превращений.
10. Уравнение Клаузиуса-Клайперона.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 113 – 130 с.
Дата: 2018-12-21, просмотров: 758.