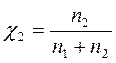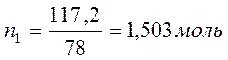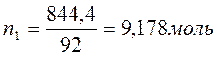Кафедра химии

УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ПО ФИЗИЧЕСКОЙ ХИМИИ
для студентов, обучающихся по специальности « Фармация»
ТВЕРЬ
2018
УДК 541.1
ББК 24
Авторы-составители: Бордина Г.Е., Лопина Н.П., Халяпина Я.М.
Под общей редакцией профессора, док.биол.наук. Г.М. Зубаревой
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ГБОУ ВПО Тверская ГМА
Ю.П. Игнатова – канд. мед. наук, доцент кафедры физиологии ГБОУ ВПО Тверская ГМА
Учебно-методическое пособие утверждено ЦКМС ТГМА
Учебно-методическое пособие по физической химии [Текст]: учебное пособие для студентов фармацевтического факультета / Бордина Г.Е., Лопина Н.П. Халяпина Я.М. // Под общей редакцией: доктора биологических наук, профессора Г.М. Зубаревой. – Тверь, 2012. – 119 с.
Авторы-составители – сотрудники кафедры химии и биохимии Тверской государственной медицинской академии:
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
Надежда Петровна Лопина – канд. хим. наук, доцент кафедры химии
Янина Михайловна Халяпина – старший преподаватель кафедры химии
Учебно-методическое пособие составлено коллективом кафедры химии и биохимии Тверской государственной медицинской академии и предназначено в помощь студентам фармацевтического факультета для подготовки к лабораторно-практическим занятиям и экзамену.
УДК 541.1
ББК 24
© Бордина Г.Е., Лопина Н.П., Халяпина Я.М., 2012
ОГЛАВЛЕНИЕ
Предисловие………………………………………………………………...4
I . Химическая термодинамика…………………………………………... 5 – 6
Занятие № 1 Химическая термодинамика. Первое начало термодинамики………………………………………………………………7 – 16
Занятие № 2 Химическая термодинамика. Второе начало термодинамики.……………………………………………………………..17 – 27
Занятие № 3 Химический потенциал. Термодинамика
химического равновесия. Уравнение изотермы
химической реакции………………………………………………………..28 – 37
Занятие № 4 Итоговое занятие по теме «Химическая
термодинамика»………………………………..………………………38 – 39
II . Термодинамика фазовых равновесий……………………………….40
Занятие № 5 Термодинамика фазовых равновесий.
Основные понятия. Правило фаз Гиббса. Диаграммы состояния однокомпонентных систем………………………………………………...41 – 50
Занятие № 6 – 7 Закон Рауля. Диаграммы состояния
бинарных систем. Первый и второй законы Коновалова.
Простая и фракционная перегонка.……………………………………….51 – 63
Занятие № 8 Итоговое занятие по теме «Термодинамика
фазовых равновесий»………………………………………………………64 – 73
III. Термодинамика растворов электролитов.
Термодинамика разбавленных растворов.
Электрохимия……………………………………………………………..74
Занятие № 9 Буферные системы и растворы………..…………………...75 – 83
Занятие № 10 Буферные системы и растворы …………...……………...84 – 87
Занятие № 11 Теория растворов сильных электролитов.
Электрохимия………………………………………….…………………...88 – 93
Занятие № 12 – 13 Электрохимия …………………………......................94 – 108
Занятие № 14 Итоговое занятие по теме «Термодинамика растворов электролитов. Термодинамика разбавленных растворов.
Электрохимия» …………………………………………………………….109 – 110
Литература………………………………………………………………...113
Приложение 1……………………………………………............................114 – 116
Приложение 2……………………………………………............................117
Приложение 3………………………………………………........................118
"Мощь и сила науки – во множестве фактов,
цель – в обобщении этого множества".
Д.И. Менделеев
ПРЕДИСЛОВИЕ
Настоящее учебно-методическое пособие соответствует примерной программе по дисциплине «Физическая и коллоидная химии» для специальности 060301 –фармация, утвержденной Руководителем Департамента образовательных медицинских учреждений и кадровой политики Минздрава России Н.Н. Володиным (Москва, 2002 г.).
Физическая химия является теоретической основой для изучения биохимии, фармацевтической химии, технологии лекарств, токсикологической химии, физиологии, физико-химических методов исследования и анализа, используемых в фармации.
Авторы-составители стремились подобрать задания, охватывающие все теоретические вопросы программы курса физической и коллоидной химии.
Новизна учебно-методического пособия заключается в том, что задания выбраны применительно не к отдельному понятию или закону, а к комплексу знаний.
Учебно-методическое пособие включает 3 модуля. Каждый модуль содержит вопросы к занятию, эталоны решения типовых и ситуационных задач, задачи для самостоятельного решения, тестовые задания с эталонами ответов.
Расчетные задачи сгруппированы по модульному принципу, что соответствует содержанию важнейших тем курса физической и коллоидной химии для медицинских вузов. В каждом модуле даны примеры решения типовых и ситуационных задач. На некоторые задачи ответы не приводятся; авторы-составители пошли на такой шаг вполне сознательно, так как в ряде случаев приведение ответа фактически означает сообщение студенту решения задачи.
Учебно-методическое пособие выполняет обучающую, контролирующую и прикладную функции, дает возможность студенту самому оценить уровень сформированности расчетных умений, развить собственную инициативу и познавательную активность по решению разнообразных химических задач.
Мы заранее благодарны всем коллегам, которые, ознакомившись с данным пособием, сообщат нам о замеченных ими просчетах или недостатках.
Авторы-составители
Занятие № 1
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Лабораторная работа № 1
5. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Физическая химия – определение, предмет изучения.
2. Основные понятия термодинамики:
Ø система, термодинамическая система;
Ø системы: изолированные, закрытые и открытые (примеры);
Ø состояние системы - определение;
Ø процесс – определение;
Ø процессы: изотермические, изобарические, изохорические, адиабатические;
Ø функция состояния: внутренняя энергия, энтальпия, энтропия, энергия Гиббса.
3. 1-й закон термодинамики. Определение, математическое выражение 1-го закона для различных процессов.
4. Энтальпия. Функция состояния изобарного процесса.
5. Стандартная энтальпия образования и сгорания вещества, калорийность.
6. Закон Гесса. Следствия закона Гесса, их математическое выражение. Расчет стандартной теплоты химических реакций по стандартным теплотам образования и сгорания веществ.
7. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа.
8. Тепловые эффекты реакций. Термохимический и термодинамический способ записи химических уравнений.
9. Теплоемкость – удельная, молярная, истинная, средняя.
10. Теплота растворения, теплота нейтрализации, теплота фазовых переходов.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 21 – 47 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 19 – 22 c.
Задача 1
Рассчитайте, пользуясь первым следствием из закона Гесса, тепловой эффект реакции окисления сахарозы в организме человека, который описывается уравнением:
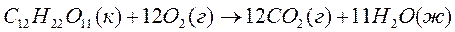
и удельную калорийность сахарозы.
Решение:
Из справочных данных (см. приложение 1):
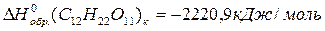
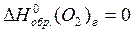
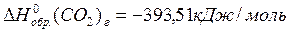
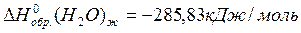
По 1 следствию из закона Гесса:
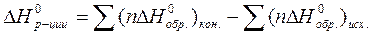
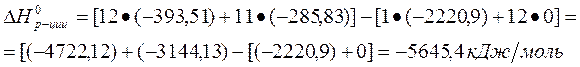
Молярная масса сахарозы М(C12H22O11)=342 г/моль, поэтому удельная калорийность сахарозы равна 5645,4:342=16,5 кДж/г.
Ответ: - 5645,4 кДж/моль; 16,5 кДж/г.
Задача 2
Определите тепловой эффект реакции синтеза акриловой кислоты при 298 К:
CH 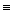 CH (г) + СO (г) + H2O (ж)
CH (г) + СO (г) + H2O (ж) 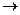 CH2 = CH- COOH (ж), если известны стандартные теплоты сгорания веществ, участвующих в химической реакции:
CH2 = CH- COOH (ж), если известны стандартные теплоты сгорания веществ, участвующих в химической реакции:
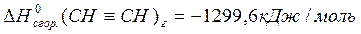
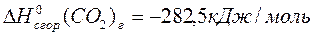
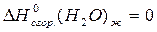
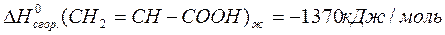
Решение:
По 2 следствию из закона Гесса:
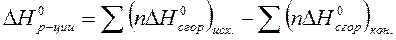
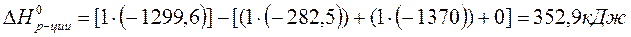
Ответ: 352,9 кДж
Задача 3
Определите стандартную теплоту образования этилового спирта, если теплоты сгорания углерода, водорода и этилового спирта соответственно равны:
-393,5; -285,8; -1366 кДж/моль.
Решение:
Образование этилового спирта из простых веществ можно представить так:
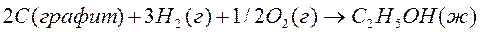
Теплота сгорания кислорода равна нулю.
По 3 следствию из закона Гесса:
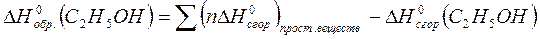
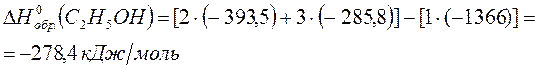
Ответ: - 278,4 кДж/моль
Расчет теплового эффекта реакции при температуре, отличающейся от 25ºС. Зависимость теплового эффекта от температуры (уравнение Кирхгофа).
Задача 4
Рассчитать тепловой эффект реакции синтеза метанола из водорода и оксида углерода на твердом катализаторе при 500 К. Как изменится тепловой эффект при повышении температуры от 298 К до 500 К.
Решение:
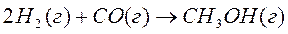
0 -110,53 -201,0 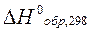 кДж/моль
кДж/моль
28,83 29,14 44,13 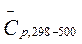 Дж/моль•К
Дж/моль•К
Решение:
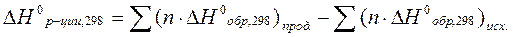
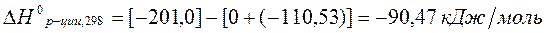
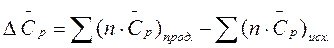
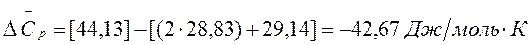
Рассчитаем 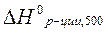 по уравнению Кирхгоффа:
по уравнению Кирхгоффа:
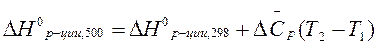
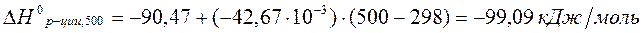 С ростом температуры количество выделяющегося тепла растет, т.к.
С ростом температуры количество выделяющегося тепла растет, т.к. 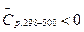
Задачи для самостоятельной работы
1. Теплоты образования NO (г) и NO2 (г), равны соответственно, 91,26 и 34,19 кДж/моль. Вычислите тепловой эффект реакции
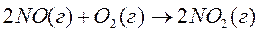 в кДж
в кДж
2. Исходя из стандартной теплоты образования углекислого газа (г), равной –393,51 кДж/моль и термохимического уравнения:
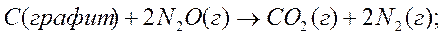
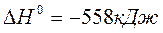 ,
,
вычислите стандартную теплоту образования N2O (г) в кДж/моль.
3. Рассчитайте 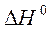 в кДж реакции сгорания аммиака по уравнению:
в кДж реакции сгорания аммиака по уравнению:
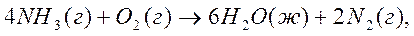
если стандартные энтальпии образования NH3(г) и H2O (ж) равны – 45,94 и - 285,83 кДж/моль, соответственно.
4. Вычислите стандартную теплоту образования бензойной кислоты C6H5COOH (к) в кДж/моль, если ее стандартная теплота сгорания по уравнению
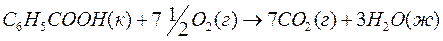
равна –3228 кДж/моль, а стандартные теплоты образования H2O (ж) и CO2 (г) равны –285,83 и –393,51 кДж/моль, соответственно.
5. Горение формальдегида протекает по уравнению:
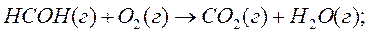
Вычислите стандартную теплоту образования формальдегида в кДж/моль, если стандартные теплоты образования углекислого газа и воды равны –393,51 и –241,81 кДж/моль, соответственно.
6. Стандартные теплоты сгорания ацетилена (г), этана (г) и водорода (г) равны, соответственно, -1300, -1540 и –286 кДж/моль. Вычислите тепловой эффект 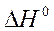 реакции в кДж:
реакции в кДж:
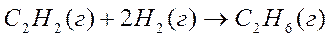
7. По стандартным теплотам сгорания веществ рассчитайте 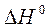 реакции в кДж.
реакции в кДж.
 -1367 -874 -2254 0
-1367 -874 -2254 0
8. Стандартная теплота сгорания глюкозы (т) равна –2816 кДж/моль; этилового спирта (ж) –1236 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы в кДж, т.е. 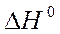 реакции в стандартных условиях:
реакции в стандартных условиях:
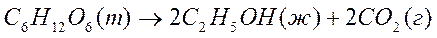
9. Найти тепловой эффект реакции при T = 400 К (все участники реакции газообразные вещества).
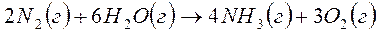
Справочные данные:
| Вещество | 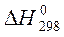 кДж/моль кДж/моль
| 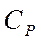 Дж/моль·К Дж/моль·К
|
| N2 | 0 | 29,12 |
| H2O | -241,81 | 33,61 |
| O2 | 0 | 29,37 |
| NH3 | -45,94 | 35,16 |
10. При получении синтез – газа из гексана основная реакция идет по уравнению:
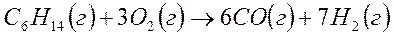
Определите тепловой эффект реакции, если она протекает при температуре 1350оС.
Справочные данные:
| Вещество | 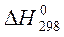 кДж/моль кДж/моль
| 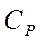 Дж/моль·К Дж/моль·К
|
| C6H14(г) | -167,19 | 143,09 |
| O2 | 0 | 29,37 |
| CO(г) | -110,53 | 29,14 |
| H2(г) | 0 | 28,83 |
11. Рассчитать тепловой эффект химических реакций (см. таблицу) при 298 К и 500 К, используя средние значения теплоемкости 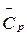 .
.
| № | Уравнение химической реакции |
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 | 2 H2 (г) + CO (г) → CH3OH (ж) 4 HCl (г) + O2 (г) → 2 H2O (г) + 2 Cl2 (г) 2 N2 (г) + 6 H2O (г) → 4 NH3 (г) + 3 O2 (г) 4 NO (г) + 6 H2O (г) → 4 NH3 (г) + 5 O2 (г) 2 NO2 (г) → 2 NO (г) + O2 (г) N2O4 (г) → 2 NO2 (г) CaCO3 (тв) → CaO (тв) + CO2 (г) Ca(OH)2 (тв) → CaO (тв) + H2O (г) ½ S2 (г) + 2 H2O (г) → SO2 (г) + 2 H2 (г) ½ S2 (г) + 2 CO2 (г) → SO2 (г) + 2 СО (г) SO2 (г) + Cl2 (г) → SO2Cl2 (г) CO (г) + 3 H2 (г) → CH4 (г) + H2O (г) 2 CO (г) + SO2 (г) → ½ S2 (г) + 2 СО2 (г) СО (г) + Cl2 (г) → СОCl2 (г) CO2 (г) + H2 (г) → CO (г) + H2O (г) 2 CO2 (г) → 2 CO (г) + O2 (г) |
Задания в тестовой форме
«ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Занятие № 2
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Обоснование необходимости введения второго закона термодинамики.
2. Некоторые критерии возможности самопроизвольного протекания процессов.
3. Общая формулировка второго закона термодинамики.
4. Что называют обратимыми и необратимыми процессами в термодинамике?
5. Максимальная работа процесса.
6. Энтропия – мера рассеивания энергии.
7. Энтропия – функция состояния системы.
8. Абсолютная энтропия. Стандартная энтропия.
9. Изменение энтропии в стандартных условиях.
10. Определение энтропии с точки зрения статистической физики.
11. Энтропийная формулировка второго начала термодинамики для изолированных систем.
12. Энтропия и ее связь с вероятностью состояния системы. Формула Больцмана.
13. Изменение энтропии, связанное с повышением температуры, фазовыми переходами, изменением давления в системе.
14. Энтальпийный и энтропийный факторы и их влияние на самопроизвольность протекания процесса.
15. Энергия Гиббса, изменение энергии Гиббса в изобарно-изотермическом процессе. Формулировка второго закона термодинамики с точки зрения изменения энергии Гиббса.
16. Стандартная свободная энергия Гиббса образования вещества. Расчет изменения энергии Гиббса в химической реакции при стандартных условиях.
17. Как рассчитать изменение энергии Гиббса химической реакции при нестандартных условиях?
18. Энергия Гиббса, энергия Гельмгольца как критерий самопроизвольного протекания процесса.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 53 – 69 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 25 – 29 c.
Задача 1
Определите изменение энтропии в стандартных условиях для следующей химической реакции:
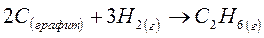
DS0(Сграфит) = 5,7 Дж/моль·К
DS0(H2)г. = 130,6 Дж/моль·К
DS0(C2H6)г. = 229,5 Дж/моль·К
Решение:
Изменение энтропии в химической реакции при стандартных условиях рассчитывается по формуле:
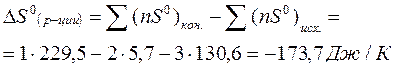
Ответ: - 173,7 Дж/К
Расчет изменения стандартной энергии Гиббса реакции по стандартным значениям энергии Гиббса образования реагентов и продуктов.
Задача 2
Определите возможность протекания реакции в стандартных условиях по величине изменения энергии Гиббса:
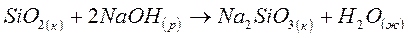
DG0обр.(SiO2)к= - 803,8 кДж/моль
DG0обр.(NaOH)р= - 419,5 кДж/моль
DG0обр.(Na2SiO3)к= -1427,8 кДж/моль
DG0обр.(H2O)ж= - 237,5 кДж/моль
Решение:
В стандартных условиях изменение энергии Гиббса в химической реакции подсчитывается по формуле:
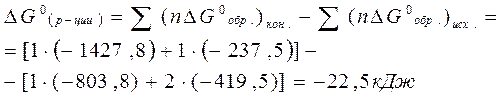 ,
,
т.е. протекание химической реакции возможно, т.к. DG0(реакции).<0
Ответ: протекание химической реакции возможно, т.к.DG0(р-ции)=-22,5 кДж.<0
Расчет изменения стандартной энергии Гиббса реакции по величинам стандартной энтальпии и стандартной энтропии. Анализ энтропийного и энтальпийного факторов.
Задача 3
Вычислите изменение энергии Гиббса при температуре 270С и определите возможность протекания химической реакции
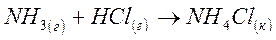
по значениям стандартных теплот образования и энтропий веществ, участвующих в реакции.
| Вещество | NH3 | HCl | NH4Cl |
| DH0обр., кДж/моль | -45,9 | -92,3 | -314,2 |
| S0,Дж/моль·К | 192,6 | 186,8 | 95,8 |
Решение:
Изменение энергии Гиббса в химической реакции при температуре T можно вычислить по уравнению: 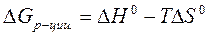
Тепловой эффект химической реакции DH0(р-ции) определяем по 1 следствию из закона Гесса:
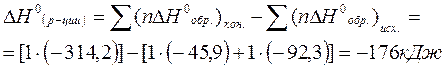
Изменение энтропии в химической реакции:
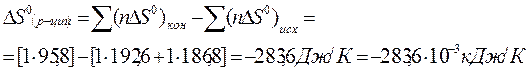
Температура в Кельвинах T = 27+273 = 300K
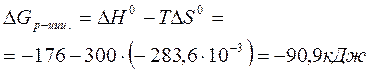 ,
,
т.е. < 0, протекание реакции в прямом направлении возможно.
Ответ: протекание химической реакции в прямом направлении возможно, т.к. DG0 (р-ции)= - 90,9 кДж,т.е.<0
Задачи для самостоятельной работы
1. Рассчитайте изменение энтропии в Дж/К для химической реакции при стандартных условиях

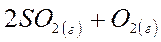
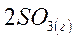
если стандартные энтропии SO2(г), O2(г) и SO3(г) равны 248; 205 и 257 Дж/моль·К, соответственно. Сделайте вывод о направлении самопроизвольного протекания реакции в этих условиях.
2. Для реакции 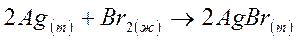 , протекающей при 298 К и 1 атм., DH0 = -199,2 кДж/моль и DG0= -191,6 кДж/моль. Вычислите стандартное изменение энтропии DS0 в кДж/К для этой реакции.
, протекающей при 298 К и 1 атм., DH0 = -199,2 кДж/моль и DG0= -191,6 кДж/моль. Вычислите стандартное изменение энтропии DS0 в кДж/К для этой реакции.
3. В организме человека в результате метаболизма образуется глицерин (CH2OH)2CHOH (ж), который далее превращается в CO2(г) и H2O(г):
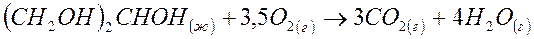
Вычислите DG0 этой реакции в кДж, если
| Вещество | Глицерин (ж) | CO2 (г) | H2O(г) |
| DG0обр., кДж/моль | - 480 | - 395 | - 230 |
4. Рассчитайте изменение свободной энергии Гиббса в кДж при T = 298 К и определите, в каком направлении следующая реакция будет протекать самопроизвольно в стандартных условиях:
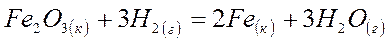
Если DG0обр. Fe2O3 (к) и H2O (г) равны – 741 и – 229 кДж/моль, соответственно, а водорода (г) и железа (к) равны нулю.
5. Рассчитайте изменение свободной энергии Гиббса в кДж при температуре 370С и определите, является ли самопроизвольным процесс окисления глюкозы:
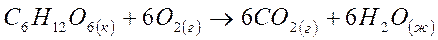
| Вещество | C6H12O6(к) | O2(г) | CO2(г) | H2O(ж) |
| DH0обр., кДж/моль | -1274 | 0 | -394 | -286 |
| S0,Дж/моль·К | 212 | 205 | 214 | 70 |
6. Рассчитайте температуру (в К), при которой в системе

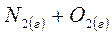
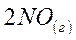
установится термодинамическое равновесие.
| Вещество | N2(г) | O2(г) | NO(г) |
| DH0обр., кДж/моль | 0 | 0 | 90 |
| S0,Дж/моль·К | 192 | 205 | 211 |
Задания в тестовой форме
« II ЗАКОН ТЕРМОДИНАМИКИ.
Занятие № 3
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Что называют химическим потенциалом? Определение. Формула для расчета. Размерность.
2. Уравнение для расчета химического потенциала вещества, находящегося в растворе.
3. Стандартный химический потенциал. Физический смысл данной величины.
4. Термодинамика химического равновесия
5. Что называют стехиометрическим соотношением концентраций Пс?
6. Стандартное изменение энергии Гиббса, его связь с константой равновесия. Вывод формулы.
7. Закон действующих масс. Математическое выражение. Определение.
8. Уравнение изотермы химической реакции. Ее значение для термодинамических определений.
9. Влияние температуры на химическое равновесие.
10. Интегральная и дифференциальная формы изобары и изохоры химической реакции.
11. Термодинамическое обоснование принципа Ле – Шателье.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 69 – 74 с.
Задача 1
Рассчитайте константу химического равновесия реакции гидролиза глицил-глицина при 310 К, если ∆G0 = - 15,08 кДж/моль. Обратима ли практически данная реакция?
R = 8,31∙10-3 кДж/моль∙К
Решение:
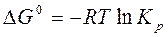
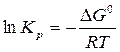
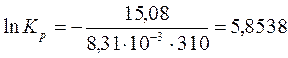
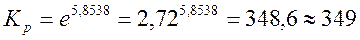
или
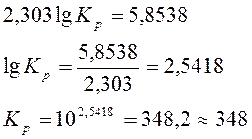
Ответ: 10-5 < 349 < 105 , т.е. реакция обратима.
Расчет по уравнению изотермы реакции. Определение направления обратимой реакции в состоянии, отличающемся от стандартного.
Задача 2
Для реакции СО (г) + Сl2 (г) → СОСl2 (г) константа равновесия равна 6,386 при 600ºС. В каком направлении она будет протекать, если в 1 л реакционной смеси будет находиться:
a) 1 моль СО; 1 моль Сl2; 4 моль СОСl2;
b) 1 моль СО; 1 моль Сl2; 8 моль СОСl2;
c) 1 моль СО; 1,565 моль Сl2; 10 моль СОСl2;
Решение:
При постоянном объеме концентрации газов пропорциональны их количествам, поэтому при расчете величины ПС, входящей в уравнение изотермы, подставляем количества веществ:
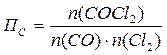
a) 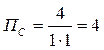
b) 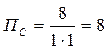
c) 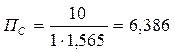
Ответ:
a) Самопроизвольно будет протекать прямая реакция, так как ПС < KP; 4 < 6,386
b) Самопроизвольно будет протекать обратная реакция, так как ПС > KP; 8 > 6,386
c) Система находится в состоянии равновесия так как ПС = KP; 6,386 = 6,386
Задача 3
Реакция образования иодида водорода 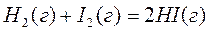 протекает в условиях Робщ.=2 атм.; исходные количества веществ: иода – 1 моль; водорода – 1 моль; иодоводорода – 2 моль; константа этой реакции при 4200С
протекает в условиях Робщ.=2 атм.; исходные количества веществ: иода – 1 моль; водорода – 1 моль; иодоводорода – 2 моль; константа этой реакции при 4200С 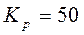 . В каком направлении будет протекать реакция в заданных условиях.
. В каком направлении будет протекать реакция в заданных условиях.
Решение:
Направление процесса в стандартных условиях можно определить по знаку 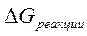 – изменению свободной энергии системы. Энергия Гиббса реакции
– изменению свободной энергии системы. Энергия Гиббса реакции 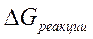 и константа равновесия связаны между собой уравнением изотермы химической реакции:
и константа равновесия связаны между собой уравнением изотермы химической реакции:
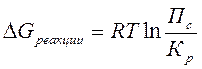
По закону Дальтона рассчитывают парциальные давления участников реакции:
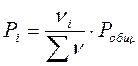
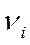 - число молей i – того компонента
- число молей i – того компонента
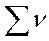 - общее число молей газообразных веществ в смеси.
- общее число молей газообразных веществ в смеси.
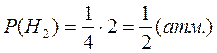
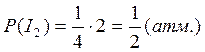
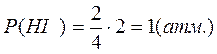
T = 420+273 = 693 K
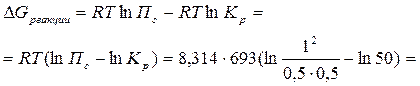
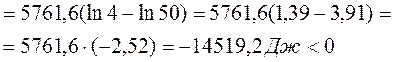
В данных условиях будет протекать процесс образования иодоводорода.
Расчет константы равновесия и стандартной энтальпии реакции по двум константам при разных температурах по уравнению изобары реакции.
Задача 4
Константы равновесия реакции:
Fe3O4 (тв) + 4СО (г) → 3Fe (тв) + 4СО2 (г)
При 1091 К и 1312 К равны 2,49 и 4,50 соответственно. Рассчитайте:
a) стандартную энтальпию реакции;
b) константу равновесия реакции при 1200 К.
Решение:
a) По уравнению изобары химической реакции при Т1 = 1091 К и Т2 = 1312 К рассчитываем ∆Н0.
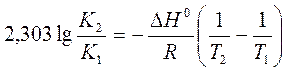
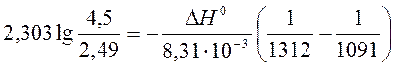
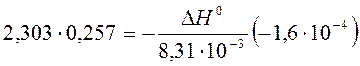
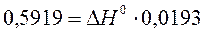
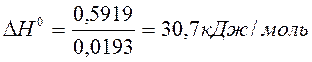
b) Пусть Т1 = 1091 К и Т3 = 1200 К.
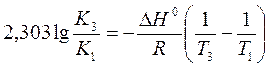
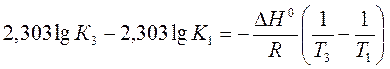
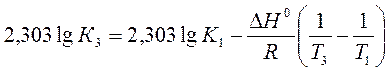
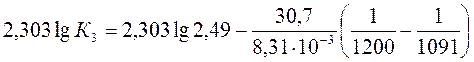
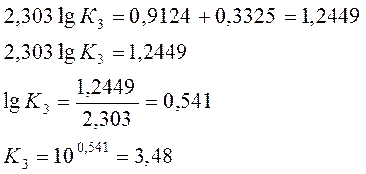
Ответ: a) ∆Н0 = 30,7 кДж/моль b) Кр 1200 = 3,48
Задачи для самостоятельной работы
1. Константа равновесия реакции тепловой денатурации химотрипсиногена при рН = 2 и 50ºС равна 32,7. Вычислите значение стандартной энтальпии процесса, если известно, что 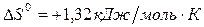 .
.
2. Для некоторой реакции при 227 К, ∆Н0 = - 50 кДж/моль, а ∆S0 = - 100 Дж/моль∙К. Вычислите константу равновесия реакции при указанной температуре.
3. Для реакции 2 NO2 (г) → N2O4 (г) рассчитайте ∆G0 при 298 К, найдите температуру, при которой оба направления процесса равновероятны, если ∆Н0 = - 57 кДж/моль, ∆S0 = - 176 кДж/моль∙К.
4. При 1500ºС константа равновесия реакции: 2 СH4 (г)→C2H2 (г)+3 H2 (г) ∆Н0 = + 376, 5 кДж/моль равна 1,5. Рассчитайте константу равновесия при 1700ºС.
5. Для реакции: 2 СH4 (г) + СО2 (г) → 2 CО (г) + 2 H2 (г) ∆Н0 = + 376, 5 кДж/моль, константа равновесия при 958 К равна 1. Рассчитайте константы равновесия при 900 К и 1000 К.
6. Для реакции: Н2О (г) + СО (г) → СО2 (г) + Н2 (г) Константы равновесия равны при 800ºС К = 2,87, а при 1000ºС К = 1,39. Вычислите стандартную энтальпию этой реакции:
a) по уравнению изобары
b) по одному из следствий закона Гесса
Сопоставьте полученные данные.
7. Для реакции: COCl2 (г) → CO (г) + Cl2 (г) Константы равновесия при 127ºС К = 33400, а при 227ºС К = 1520. Вычислите стандартную энтальпию этой реакции в указанном температурном интервале.
8. Реакция образования оксида азота (II) 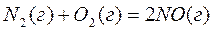 протекает в условиях: Робщ.= 2атм., исходные количества веществ – азота – 1 моль; кислорода – 1 моль; оксида азота (II) – 2 моль; константа равновесия этой реакции при t=5000С равна 0,25. В каком направлении будет протекать реакция в заданных условиях.
протекает в условиях: Робщ.= 2атм., исходные количества веществ – азота – 1 моль; кислорода – 1 моль; оксида азота (II) – 2 моль; константа равновесия этой реакции при t=5000С равна 0,25. В каком направлении будет протекать реакция в заданных условиях.
9. Изменение свободной энергии Гиббса реакции образования иодоводорода 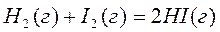 протекающей при t = 4200С равно –14519,2 кДж. Исходные количества веществ: иода-1 моль; водорода – 1 моль; иодоводорода – 2 моль. Общее давление в системе 2 атм. Рассчитайте Kp в заданных условиях.
протекающей при t = 4200С равно –14519,2 кДж. Исходные количества веществ: иода-1 моль; водорода – 1 моль; иодоводорода – 2 моль. Общее давление в системе 2 атм. Рассчитайте Kp в заданных условиях.
Задания в тестовой форме
«ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ. ТЕРМОДИНАМИКА ХИМИЧЕСКОГО РАВНОВЕСИЯ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Химическим потенциалом вещества (Х) в данной системе называется величина, которая определяется
A. энергией Гиббса, приходящейся на 1 г вещества
B. энергией Гиббса, приходящейся на 1 моль вещества
C. внутренней энергией системы
D. энтальпией образования, приходящейся на 1 моль вещества
2. Химический потенциал обозначается буквой
A. υ
B. Е
C. μ
D. n
3. Выберете правильную формулу для расчета величины химического потенциала
A. Н = Е + pV
B. 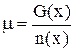
C. S = KБ ln w
D. μ = μ0(х) + RT ln C(x)
4. Химический потенциал измеряется в
A. кал
B. Дж/моль
C. кДж/моль
D. ккал
5. Химический потенциал вещества (Х), находящегося в растворе зависит от
A. концентрации растворенного вещества в растворе
B. температуры
C. давления
D. природы растворителя
6. Стандартный химический потенциал μ0(х) равен химическому потенциалу вещества при
A. Р = 1 атм
B. Т = 298 К
C. концентрации вещества 1 моль/л
D. концентрации вещества 1 г на 1000 г растворителя

 7. Для обратимой реакции аА + вВ рР + qQ стехиометрическим соотношением концентраций веществ, участвующих в реакции является выражением
7. Для обратимой реакции аА + вВ рР + qQ стехиометрическим соотношением концентраций веществ, участвующих в реакции является выражением
A. 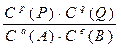
B. 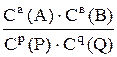
C. 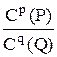
D. 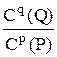
8. ΔG0 реакции связаны с константой равновесия следующим соотношением
A. ΔG0 = RT lg Kр
B. ΔG0 = - RT lg Kр
C. ΔG0 = - RT ln Kр
D. ΔG0 = RT ln Kр
9. Равновесные концентрации вещества (Х) обозначают
A. буквой С(х)
B. буквой Сравн.
C. круглыми скобками
D. квадратными скобками
10. В состоянии термодинамического равновесия изменение энергии Гиббса системы
A. Δ G = 0
B. Δ G > 0
C. Δ G < 0
D. Δ G = 1
11. Уравнение изотермы химической реакции имеет вид
A. ΔG0 = RT ln Kр
B. 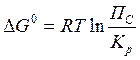
C. 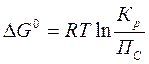
D. ΔG0 = - RT ln Kр
12. Процесс будет протекать самопроизвольно, если
A. Пс > Кр
B. Пс = Кр
C. Пс < Кр
D. Кр = 1
13. Интегральная форма изобары химической реакции имеет вид
A. 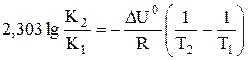
B. 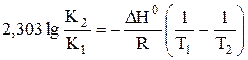
C. 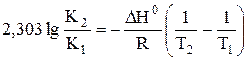
D. 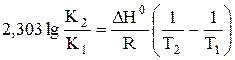
14. Дифференциальная форма изобары химической реакции имеет вид
A. 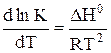
B. 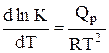
C. 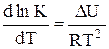
D. 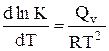
15. Если реакция протекает в условиях р = const, то при повышении температуры Т2 > Т1
A. увеличится выход продуктов в прямой реакции, если реакция эндотермическая
B. увеличится выход продуктов в прямой реакции, если реакция экзотермическая
C. равновесие реакции не сместится, если она не сопровождается тепловым эффектом
D. уменьшится выход продуктов, если реакция экзотермическая
16. Нужно ли повышать температуру в условиях Р = const экзотермической реакции, чтобы увеличить выход продуктов реакции: Т2 > Т1
A. Да
B. Нет
C. Не знаю
17. Дифференциальная форма изохоры химической реакции имеет вид
A. 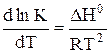
B. 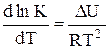
C. 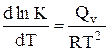
D. 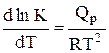
18. Рассчитать Кр, при изменении температуры, если известен тепловой эффект реакции, можно по уравнению
A. изотермы химической реакции
B. изобары химической реакции
C. изохоры химической реакции
Занятие № 4
План занятия
1. Проверка посещаемости и информация
2. Решение ситуационных задач
3. Защита лабораторных работ
4. Подведение итогов занятия
Ситуационные задачи
Задача 1.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для гидролиза сложноэфирной связи; ∆G0 = - 10,48 кДж/моль.
Задача 2.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для переноса ацетильной группы при гидролизе ацетилкофермента А, ∆G0 = - 34,36 кДж/моль.
Задача 3.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции:
АТФ + АМФ → 2 АДФ ∆G0 = - 2,10 кДж/моль.
Задача 4.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции:
креатин + фосфат → креатинфосфат + Н2О ∆G0 = 29,33 кДж/моль.
Задача 5.
Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции дегидратации лимонной кислоты с образованием цис-аконитовой кислоты ∆G0 = 8,36 кДж/моль.
Задача 6.
Сделайте заключение о практической обратимости реакции в стандартном состоянии рассчитав константу равновесия при 310 К для гидратации цис-аконитовой кислоты с образованием изолимонной кислоты ∆G0 = - 1,68 кДж/моль.
Задача 7.
Константа равновесия реакции N2O4 (г) → 2 NO2 (г) при 25ºС равна 4,64 ∙ 10-3. В каком направлении будет идти реакция при следующих концентрациях веществ:
a) С (NO2) = 0,05 моль/л; С (N2O4) = 0 моль/л;
b) С (NO2) = 0 моль/л; С (N2O4) = 0,05 моль/л;
c) С (NO2) = 0,0107 моль/л; С (N2O4) = 0,0246 моль/л;
d) С (NO2) = 0,0095 моль/л; С (N2O4) = 0,046 моль/л.
Задача 8.
Константа равновесия реакции:
PCl5 (г) → PCl3 (г) + Cl2 (г)
при 250ºС равна 2. В каком направлении идет реакция при следующих концентрациях С (PCl5) = С (PCl3) = 1 моль/л и С (Сl2) = 2 моль/л.
Задача 9.
В организме человека протекают реакции превращения глюкозы:
1) С6Н12О6 (к) ↔ 2 С2Н5ОН (ж) + 2 СО2 (г)
2) С6Н12О6 (к) + 6 О2 (г) ↔ 6 СО2 (г) + 6 Н2О (ж)
Какая из этих реакций поставляет организму больше энергии? Ответ обоснуйте.
Задача 10.
В организме человека протекают реакции:
1) АТФ + Н2О → АДФ + Н3РО4; ∆G = - 29,2 кДж/моль
2) глюкоза + Н3РО4 → глюкоза-6-фосфат + Н2О; ∆G = 13,1 кДж/моль
Чему равна ∆G суммарного процесса:
глюкоза + АТФ → глюкоза-6-фосфат + АДФ
и какой вывод о его самопроизвольности можно сделать? Ответ обоснуйте.
Учебные элементы модуля
| Закон Вант-Гоффа для растворов неэлектролитов | Р = С R Т Р - осмотическое давление С - молярная концентрация вещества R - универсальная газовая постоянная Т - абсолютная температура |
| Закон Вант-Гоффа для растворов электролитов | Р = i CRT Р - осмотическое давление С - молярная концентрация вещества i - изотонический коэффициент R - универсальная газовая постоянная Т - абсолютная температура |
| Изотонический коэффициент | i = a ( n –1)+1 a - степень диссоциации или ассоциации, выраженная в долях единицы, n - число ионов, образующихся при диссоциации одной молекулы или число, обратное количеству молекул в одном ассоциате (полимерной молекуле) |
| 1-й закон Рауля для растворов неэлектролитов | 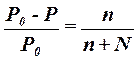 Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
|
| 1-й закон Рауля для растворов электролитов | 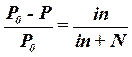 Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
i - изотонический коэффициент
Р0 - давление пара чистого растворителя
Р - давление пара растворителя над раствором
n - число молей растворенного вещества
N - число молей растворителя
i - изотонический коэффициент
|
| 2-ой закон Рауля для растворов неэлектролитов | 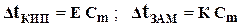 Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
Cm - моляльная концентрация
Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
Cm - моляльная концентрация
|
| 2-ой закон Рауля для растворов электролитов | 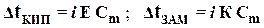 Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
i - изотонический коэффициент
Cm - моляльная концентрация
Dt КИП = t КИП. РАСТВОРА – t КИП. РАСТВОРИТЕЛЯ – изменение температуры кипения
Dt ЗАМ = t ЗАМ. РАСТВОРИТЕЛЯ – t ЗАМ. РАСТВОРА – изменение температуры замерзания
Е - эбуллиоскопическая константа
К - криоскопическая константа
i - изотонический коэффициент
Cm - моляльная концентрация
|
Занятие № 5
Термодинамика фазовых равновесий. Основные понятия. Правило фаз Гиббса. Диаграммы состояния однокомпонентных систем.
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Основные понятия: фаза, гомо- и гетерогенные системы.
2. Фазовый переход. Определение. Примеры фазовых переходов: парообразование, испарение, сжижение. Возгонка (сублимация), десублимация. Плавление, отвердевание.
3. Полиморфизм, аллотропия.
4. Число составляющих веществ. Компоненты системы. Правило фаз Гиббса. Системы моно-, би- и безвариантные.
5. Фазовое равновесие. Определение. Понятие о динамическом равновесии. Условия фазового равновесия.
6. Однокомпонентные системы. Правило фаз Гиббса для однокомпонентных систем.
7. Диаграмма состояния. Определение.
8. Диаграмма состояния воды. Анализ диаграммы.
9. Диаграмма состояния серы. Анализ диаграммы. Понятие энантиотропных превращений.
10. Уравнение Клаузиуса-Клайперона.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 113 – 130 с.
Задача 1
Лед плавится при Т = 273 К под давлением 101325 Па, удельный объем льда при этой температуре 991,1 см3/кг, а воды 916,6 см3/кг. Молярная теплота плавления льда 6010 Дж/моль. Вычислить давление при котором лед будет плавиться при 271 К.
Дано:
Т1 = 273 К
Р1 =101325 Па
Vуд.тв = 991,1 см3/кг
Vуд. ж = 916,6 см3/кг
∆Н = 6010 Дж/моль
Т2 = 271 К
 Р2 = ?
Р2 = ?
|  Решение:
1. Находим изменение объема при плавлении льда.
∆ V = Vж – Vтв = (916,6 – 991,1) =
= 74,5 см3/кг = - 74,5•10-6 м3/кг
2. Находим изменение молярного объема.
∆ Vмол = ∆ Vуд • М = - 74,5•10-6 • 18,0 •10-3 =
= - 1341•10-9 м3/моль = - 1,341•10-6 м3/моль
3. По уравнению Клайперона-Клаузиуса Решение:
1. Находим изменение объема при плавлении льда.
∆ V = Vж – Vтв = (916,6 – 991,1) =
= 74,5 см3/кг = - 74,5•10-6 м3/кг
2. Находим изменение молярного объема.
∆ Vмол = ∆ Vуд • М = - 74,5•10-6 • 18,0 •10-3 =
= - 1341•10-9 м3/моль = - 1,341•10-6 м3/моль
3. По уравнению Клайперона-Клаузиуса
|
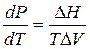
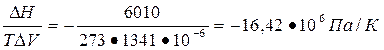
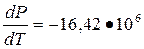
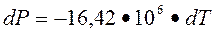
Для малого интервала температур можно принять
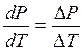
∆Р = Р2 – Р1 = - 16,42•106•∆Т
Р2 = Р1 – 16,42•106•∆T
P2 = 101325 – 16,42•106 • (271-273) = 1,01•105 + 32,84•106 = 329,41•105 ≈ 330•105
Таким образом при уменьшении температуры плавления на 2 К давление должно возрасти с 1,01•105 до 330•105.
Ответ: P2 = 330•105 Па
Задачи для самостоятельной работы
1. При нагревании ромбическая сера переходит в моноклинную. При этом изменение объема составляет ∆V = 1,38•10-5 м3/кг. Температура перехода равна 96,7º С, а ее изменение с давлением определяется коэффициентом 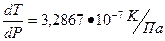 . Определить молярную теплоту фазового перехода (∆ Н в Дж/моль). Молярная масса серы равна 32 г/моль.
. Определить молярную теплоту фазового перехода (∆ Н в Дж/моль). Молярная масса серы равна 32 г/моль.
2. Рассчитать молярную теплоту плавления дифениламина, если плавление 1 кг дифениламина сопровождается увеличением объема на 9,58•10-5 м3/кг, 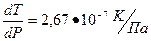 . Температура плавления дифениламина 54º С, молекулярная масса 169 г/моль.
. Температура плавления дифениламина 54º С, молекулярная масса 169 г/моль.
3. Давление паров диэтилового эфира при 20º С и 30º С соответственно равны 58945 и 866285 Па. Рассчитать теплоту испарения эфира в указанном интервале температур.
4. Давление пара этилового эфира при t = - 10º С равно 15300 Па, а при 0º С 24600 Па. Рассчитать молярную теплоту испарения эфира.
5. Давление паров бензола при температурах 15,4º С и 60,6º С равны соответственно 8 и 53,3 кПа. Определить молярную теплоту испарения бензола.
6. Рассчитать давление насыщенного пара воды при 25º С, если молярная теплота испарения воды 42,7 кДж/моль, температура кипения 100º С при нормальном давлении Р = 101325 Па.
Задания в тестовой форме
«ТЕРМОДИНАМИКА ФАЗОВЫХ РАВНОВЕСИЙ. ОСНОВНЫЕ ПОНЯТИЯ. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Совокупность гомогенных частей системы, имеющих одинаковые химические, физические и термодинамические характеристики называется
A. фазой
B. фазовым переходом
C. поверхностью раздела
2. Системы, у которых отдельные компоненты находятся в одной фазе и отсутствуют поверхности раздела называются
A. равновесными
B. гомогенными
C. стационарными
3. Примерами гетерогенной системы являются
A. этиловый спирт + вода
B. лед + вода
C. бензол + вода
4. Система является гетерогенной, если
A. Ф = 1
B. Ф = 2
C. Ф = 3
5. Переход вещества из одного агрегатного состояния в другое, а также изменение его аллотропной или полиморфной модификации называется
A. процессом
B. фазовым переходом
C. химическим явлением
6. Переход вещества из жидкого состояния в газообразное называется
A. испарением
B. сжижением
C. парообразованием
7. При нагревание металлический йод из твердого состояния переходит в газообразное, то есть происходит
A. испарение
B. сублимация
C. возгонка
8. При нагревании хлорида аммония происходит реакция
NH4Cl ↔ NH3 ↑ + HCl ↑.
Этот процесс называют
A. парообразованием
B. испарением
C. сублимацией
9. Явление, когда данный элемент способен существовать в виде различных простых веществ называется
A. вариантность
B. полиморфизмом
C. аллотропией
10. Если веществу в твердом состоянии соответствуют две, три или больше модификаций, различающиеся по внутреннему строению и свойствам, то это явление называют
A. аллотропией
B. полиморфизмом
C. изомерией
11. Чему равно число составляющих веществ в водном растворе поваренной соли
NaCl ↔ Na+ + Cl –
H2O ↔ H+ + OH –
A. трем
B. двум
C. четырем
12. Число составляющих веществ в водном растворе хлорида калия равно
КCl ↔ К+ + Cl –
H2O ↔ H+ + OH –
A. четырем
B. трем
C. двум
13. Число составляющих веществ в водном растворе этилового спирта равно
С2Н5ОН
H2O ↔ H+ + OH –
A. двум
B. трем
C. четырем
14. В водном растворе хлорида натрия число компонентов равно
A. четырем
B. трем
C. двум
15. Число составляющих веществ равно числу компонентов, если между ними
A. возможна одна химическая реакция
B. невозможны никакие химические реакции
C. возможны две химические реакции
16. Чему равно число независимых компонентов в растворе хлорида калия в условиях полной диссоциации? Ответ поясните.
A. 1
B. 2
C. 3
17. Сколько параметров (давление, температуру, концентрации) можно одновременно и произвольно менять, не изменяя числа фаз равновесной системы показывает
A. число степеней свободы
B. вариантность
C. количество степеней свободы
18. Число степеней свободы увеличивается с увеличением
A. числа компонентов
B. числа фаз
C. числа внешних параметров
19. Между числом степеней свободы (С), числом компонентов (К) и числом фаз (Ф) существует следующая зависимость
A. С = К + Ф +П
B. С = К – Ф + П
C. С = К + Ф – П
20. Системы, не имеющие ни одной степени свободы называются
A. нонвариантными
B. инвариантными
C. безвариантными
21. Если при изменении хотя бы одного из параметров равновесие системы смещается и одна из фаз исчезает, то такие системы называются
A. моновариантными
B. нонвариантными
C. безвариантными
22. Выберите правильное выражение для однокомпонентной системы, если число внешних параметров равно 2
A. С = 3 - Ф
B. С = 2 - Ф
C. С = 1 – Ф
23. Графическая зависимость состояния системы от внешних условий или от состава системы называется
A. диаграммой состава
B. диаграммой состояния
C. фазовой диаграммой
24. Может ли в однокомпонентной системе одновременно присутствовать больше трех фаз? Ответ поясните.
A. да
B. нет
C. не знаю
25. Чему равно число степеней свободы для точки Х, находящейся внутри области “тв”? Ответ поясните .
A. 1
B. 2
C. 3
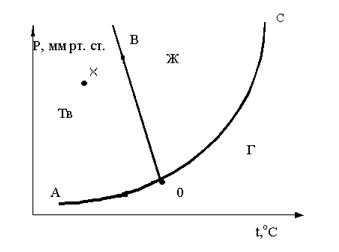
26. Если находясь в точке трехфазного состояния внешние условия системы изменить T↓, P = const то образуется
A. жидкая вода
B. лед
C. пар
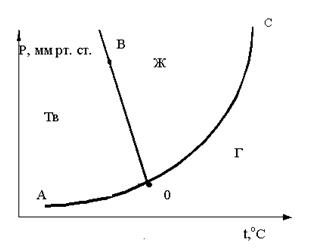
27. Чему равно число степеней свободы для точки K, находящейся на линии ОА? Ответ поясните .
A. 2
B. 3
C. 1
28. Исходя из графика определите, каким образом нужно изменить внешние условия, чтобы из точки трехфазного состояния системы перейти в область Ж
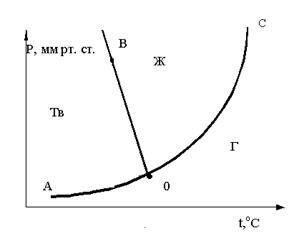
A. T↓, P = const
B. P↑, T = const
C. P↓, T = const
29. Выберите правильные координаты тройной точки на диаграмме состояния воды
A. t ≈ 0,1C° P = 4,6 мм. рт. ст.
B. t ≈ 0,01C° P ≈ 4,6 мм. рт. ст.
C. t ≈ 0,01C° P = 4,6 мм. рт. ст.
30. Чему равно число степеней свободы для точки Q на диаграмме состояния серы? Ответ поясните .
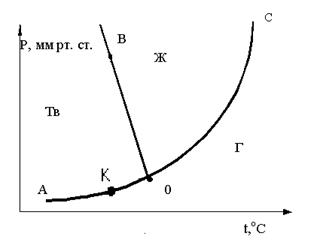
A. 2
B. 1
C. 0
31. Чему равно число степеней свободы для точки P на диаграмме состояния серы. Ответ поясните .
A. 2
B. 1
C. 0
32. Чему равно число степеней свободы для точки B на диаграмме состояния серы? Ответ поясните .
A. 1
B. 0
C. 2
33. Две модификации серы находятся в равновесии при температуре
A. 9,54ºС
B. 95,4°С
C. 25°С
34. Обратимые превращения модификаций называются
A. динамическими
B. аллотропными
C. энантиотропными
35. Если изменяют температуру то фазовое равновесие сохранится только при соответствующем изменении давления, и наоборот. Эту зависимость показывает
A. уравнение Гиббса
B. уравнение Менделеева-Клайперона
C. уравнение Клаузиуса-Клайперона
36. Уравнение Клаузиуса-Клайперона показывает зависимость между соответствующими изменениями
A. внутренней энергии и энтальпии
B. объема и температура
C. давления и температуры
Занятие № 6 - 7
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Практическое построение диаграмм состояния бинарных систем. Определение по диаграммам:
- состава смеси
- характеристических точек
- числа степеней свободы в любой точке и области диаграммы
5. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Фазовое равновесие раствор-пар растворителя. Закон Рауля. Определение. Математическое выражение.
2. Следствия из закона Рауля. Определение. Математическое выражение.
3. Понятие об идеальных смесях.
4. Диаграмма "давление-состав" для идеальных смесей.
5. Формула для расчета состава пара в идеальных смесях (вывод).
6. Первый закон Коновалова. Математическое обоснование.
7. Расширенный вариант диаграммы "давление-состав".
8. Диаграмма "температура-состав" для идеальных смесей.
9. Правило рычага. Определение. Математическое выражение.
10. Неидеальные смеси. Положительное и отрицательное отклонение от закона Рауля.
11. Второй закон Коновалова. Азеотропные смеси.
12. Анализ диаграммы азеотропной смеси с положительным отклонением от закона Рауля (отрицательным отклонением).
13. Диаграммы плавкости, когда компоненты неограниченно растворимы и в жидком и в твердом состоянии. Линия ликвидуса. Линия солидуса.
14. Диаграммы плавкости, когда компоненты взаимно нерастворимы в твердом состоянии. Линии ликвидуса, солидуса. Точка эвтектики.
15. Правило рычага Определение относительного количества твердой и жидкой фаз.
16. Применение диаграмм плавкости.
17. Простая перегонка.
18. Фракционная перегонка. Ректификация.
19. Особенности жидких смесей с взаимно нерастворимыми жидкостями. Перегонка с водяным паром.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010.– 130 – 137, 140 – 156, 168 – 170 с.
Задача 1
Бензол и толуол образуют идеальный раствор при 30ºС, давление чистого бензола 15705 Па и толуола 4661 Па. Для раствора, содержащего 117,2 г бензола и 844,4 г толуола определить: мольные доли компонентов в растворе; парциальные давления компонентов; общее давление пара над раствором; мольные доли компонентов в паре.
| Дано: Р01 = 15705 Па Р02 = 4661Па m1 = 117,2 г m2 = 844,4 г |
Решение:
M(бензола C6H6) =78 г/моль;
M(толуола C6H5-СН3) =92 г/моль;
|
| Р1 = ? Р2 = ? Робщ = ? χ1 = ? χ2 = ? |
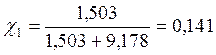
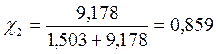
Р1 = χ1Р01 = 0,141 • 15705 = 2214,4 Па
Р2 = χ2Р02 = 0,859 • 4661 = 4003,8 Па
Робщ = Р1 + Р2 = 2214,4 + 4003,8 = 6218,2 Па
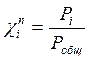 - мольная доля компонента i в паре
- мольная доля компонента i в паре
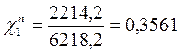
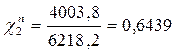
Таким образом в паре повышается содержание более летучего компонента – бензола (1), т.к. по условию Р01>Р02
Расчетные задачи на I и II законы Рауля
Задача 2
Определить давление насыщенного пара над водным раствором сахарозы, моляльная концентрация которого равна 0,2 моль/кг, если давление насыщенного пара чистой воды равно 24 мм.рт.ст.
| Дано: Сm = 0,2 моль/кг Р0 = 24 мм.рт.ст. | Решение: Сm = 0,2 моль/кг означает, что 0,2 моль сахарозы содержится в 1 кг H2O, т.е. n = 0,2 моль |
| Р = ? |
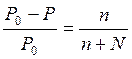
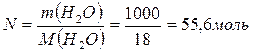
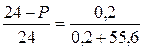
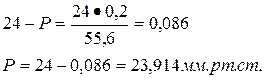
Ответ: 23,914 мм.рт.ст.
Задача 3.
На сколько понизится температура замерзания раствора, если 2,76 г глицерина С3Н5(ОН)3 растворить в 200 г воды (Кводы=1,86)?
| Дано: m(в-ва) = 2,76 г m(Н2О) = 200 г Кводы=1,86 |
Решение:
Ответ: 0,279ºC |
| ∆tзам = ? |
Эталоны решения задач по диаграммам состояния
Задача 4
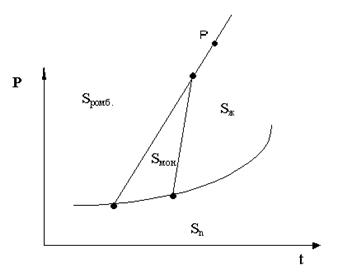
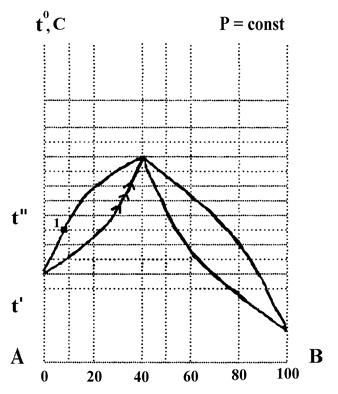
По диаграмме состояния компонентов А и В, построенной в координатах температура кипения - состав (см. рис. 1), определить:
1. К какому типу относится данная система?
2. Что представляет собой система состава 80% А и 20% В при температуре t'. Какими степенями свободы она обладает?
3. При какой температуре начнется кипение этой системы? Каким компонентом будет обогащаться пар, образующийся при ее кипении?
4. На какие составляющие можно разделить исходную систему ректификацией?
5. Как называют смесь состава 60% А и 40% В? Какими свойствами она обладает?
Рис. 1. Диаграмма “Температурного кипения – состав” компонентов А и В
Решение:
1. Изображенная диаграмма характерна для неограниченно смешивающихся жидкостей.
2. Система представляет собой гомогенную жидкость (раствор). По правилу фаз: С = К – Ф + 1 = 2 – 1 + 1 = 2, т.е, произвольно можно задавать температуру и состав.
3. Кипение системы начнется при t''. Пар будет обогащаться компонентом А. Его состав: 90% А и 10% 3 (точка 1).
4. Жидкая фаза будет обогащаться компонентом В и ее температура кипения будет непрерывно расти. Изменение состава жидкой фазы при кипении изображено на рисунке стрелками.
5. Так как пар обогащается компонентом А, а жидкость компонентом В, то при ректификации в паровой фазе можно получить чистый компонент А, а в жидкой - азеотропную смесь.
6. Смесь состава: 60% А и 40% В называют азеотропной (или нераздельнокипящей). Такая смесь имеет экстремальную температуру кипения (в данном примере – максимальную). При кипении образуется пар такого же состава, как и состав жидкой фазы. Поэтому азеотропную смесь нельзя разделить на компоненты ректификацией при постоянном давлении.
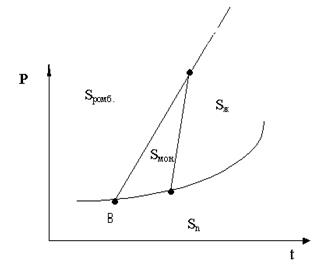
Задача 5
По диаграмме плавкости системы компонентов А - В (см. рис. 2), которая построена в координатах температура - состав в массовых процентах, определить.
К какому типу относится данная система?
Что представляет собой система состава 80% А + 20% В при температуре t', какими степенями свободы она обладает?
При какой температуре начнется кристаллизация в этой системе? Какое вещество (компонент) будет кристаллизоваться при этой температуре?
Как будет изменяться состав системы при медленном охлаждении и при какой температуре закончится кристаллизация? Каковы состав и весовое количество фаз первоначальной системы, если провести ее резкое охлаждение до температуры t''', общий вес системы принять равным 1 кг. Какими степенями свободы обладает система в этом состоянии?
Что представляет собой система и какими степенями свободы она обладает при температуре t''''?
Решение:
1. Изображенная на диаграмме система относится к таким системам, которые образованы веществами, неограниченно растворимыми в жидком состоянии и нерастворимыми в твердой состоянии.
2. Система заданного состава характеризуется фигуративной точкой а. Она представляет собой гомогенную (однофазную) систему – раствор (расплав). Согласно правилу фаз С = К – Ф + 1 = 2 – 1 + 1 = 2, т.е. в однофазном состоянии произвольно можно изменять температуру и состав системы.
Рис. 2 Диаграмма плавкости компонентов А и В
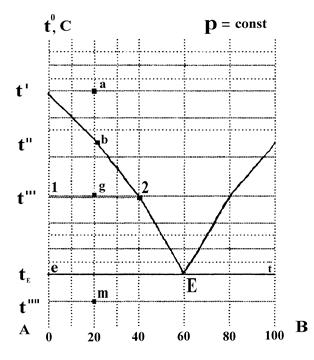
3. Кристаллизация компонента А начнется при температуре t''. Состав этой кристаллической фазы можно найти по изотерме (точка b). Кристаллизация компонента А приведет к увеличению в растворе содержания компонента В, а, в связи с этим, к понижению температуры кристаллизации компонента А по линии bE. Кристаллизация компонента А будет продолжаться до температуры tE. В точке Е состав жидкой фазы: 40% А и 60% В. Из такой жидкой фазы при дальнейшем охлаждении кристаллизуются оба компонента А и В (им соответствуют точки е и t). При этом температура не изменяется и в равновесии сосуществуют кристаллы А, кристаллы В и жидкая фаза (точка Е называется эвтектической точкой). В этом состоянии система не имеет степеней свободы (С = 0), поэтому температура кристаллизации остается постоянной до тех пор, пока не исчезнут последние капли жидкой фазы. После этого твердая фаза, состоящая из кристаллов А и В, будет охлаждаться.
4. При резком охлаждении системы до t''' (точка g) состав жидкой фазы значительно изменится вследствие выпадения кристаллов компонента А. Составы равновесных фаз можно найти, используя термическое условие фазовых равновесий. Точка 1 определяет состав твердой фазы (компонент А), точка 2 - состав равновесной жидкой фазы (60% А и 40% В): из точки 2 опускают перпендикуляр и определяют состав жидкой фазы. По диаграмме состояния можно не только определить состав находящихся в равновесии фаз, но и оценить их относительное и абсолютное количество, Для этой цели служит правило рычага, согласно которому:
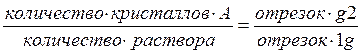
В рассматриваемом состоянии системы при температуре t''' общий (валовый) состав системы 80% А и 20% В, а в жидкой фазе 60% А и 40% В. Принимая общий вес 1 кг, получим:
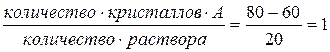
т ,е, вес кристаллов А и раствора одинаковые (по 0,5 кг).
При t''' система, заданная точкой a, имеет одну степень свободы (можно произвольно менять либо температуру, либо состав).
5. При t'''' в системе нет жидкой фазы. Точка m характеризует гетерогенную двухфазную систему, содержащую 20% В и 80% А, система имеет одну степень свободы (С = 1), которой может быть только температура, так как компоненты в твердом виде не образуют растворов и понятие «концентрация» теряет смысл.
Задача 6
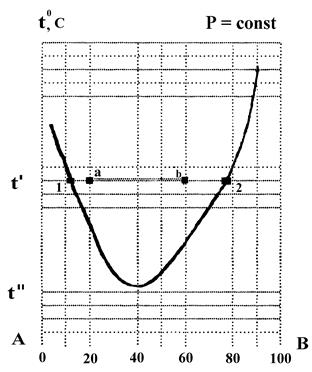
По диаграмме состояния компонентов А и В, построенной в координатах: температура смешения - состав (см. рис. 3) определить:
Рис. 3 Диаграмма состояния системы ограниченно растворимых компонентов А и В с нижней критической температурой смешения
1. К какому типу относится данная система?
2. Что представляет собой система состава: 80% А и 20% В при температуре t'? Какими степенями свободы она обладает?
3. Каков состав равновесных фаз при температуре t'?
4. Как изменяется растворимость с понижением температуры?
5. Что представляет собой исходная система при температуре t'', какими степенями свободы она обладает?
6. Какие изменения произойдут в системе при температуре t'', если содержание компонента А изменится от 80% до 40%.
Решение:
1. Изображенная диаграмма характерна для ограниченно-смешивающихся жидкостей с нижней критической температурой смешения.
2. Заданная система характеризуется фигуративной точкой а.
3. При температуре t' - она двухфазна. Составы фаз можно определить по точкам пересечения изотермы с кривыми растворимости (точки 1 и 2). Число степеней свободы С = 2 - 2 + + 1 = 1, т.е. произвольно можно задавать или температуру или концентрацию насыщенных растворов.
4. Составы фаз: фаза компонента А (точка 1) содержит 90% А и 10 % В; фаза компонента В (точка 2) содержит 20% А и 80% В
5. С понижен ней температуры растворимость компонентов растет.
6. При температуре t'' система состава 80% А и 20% В становится однофазной и обладает двумя степенями свободы, т.е., произвольно можно задавать температуру и концентрацию.
7. При содержании компонента А - 40 % (фигуративная точка b) система остается двухфазной. Составы фаз не изменяются (они определяются точками 1 и 2), изменится весовое соотношение между фазами.
Эталон построения диаграммы состояния, нахождение характеристических точек
Задача 7
Дана зависимость составов жидкой фазы и находящегося с ней в равновесии пара от температуры для двухкомпонентной жидкой системы А - В при постоянном давлении.
А - Н2О; В - С3Н8О – пропанол
| Молярный состав В, % | ж.ф | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
| пар | 0 | 40 | 57 | 60 | 70 | 75 | 100 | |
| Т, ºС | 100 | 95,0 | 90,8 | 87,7 | 89,2 | 91,5 | 97,8 | |
1. Построить диаграмму кипения Н2О - С3Н8О в координатах “Т - состав”. Определить тип бинарной смеси.
2. Определить точки, соответствующие равновесию фаз одинакового состава. Описать их качественный и количественный состав (точки А, Б, В).
3. Рассчитать число степеней свободы в точках А, Б, В и точке ХВ, соответствующей 40 % С3Н8О, при Т1 = 94ºС.
Для системы, содержащей ХВ = 40 % С3Н8О, определить:
4. Температуру начала кипения системы (т. 4)
5. Состав первой капли конденсата (пара) над этой системой (т. 5).
6. Температуру конца кипения (т. 6).
7. Состав последней капли жидкой фазы (т. 7).
8. Состав и массу пара и жидкой фазы при Т1 = 94 ºС, если масса всей системы равна 2 кг.
Решение:
1. Для построения диаграммы состояния необходимо определить масштаб по оси абсцисс - ось состава и ось ординат - ось температур.
Состав изменяется от 0 до 100 % или от 0 до 1 мольных долей, значит ось абсцисс надо разделить на 10 одинаковых частей (1 деление = 10 % или 0,1 мольная доля).
В нашем случае интервал температур ∆Т = Тmax - Tmin = 100 - 87 = 13 ºС. Удобно взять также 10 делений (1 деление = 2 ºС), начиная с 80 ºС.
Нанести деления на оси координат согласно выбранного масштаба.
При построении диаграммы кипения надо знать, что каждой температуре, кроме температур кипения чистых жидкостей, соответствует две точки, определяющие состав жидкой фазы и состав равновесного с ней пара.
На ось ординат наносим точки, соответствующие температуре кипения чистых жидкостей: т.А Ткип = 100 ºС Н2О и т.Б Ткип = 97,8 ºС С3Н8О. Для каждой температуры мысленно проводим горизонталь и отмечаем точки, соответствующие содержанию компонента В (С3Н8О) в жидкой фазе и паре разными символами, например ▲ и ●. Последовательно соединяя точки, соответствующие составу жидкой фазы, получаем линию жидкости; соединяя точки, соответствующие составу пара - линию пара.
Диаграмм кипения “Т - состав” для системы Н2О - С3Н8О с положительным отклонением от закона Рауля (рис.4).
Рис. 4 Диаграмма кипения “Т - состав” для системы Н2О - С3Н8О

2. Равновесию фаз одинакового состава соответствуют точки:
| т. А - температура кипения H2O | ТА = 100 ºС | 100 % H2O в жидкой фазе и паре |
| т. Б - температура кипения С3Н8О | ТБ = 97,8 ºС | 100 % С3Н8О в жидкой фазе и паре |
| т. В - температура кипения азеотропной смеси | ТВ = 87,7 ºС = min | состав 60 % С3Н8О и 40 % H2O в жидкой фазе и паре |
3. Число степеней свободы для диаграммы состояния “Т - состав” рассчитывают по уравнению Гиббса С = К - Ф + 1, т.к. они построены при условии P = const.
Для т. А и Б:
К = 1 чистые С3Н8О или H2O
Ф = 2 жидкость и пар
С = 1-2+1 = 0 система нонвариантна
Для т. В - азеотропная смесь, состав жидкой и газообразной фаз одинаков, поэтому считаем, что смесь ведет себя как чистое вещество: К = 1, Ф = 2, С = 1-2+1 = 0
Для т. 1, где ХВ = 40 %, при Т1 = 94 ºС:
К = 2 чистые С3Н8О и H2O
Ф = 2 жидкость и пар
С = 2-2+1 = 1
4. Смесь, содержащая 40 % С3Н8О начнет кипеть при Т4 = 90,8ºС (т. 4).
5. Состав первой капли конденсата (пара) при Т = 90,8 ºС  С3Н8О (т. 5).
С3Н8О (т. 5).
6. Смесь закончит кипение при Т = 95 ºС (т. 6).
7. Состав последней капли жидкости при Т = 95 ºС  С3Н8О (т. 7).
С3Н8О (т. 7).
8. Массу пара и жидкости при Т = 94 ºС можно определить по правилу рычага.
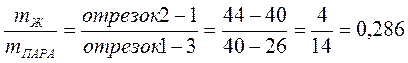
Обозначим mЖ = х
mПАРА=2 - х, т.к. общая масса смеси равна 2 кг
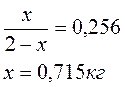
Масса жидкой фазы mЖ = 0,715 кг, состав (т. 2) 44 % С3Н8О и 56 % H2O.
Масса пара mПАРА = 2 - 0,715 = 1,285 кг, состав пара (т. 3) 26 % С3Н8О и 74 % H2O.
Задачи для самостоятельной работы
1. Чему равно давление насыщенного пара над 10%-ным водным раствором карбамида СО(NН2)2 при 100º С, если давление пара над чистым растворителем 101,09 кПа?
2. При 25º С давление насыщенного пара воды составляет 3,166 кПа. Найти при той же температуре давление насыщенного пара над водным раствором мочевины СО(NН2)2, если ω (СО(NН2)2) = 5%.
3. Каково давление пара 10%-ного водного раствора сахара С12H22O11 при 100ºС, если давление пара чистого растворителя 760 мм.рт.ст.?
4. Давление насыщенного пара над раствором с массовой долей Na2SO4, равно 10 %, при 40ºС равно 7,1 кПа, а давление насыщенного пара над водой при этой температуре равно 7,4 кПа. Рассчитайте степень электролитической диссоциации сульфата натрия в долях единицы.
5. При 100º С давление пара раствора, содержащего 0,05 моль сульфата натрия в 450 г воды, равно 100,8 кПа. Определить степень диссоциации Na2SO4, если давление пара над чистым растворителем 101,3 кПа?
6. Давление пара водного раствора с массовой долей NaNO3 8% равно 2,26 кПа при 20º С. Давление паров воды при этой температуре равно 2,34 кПа. Найдите кажущуюся степень диссоциации (в процентах) нитрата натрия в этом растворе.
7. Раствор 0,455 г тироксина в 10 г бензола замерзает при температуре 5,144º С, тогда как температура замерзания чистого бензола 5,444º С. Какова молекулярная масса тироксина, если криоскопическая постоянная бензола К(С6Н6) = 5,12.
8. Определите молекулярную массу вещества – неэлектролита, если при растворении 0,9 г его в 50 г воды получен раствор с температурой кипения 100,052º С. Эбуллиоскопическая постоянная воды равна 0,52.
9. Если 10 г глюкозы С6H12O6, растворить в 400 г этилового спирта, температура кипения спирта повышается на 0,1428º С. При растворении 2 г неизвестного органического вещества в 100 г этилового спирта температура кипения повышается на 0,125º С. Вычислите молярную массу неизвестного вещества.
10. Раствор, содержащий 5 г вещества в 100 г воды, кипит при 100,42º С. Найти молекулярную массу этого вещества, зная, что электрический ток раствор не проводит. Еводы = 0,52.
11. После растворения 0,412 г нафталина (С10Н8) в 10 г камфары температура замерзания раствора оказалась на 13º С ниже по сравнению с температурой замерзания чистой камфары. Чему равна криоскопическая константа для камфары, рассчитанная на основании этих данных?
12. Температура кипения раствора, содержащего 12 г гидроксида натрия в 100 г воды, равна 102,65º С. Рассчитайте степень электролитической диссоциации NaOH в этом растворе в процентах. Эбуллиоскопическая постоянная воды равна 0,52.
13. Многовариантная задача
Дана зависимость составов жидкой фазы и находящегося с ней в равновесии пара от температуры для двухкомпонентной жидкой системы А - В при постоянном давлении.
1. Построить диаграмму кипения А - В в координатах “Т - состав” и определить ее тип.
2. Определить точки, соответствующие равновесию фаз одинакового состава. Описать их качественный и количественный состав (точки А, Б, В).
3. Рассчитать число степеней свободы в точках А, Б, В и точке ХВ при Т1 (т. 1).
Для системы, содержащей ХВ, определить:
4. Температуру начала кипения системы (т. 4)
5. Состав первой капли конденсата (пара) над этой системой (т. 5).
6. Температуру конца кипения (т. 6).
7. Состав последней капли жидкой фазы (т. 7).
8. Массу пара и жидкой фазы при Т1, если масса всей системы равна 2 кг.
|
№ |
Система
Молярный состав В, %
Т, К
ХВ
Т1
Занятие № 8
План занятия
1. Проверка посещаемости и информация
2. Решение ситуационных задач
3. Подведение итогов занятия
Ситуационные задачи
Задача 11
По диаграмме плавкости системы фенилсалицилат (А) – фенол (В), которая построена в координатах температура – состав в массовых процентах, определить:
1. Что представляет собой система, состоящая из 40% фенола и 60% фенилсалицилата при 55°С. Какими степенями свободы она обладает?
2. Что произойдет с системой состава, указанного в пункте 1, если ее резко охладить до 25°С? Какими степенями свободы она будет обладать?
3. Какой состав должна иметь данная система при 20°С, чтобы ее можно было использовать как жидкую (однородную) лекарственную форму?

А В
Задача 12
По диаграмме плавкости системы парафин (А) – метилстеарат (В), определить:
1. При какой температуре начнется кристаллизация системы содержащей 80% метилстеарата и 20% парафина? Какое вещество начнет кристаллизоваться из этой системы?
2. При какой температуре закончится кристаллизация указанного в пункте 1 состава?
3. Какие фазы сосуществуют в системе, заданной точкой а, сколько степеней свободы у системы в этом состоянии?

А В
Задача 13
По диаграмме состояния в координатах температура кипения – состав системы этиловый спирт (А) тетрахлорид углерода (В), определить:
1. При какой температуре закипит жидкость, содержащая 80% спирта и 20% ССl4?
2. Пар какого состава образуется при кипении?
3. Как будет изменяться состав жидкой и паровой фаз при дальнейшем нагревании системы указанного в пункте 1 состава?
4. Каким будет состав жидкой и паровой фаз при ректификации этой смеси?

А В
Задача 14
По диаграмме плавкости системы камфора (А) – резорцин (В), которая построена в координатах температура-состав в массовых процентах, определить:
1. Что представляет собой система, имеющая состав 60% резорцина и 40% камфоры при 120°С, какими степенями свободы она обладает?
2. Какие изменения будут наблюдаться в системе указанного в пункте 1 состава при охлаждении до 15°С?
3. Какого состава данная система может применяться при 20°С, как жидкая (однородная) лекарственная форма?
4. Фазы какого состава сосуществуют в системе, состоящей из 60% резорцина и 40% камфоры, при 40°С, какими степенями свободы она обладает?

В
Задача 15
По диаграмме плавкости системы камфора (А) – тимол (В), которая построена в координатах температура – состав в массовых процентах, определить:
1. Что представляет собой система, состоящая из 20% тимола и 80% камфоры при 140°С и какими степенями свободы она обладает?
2. При какой температуре и какой компонент начнет кристаллизоваться при охлаждении системы с заданным в пункте 1 составом?
3. При какой температуре и из какого состава пойдет кристаллизация обоих компонентов, сколько степеней свободы у системы в таком состоянии?
4. Какие фазы с степени свободы у системы заданного в пункте 1 состава при 15°С?

В
Задача 16
По диаграмме в координатах температура кипения – состав системы вода (А) – азотная (В) определить:
1. При какой температуре закипит жидкость состава 40% HNO3 и 60% воды?
2. Каким компонентом будет обогащаться пар и как изменится температура кипения оставшейся жидкости?
3. Каким будет состав паровой и жидкой фаз при ректификации смеси заданного в пункте 1 состава?
4. Как называется состав содержащий 68% В и 32% А при 120°С, каким свойствами он обладает?
5. Фазы какого состава будут в равновесии, если смесь заданного в пункте I состава нагреть до 112°С?

В
Задача 17
По диаграмме состояния системы компонентов А и В определите:
1. К какому типу относится данная система?
2. Что представляет собой система 80% А и 20% В при температуре 30°С? Какими степенями свободы она обладает?
3. При какой температуре начинается кипение этой системы? Каким компонентом будет обогащаться пар, образующийся при ее кипении?
4. Как будет изменяться состав жидкой фазы при дальнейшем нагревании?

В
Диаграмма состояния системы, образованной из компонентов А и В, в координатах “температура кипения – состав”
Задача 18
По диаграмме состояния системы компонентов А и В определите:
1. При какой температуре начинается кипение этой системы состава 80% А и 20% В?
2. Каким компонентом будет обогащаться пар, образующийся при ее кипении?
3. На какие составляющие можно разделить исходную систему ректификацией?
4. Как называется смесь состава 70% А и 30% В. Какими свойствами она обладает?

Диаграмма состояния системы, образованной из компонентов А и В, в координатах “температура кипения – состав”
Задача 19
По диаграмме кипения системы С2Н5ОН – ССl4 (С2Н5ОН – «А»; ССl4 – «В») для системы, содержащей 20% ССl4 определите:
1. Температуру начала кипения
2. Температуру конца кипения
3. Состав первой капли конденсата
4. Состав последней капли жидкой фазы

Положительное отклонение
Задача 20
По диаграмме кипения системы С2Н5ОН – ССl4 (С2Н5ОН – «А»; ССl4 – «В») определите:
1. Тип бинарной системы
2. Точки, соответствующие равновесию фаз одинакового состава
3. Рассчитать число степеней свободы в этих точках
4. Рассчитать число степеней свободы в точке ХВ = 20 % ССl4 при Т1 = 343º С.

Положительное отклонение
Задача 21
По диаграмме состояния воды определить и дать пояснения:
1. Чему равно число степеней свободы для точки K, находящейся на линии ОА?
2. Чему равно число степеней свободы для точки Х, находящейся внутри области “тв”?
3. Если находясь в точке трехфазного состояния внешние условия системы изменить T↓, P = const. Что будет образовываться?
4. Исходя из графика определите, каким образом нужно изменить внешние условия, чтобы из точки трехфазного состояния системы перейти в область Ж.

Учебные элементы модуля
| рН для буферных систем кислотного типа | 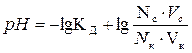 КД – константа диссоциации кислоты
Nc, Nк – нормальные концентрации соли и кислоты, взятых для приготовления буферного раствора
Vc, Vк – объемы в миллилитрах растворов соли и кислоты, взятых для приготовления буферного раствора
КД – константа диссоциации кислоты
Nc, Nк – нормальные концентрации соли и кислоты, взятых для приготовления буферного раствора
Vc, Vк – объемы в миллилитрах растворов соли и кислоты, взятых для приготовления буферного раствора
|
| рН для буферных систем основного типа | 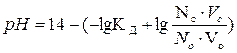 Кд – константа диссоциации основания
Nc, No – нормальные концентрации соли и основания, взятых для приготовления буферного раствора
Vc, Vo – объемы в миллилитрах растворов соли и основания, взятых для приготовления буферного раствора
Кд – константа диссоциации основания
Nc, No – нормальные концентрации соли и основания, взятых для приготовления буферного раствора
Vc, Vo – объемы в миллилитрах растворов соли и основания, взятых для приготовления буферного раствора
|
| Буферная емкость | 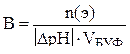 n(э) – число молей эквивалентов сильной кислоты или щелочи
n(э) = Nк·Vк (при титровании кислотой)
n(э) = Nо·Vо (при титровании основанием)
|∆ pH| - абсолютная величина изменения pH в результате добавления кислоты или щелочи
Vбуф – объем буферного раствора
n(э) – число молей эквивалентов сильной кислоты или щелочи
n(э) = Nк·Vк (при титровании кислотой)
n(э) = Nо·Vо (при титровании основанием)
|∆ pH| - абсолютная величина изменения pH в результате добавления кислоты или щелочи
Vбуф – объем буферного раствора
|
| Электродвижущая сила | ЭДС = Е+ – Е– Е+ – потенциалы положительного электродов E – – потенциалы отрицательного электродов |
| Электродный потенциал в нестандартных условиях (уравнение Нернста) | 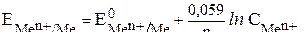
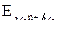 - электродный потенциал - электродный потенциал
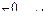 - стандартный электродный потенциал
n – заряд ионов металла
С – концентрация и o нов металла в растворе - стандартный электродный потенциал
n – заряд ионов металла
С – концентрация и o нов металла в растворе
|
| Электродвижущая сила для концентра-ционного гальванического элемента | 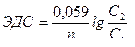 n – заряд ионов металла
С1 – концентрация анодного раствора
С2 – концентрация катодного раствора
n – заряд ионов металла
С1 – концентрация анодного раствора
С2 – концентрация катодного раствора
|
| Уравнение Нернста для водородного электрода | 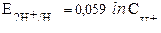 или или 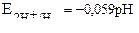 рН – водородный показатель
СН+ - концентрация протонов водорода
рН – водородный показатель
СН+ - концентрация протонов водорода
|
ЗАНЯТИЕ № 9
Буферные системы и растворы
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Что такое буферные системы, буферные растворы? Какие 3 вида буферных систем Вы знаете?
2. Дайте определение понятий “кислота” и “основание” с точки зрения протолитической теории. Какие кислота и основание называются сопряженными? Приведите пример
3. Механизм действия буферных систем:
Ø ацетатной,
Ø гидрокарбонатной,
Ø фосфатной,
Ø белковой,
Ø гемоглобиновой,
Ø оксигемоглобиновой,
Ø аммонийной
Уравнения реакций взаимодействия с сильной кислотой и сильной щелочью в ионном и молекулярном виде.
4. Формулы для расчета pH буферных систем кислотного и основного типов по уравнению Гандерсона-Гассельбаха. От каких факторов зависит рН буферных систем и почему он не зависит от разбавления раствора?
5. Что такое буферная емкость и чему она ровна количественно? Формула для расчета буферной емкости. От каких факторов и как именно зависит буферная емкость?
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 216 – 221 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 109 – 119 c.
Задача 1
Найти рН буферной смеси, состоящей из 100 мл 0,1 н раствора CH3COOH и 10 мл 0,1 н раствора CH3COONa. КД (CH3COOH) = =1,8•10-5; lg 1,8•10-5 = - 4,74.
Решение:
По уравнению Гандерсона-Гассельбаха для кислотного буфера находим:
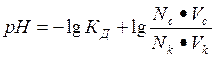
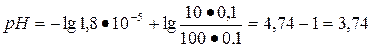
Ответ: pH = 3,74
Расчет буферной емкости.
Задача 2
Найти буферную емкость гидрокарбонатной буферной системы, если на титрование 15 мл ее потребовалось 12 мл 0,1 н раствора NaOH. Начальное значение рН = 5,2; конечное значение рН = 6,8.
Решение:
Используем формулу для расчета буферной емкости (при титровании щелочью)
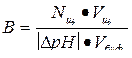
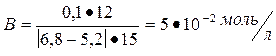
Ответ: В = 5•10-2 моль/л
Расчет рН растворов протолитов, полученных смешением растворов разных веществ
Задача 3
Вычислите рН раствора, полученного смешением равных объемов растворов с (НСl) = 0,015 моль/л и с (NaOH) = 0,03 моль/л
Решение:
Запишем уравнение реакции:
HCl + NaOH → NaCl + H2O
По условию задачи раствор кислоты прореагировал полностью. Следовательно, после протекания реакции нейтрализации среда полученного раствора будет щелочной. Определим концентрацию NaOH после завершения реакции.
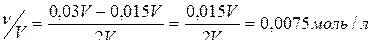
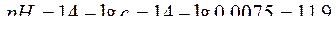
Ответ: рН = 11,9
Расчет объемов веществ для приготовления буферного раствора с заданными параметрами
Задача 4
Вычислите объемы растворов гидрофосфата натрия с концентрацией 0,1 моль/л и дигидрофосфата натрия с концентрацией 0,15 моль/л для приготовления буферного раствора объемом 1 л с рН = 7,0.
Решение:
Запишем протолитическое равновесие:
H2PO41- + H2O ↔ H3O+ + HPO42-
a1 b2 a2 b1
Найдем отношение концентраций солей в буферном растворе, который надо приготовить:
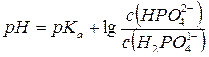
Где pKa (H2PO41-) = 7,21. Обозначим объем раствора гидрофосфата натрия через х (л), тогда объем раствора дигидрофосфата натрия (1-х) (л). Количества веществ этих солей в приготовленном растворе будут равны соответственно 0,1 х (моль) и 0,15 (1-х) (моль).
Поскольку эти количества веществ находятся в одном и том же объеме, отношение концентраций можно заменить отношением количеств веществ:
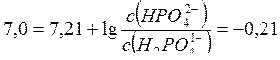
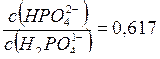
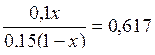
откуда х = 0,48 л, т.е. V(Na2HPO4) = 0,48 л; V(NaH2PO4) = 0,52 л.
Ответ: 480 мл раствора гидрофосфата натрия и 250 мл дигидрофосфата натрия.
Выявление буферных свойств раствора на основании анализа количеств веществ его компонентов.
Задача 5
Серия растворов приготовлена смешением двух растворов:
А) гидроксида натрия (с = 0,1 моль/л; V = 10 мл) и уксусной кислоты (с = 0,05 моль/л; V = 5 мл);
Б) гидроксида натрия (с = 0,05 моль/л; V = 5 мл) и уксусной кислоты (с = 0,1 моль/л; V = 10 мл);
В) ацетата натрия (с = 0,1 моль/л; V = 10 мл) и соляной кислоты (с = 0,05 моль/л; V = 5 мл);
Г) ацетата натрия (с = 0,1 моль/л; V = 10 мл) и уксусной кислоты (с = 0,01 моль/л; V = 5 мл);
Д) гидроксида натрия (с = 0,1 моль/л; V = 10 мл) и ацетата натрия (с = 0,01 моль/л; V = 5 мл);
Решение:
Только компоненты раствора Г) могут образовать буферную систему, т.е. протолитическую пару слабая кислота – сопряженное основание. В растворах А), Б), В) подобные пары могут образоваться в результате обменных реакций. Однако необходимо сделать расчет, так как в избытке может оказаться и слабый электролит (пара образуется), и сильный (пары не образуется). Раствор Д) не содержит компоненты, отвечающие данным условиям, и они не могут образоваться в результате реакции. Раствор Д) однозначно не обладает буферным действием.
Рассчитаем, какие компоненты останутся после протекания реакции в растворах А), Б), В). Для этого рассчитаем количества вступающих в реакции веществ ( в ммоль).
А) ν (NaOH) = 0,1 • 10 = 1 ммоль и ν (CH3COOH) = 0,05 • 5 = 0,25 ммоль.
Поскольку кислота прореагирует полностью, то по окончании реакции в растворе останутся NaOH и CH3COOH; протолитическая пара не образуется.
Б) ν (NaOH) = 0,05 • 5 = 0,25 ммоль и ν (CH3COOH) = 0,1 • 10 = 1 ммоль.
Поскольку щелочь прореагирует полностью, то по окончании реакции в растворе будут CH3COOH (1 – 0,25 = 0,75 ммоль) и CH3COONa (0,25 ммоль); протолитическая пара образуется.
В) ν (CH3COONa) = 0,1 • 10 = 1 ммоль и ν (HCl) = 0,05 • 5 = 0,25 ммоль.
Поскольку кислота прореагирует полностью, то по окончании реакции в растворе будут CH3COOH (0,25 ммоль) и CH3COONa (1 – 0,25 = 0,75 ммоль); протолитическая пара образуется.
Для окончательного ответа на вопрос надо выяснить, отвечает ли соотношение компонентов в растворах Б), В), Г) зоне буферного действия:
Б)
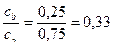
| В)
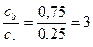
| Г)
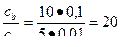
|
Соотношение компонентов отвечает зоне буферного действия только в растворах Б) и В).
Ответ: буферным действием обладают растворы Б) и В).
Задачи для самостоятельной работы
1. Найти рН буферной смеси, состоящей из 15 мл 0,1 н раствора CH3COOH и 100 мл 0,15 н раствора CH3COONa. КД (CH3COOH) = =1,8•10-5; lg 1,8•10-5 = - 4,74.
2. Найти рН буферной смеси, состоящей из 20 мл 0,1 н раствора NaH2PO4 и 10 мл 0,2 н раствора Na2HPO4. КД (H2PO4 -) = 6,3•10-8; lg6,3•10-8 = - 7,2.
3. Найти рН буферной смеси, состоящей из 30 мл 0,1 н раствора муравьиной кислоты HCOOH и 100 мл 0,3 н раствора формиата натрия HCOONa. КД (HCOOH) = =1,8•10-4; lg 1,8•10-4 = - 3,74.
4. Найти рН буферной смеси, состоящей из 60 мл 0,1 н раствора слабого основания MeOH и 3 мл 0,2 н раствора MeCl. КД (MeOH) = 1,6•10-5; lg1,6•10-5 = - 4,8.
5. Найти рН буферной смеси, состоящей из 15 мл 0,1 н раствора NH4OH и 10 мл 0,15 н раствора NH4Cl. КД(NH4OH) = 1,76•10-5; lg 1,76•10-5= -4,75.
6. Найти рН буферной смеси, состоящей из 40 мл 0,1 н раствора NH4OH и 100 мл 0,4 н раствора NH4Cl. КД(NH4OH) = 1,75•10-5; lg 1,75•10-5= -4,76.
7. Найти рН буферной смеси, состоящей из 100 мл 0,15 н раствора NH4OH и 150 мл 0,1 н раствора NH4Cl. КД(NH4OH) = 1,76•10-5; lg1,76•10-5= -4,75.
8. К 100 мл крови для изменения pH от 7,36 до 7,0 надо добавить 36 мл 0,05 н раствора HCl. Рассчитайте буферную емкость крови в моль/л.
9. Найти буферную емкость фосфатной буферной системы, если на титрование 25 мл ее потребовалось 20 мл 0,1 н раствора NaOH. Изменение рН = 4.
10. Найти буферную емкость ацетатной буферной системы, если на титрование 30 мл ее потребовалось 12 мл 0,1 н раствора КOH. Начальное значение рН = 4,7; конечное значение рН = 6,3.
11. Найти буферную емкость аммонийной буферной системы, если на титрование 10 мл ее потребовалось 8 мл 0,1 н раствора HCl. рН изменился от 10 до 8.
12. К 50 мл крови для изменения рН от 7,36 до 7,0 надо добавить 18 мл 0,05 н раствора HCl. Рассчитайте буферную емкость крови в моль/л.
13. Найти буферную емкость белковой буферной системы, если на титрование 20 мл ее потребовалось 1,2 мл 0,1 н раствора HCl. Изменение рН = 2.
14. Вычислите рН раствора, полученного смешением равных объемов уксусной кислоты С = 0,15 моль/л и гидроксида натрия С = 0,2 моль/л.
15. Вычислите рН раствора, полученного смешением равных объемов азотной кислоты С = 0,25 моль/л и аммиака С = 0,2 моль/л.
16. Вычислите рН раствора, полученного смешением 5 мл раствора дигидрофосфата натрия с концентрацией 0,2 моль/л и 10 мл раствора гидроксида натрия с концентрацией 0,2 моль/л.
17. Вычислите рН раствора, полученного смешением 5 мл раствора гидрофосфата натрия с концентрацией 0,2 моль/л и 10 мл раствора соляной кислоты с концентрацией 0,02 моль/л.
Задания в тестовой форме
«БУФЕРНЫЕ СИСТЕМЫ И РАСТВОРЫ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Какой из параметров буферной системы остается постоянным при разбавлении ее водой, добавлении сильной кислоты и щелочи
A. температура кипения
B. осмотическое давление
C. рН
D. объем раствора
2. Что из перечисленного не относится к примерам буферных систем
A. морская вода
B. 0,1 н раствор кислоты
C. клеточный сок
D. кровь, слюна, моча
3. Какая из теорий используется для рассмотрения вопроса о буферных системах
A. протолитическая
B. активации
C. электронная
D. диссоциации
4. Сопряженные кислоты и основания связаны соотношением:
A. основание + протон ↔ кислота
B. кислота + протон ↔ основание
C. соль + протон ↔ кислота
D. основание - протон ↔ кислота
5. В соответствии с протолитической теорией кислот и оснований
A. кислота – донор протонов
B. кислота – акцептор протонов
C. основание – донор протонов
D. основание – акцептор протонов
6. Какой вид буферной системы не существует
A. кислотные
B. нейтральные
C. основные
D. амфолитные
7. Какая из буферных систем не относится к кислотным б.с.
A. фосфатная
B. аммонийная
C. гемоглобиновая
D. ацетатная
8. Из перечисленных буферных систем выберите амфолитную б.с.
A. оксигемоглобиновая
B. белковая
C. гемоглобиновая
D. гидрокарбонатная
9. К какому типу буферных систем относится фосфатная б.с. NaH2PO4/Na2HPO4
A. кислотные
B. основные
C. амфолитные
D. не относится к б.с.
10. Что показывает механизм буферного действия
A. характеристику реакций, протекающих в буферном растворе при добавлении сильной кислоты или щелочи
B. характеристику реакций, протекающих в буферном растворе при разбавлении водой
C. почему не меняется рН
D. почему не меняется осмотическое давление
11. Какие из приведенных уравнений описывают механизм действия фосфатной буферной системы при добавлении сильного основания
A. H3PO4 + 3 NaOH ↔ Na3PO4 + 3 H2O
B. NaH2PO4 + NaOH ↔ Na2HPO4 + H2O
C. Na2HPO4 + HCl ↔ NaH2PO4 + NaCl
D. Na2HPO4 + 2 HCl ↔ H3PO4 + 2 NaCl
12. Какое из приведенных уравнений описывает механизм действия гемоглобиновой буферной системы при добавлении сильной кислоты
A. Hb- + H+ ↔ HHb
B. НHb + H+ ↔ Hb+ + Н2
C. Hb+ + OH- ↔ HHbО
D. HbO2- + H+ ↔ HHbO2
13. С помощью какого уравнения рассчитывается рН любой буферной системы
A. Бренстеда и Лоури
B. Клапейрона
C. Гандерсона –Гассельбаха
D. Гиббса
14. Как записывается уравнение для расчета рН кислотных буферов
A. 
B. 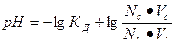
C. 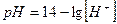
D. 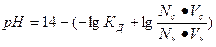
15. Как записывается уравнение для расчета рН основных буферов
A. 
B. 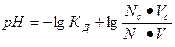
C. 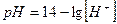
D. 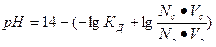
16. От чего не зависит рН буферной системы
A. от разбавления
B. от величины константы диссоциации кислоты
C. от величины соотношения концентраций компонентов буфера
D. от величины константы диссоциации основания
17. По какой из приведенных формул рассчитывают буферную емкость при титровании буфера кислотой
A. 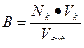
B. 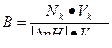
C. 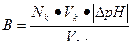
D. 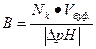
18. По какой из приведенных формул рассчитывают буферную емкость при титровании буфера щелочью
A. 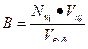
B. 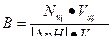
C. 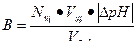
D. 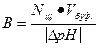
19. От каких из перечисленных факторов не зависит величина буферной емкости
A. исходной концентрации компонентов буфера
B. разбавления
C. от соотношения концентраций компонентов буфера
D. от давления
20. С позиции кислот и оснований и их протолитического взаимодействия в организме поддерживается
A. тургор
B. онкотическое давление
C. гомеостаз
D. температура тела
ЗАНЯТИЕ № 10
Буферные системы и растворы
План занятия
1. Проверка посещаемости и информация
2. Решение ситуационных задач
3. Лабораторная работа № 2
4. Подведение итогов занятия
Ситуационные задачи
Задача 22
К раствору, содержащему ацетат натрия, массой 16,4 г добавили 50 мл соляной кислоты с концентрацией хлороводорода 1 моль/л. Объем полученного раствора довели дистиллированной водой до 1 л. Вычислите рН конечного раствора.
Задача 23
К раствору, содержащему хлорид аммония, массой 5,35 г добавили 40 мл раствора гидроксида натрия с концентрацией 0,5 моль/л. Объем полученного раствора довели дистиллированной водой до 0,5 л. Вычислите рН конечного раствора.
Задача 24
В пяти колбах содержалось по 10 мл раствора уксусной кислоты с концентрацией 0,1 моль/л. В каждую из этих колб был добавлен раствор гидроксида калия с концентрацией 0,05 моль/л в разных объемах: а) 1 мл; б) 10 мл; в) 15 мл; г) 20 мл; д) 25 мл. Какие из образовавшихся растворов обладают буферным действием? Ответ подтвердите расчетами.
Задача 25
В пяти колбах содержалось по 20 мл раствора аммиака с концентрацией 0,05 моль/л. В каждую из этих колб добавлена соляная кислота с концентрацией 0,1 моль/л в разных объемах: а) 0,5 мл; б) 5 мл; в) 7,5 мл; г) 10 мл; д) 15 мл. Какие из образовавшихся растворов обладают буферным действием? Ответ подтвердите расчетами.
Задача 26
Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом:
| раствор NH3 А) с = 0,1 моль/л, V = 10 мл Б) с = 0,01 моль/л, V = 10 мл | раствор NH4Cl с = 0,05 моль/л, V = 20 мл с = 0,1 моль/л, V = 20 мл |
| раствор NH3 В) с = 0,1 моль/л, V = 10 мл Г) с = 0,05 моль/л, V = 15 мл | раствор HCl с = 0,05 моль/л, V = 15 мл с = 0,1 моль/л, V = 10 мл |
Задача 27
Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом:
| раствор HCOONa А) с = 0,1 моль/л, V = 10 мл раствор HCOONa Б) с = 0,1 моль/л, V = 10 мл | раствор HCl с = 0,05 моль/л, V = 5 мл раствор HCOOH с = 0,01 моль/л, V = 5 мл |
| раствор NaOH В) с = 0,1 моль/л, V = 10 мл Г) с = 0,05 моль/л, V = 5 мл | раствор HCOOH с = 0,05 моль/л, V = 5 мл с = 0,1 моль/л, V = 10 мл |
Задача 28
Какие из перечисленных растворов обладают буферным действием? Ответ подтвердите расчетом:
| раствор NaOH А) с = 0,1 моль/л, V = 10 мл раствор CH3COONa Б) с = 0,1 моль/л, V = 10 мл | раствор CH3COOH с = 0,05 моль/л, V = 20 мл раствор CH3COOH с = 0,05 моль/л, V = 5 мл |
| раствор NaOH В) с = 0,05 моль/л, V = 5 мл раствор CH3COONa Г) с = 0,1 моль/л, V = 10 мл | раствор CH3COOH с = 0,1 моль/л, V = 10 мл раствор HCl с = 0,01 моль/л, V = 5 мл |
Задача 29
В двух пробирках находится раствор ацетатного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора NaOH, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 30
В двух пробирках находится раствор ацетатного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора НСl, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 31
В двух пробирках находится раствор гидрокарбонатного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора NaOH, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 32
В двух пробирках находится раствор гидрокарбонатного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора НСl, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 33
В двух пробирках находится раствор фосфатного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора NaOH, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 34
В двух пробирках находится раствор фосфатного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора НСl, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 35
В двух пробирках находится раствор аммонийного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора NaOH, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 36.
В двух пробирках находится раствор аммонийного буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора НС1, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 37
В двух пробирках находится раствор белкового буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора NaOH, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 38
В двух пробирках находится раствор белкового буфера с одним и тем же значением рН. В одну пробирку добавили 5 капель 0,1 н раствора НСl, а в другую 5 капель дистиллированной воды. В каждую пробирку добавили по 4 капли кислотно - основного индикатора.
Вопрос: Каков цвет растворов в пробирках? Ответ обоснуйте.
Задача 39
Для определения буферной емкости проба буферного раствора оттитрована 0,1 н раствором NaOH. Затем такую же пробу буферного раствора разбавили в 2 раза дистиллированной водой.
Вопрос: Изменятся ли результаты титрования и величина буферной емкости? Ответ обоснуйте.
Задача 40
Для определения буферной емкости проба буферного раствора оттитрована 0,1 н раствором NaOH. Затем такую же пробу буферного раствора разбавили в 3 раза дистиллированной водой.
Вопрос: Изменятся ли результаты титрования и величина буферной емкости? Ответ обоснуйте.
Задача 41
Для определения буферной емкости проба буферного раствора оттитрована 0,1 н раствором NaOH. Затем такую же пробу буферного раствора разбавили в 4 раза дистиллированной водой.
Вопрос: Изменятся ли результаты титрования и величина буферной емкости? Ответ обоснуйте.
Задача 42
Для определения буферной емкости проба буферного раствора оттитрована 0,1 н раствором NaOH. Затем такую же пробу буферного раствора разбавили в 5 раза дистиллированной водой.
Вопрос: Изменятся ли результаты титрования и величина буферной емкости? Ответ обоснуйте.
ЗАНЯТИЕ № 11
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение ситуационных задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Понятие об ионной атмосфере.
2. Активность ионов и ее связь с концентрацией.
3. Коэффициент активности и зависимость его величины от общей концентрации электролитов в растворе.
4. Ионная сила раствора. Расчет ионной силы раствора.
5. Зависимость коэффициента активности от ионной силы раствора (предельный закон Дебая и Хюккеля).
6. Электрохимия (определение). Проводники I и II рода. Формула для расчета сопротивления проводника I рода.
7. Кондуктометрическая ячейка. Удельная электрическая проводимость. Определение, обозначение, формула для расчета по известному сопротивлению раствора.
8. Молярная электрическая проводимость. Определение, обозначение. Формула для расчета по известной величине удельной электропроводимости.
9. Влияние разбавления на молярную электрическую проводимость растворов сильных и слабых электролитов. График и пояснение.
10. Движение катионов и анионов в электрическом поле при больших разведениях. Закон Кольрауша (формулировка и математическое выражение). Какую величину как именно можно рассчитывать, пользуясь законом Кольрауша?
11. Особенности подвижности ионов Н+ и ОН-.
12. Кондуктометрия. Кондуктометрическое определение степени и константы диссоциации слабого электролита. Формулы, на которых основано определение. Применение метода.
13. Кондуктометрическое титрование сильной и слабой кислот, а также их смеси со щелочью. Графики, пояснения и применение в медико-биологнческих исследованиях.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 221 – 226, 283 – 301 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 83 – 89 c.
Ситуационные задачи
Задача 43
Рассчитайте ионную силу плазмозамещающего раствора «Тририсоль», который готовят по прописи:
Натрия хлорид 0,5 г
Калия хлорид 0,1 г
Натрия гидрокарбонат 0,4 г
Вода для инъекций до 100 мл
Задача 44
Рассчитайте ионную силу плазмозамещающего раствора «Ацесоль», который готовят по прописи:
Натрия ацетат 0,2 г
Натрия хлорид 0,5 г
Калия хлорид 0,1 г
Вода для инъекций до 100 мл
Задача 45
Рассчитайте ионную силу плазмозамещающего раствора «Хлосоль», который готовят по прописи:
Натрия ацетат 0,36 г
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Вода для инъекций до 100 мл
Задача 46
Рассчитайте ионную силу плазмозамещающего раствора «Квартасоль», который готовят по прописи:
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Натрия ацетат 0,26 г
Натрия гидрокарбонат 0,1 г
Вода для инъекций до 100 мл
Задача 47
Рассчитайте ионную силу плазмозамещающего раствора «Лактасоль», который готовят по прописи:
Натрия хлорид 0,62 г
Калия хлорид 0,03 г
Кальция хлорид безводный 0,016 г
Магния хлорид безводный 0,01 г
Натрия лактат 0,336 г
Вода для инъекций до 100 мл
Задача 48
Рассчитайте активность хлорид-ионов (см. Приложение 2) в кровезаменителе «Гемодез» следующего состава:
Поливинилпирролидон низкомолекулярный 6,0 г
Натрия хлорид 0,55 г
Калия хлорид 0,042 г
Кальция хлорид 0,05 г
Магния хлорид 0,0005 г
Натрия гидрокарбонат 0,023 г
Вода для инъекций до 100 мл
Задача 49
Рассчитайте активность иона калия (см. Приложение 2) в плазмозамещающем растворе следующего состава:
Глюкоза безводная 10,0 г
Натрия хлорид 0,5 г
Калия хлорид 0,3 г
Магния сульфат 0,05 г
Кислота глутаминовая 0,1 г
Вода для инъекций до 100 мл
Задача 50
Водные растворы сульфата цинка с массовой долей 0,1%; 0,25% и 0,5% применяются в качестве глазных капель как антисептическое и вяжущее. Рассчитайте активность иона цинка (см. Приложение 2) в таких растворах. Плотность каждого раствора условно принять равной 1 г/мл.
Задача 51
Водный раствор сульфата меди с массовой долей 1% назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе (плотность раствора 1,009 г/мл).
Задача 52
При отравлениях цианидами внутривенно вводят 2%-ный водный раствор нитрата натрия с плотностью 1,011 г/мл. Вычислите активности ионов в этом растворе (см. Приложение 2).
Задания в тестовой форме
«ТЕОРИЯ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ ДЕБАЯ И ХЮККЕЛЯ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Активность электролита Х определяется по формуле:
A. 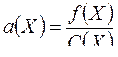
B. 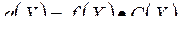
C. 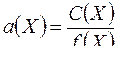
D. 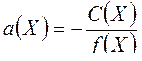
2. Отклонение раствора с концентрацией С(Х) от поведения раствора при бесконечном разведении выражаем:
A. активность а
B. ионная сила раствора I
C. коэффициент активности f
D. степень диссоциации α
3. Если f(X) = 1, то
A. а(Х) = С(Х)
B. а(Х) > С(Х)
C. а(Х) < С(Х)
D. а(Х) << С(Х)
4. Мерой общего содержания катионов и анионов является:
A. ионная сила раствора
B. активность электролита
C. концентрация электролита
D. коэффициент активности
5. Значение ионной силы раствора электролита рассчитывают по формуле:
A. 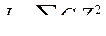
B. 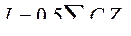
C. 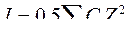
D. 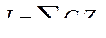
6. Значение I для фосфатного буфера при условии, что С(NaH2PO4) = 0,1 М, С(Na2HPO4) = 0,005 М равно? Ответ подтвердить расчетом.
A. 1,15
B. 0,115
C. 0,2
D. 11,5
7. Значение I для 0,02 н раствора K3PO4 равно? Ответ подтвердить расчетом.
A. 0,12
B. 1,2
C. 0,24
D. 2,4
8. Значение I для 0,01 М раствора алюминиевых квасцов K2SO4•Al2(SO4)3•2H2O равно? Ответ подтвердить расчетом.
A. 1,8
B. 0,18
C. 0,018
D. 18
9. Значения I для ацетатного буфера при условии, что С(CH3COONa) = 0,1 М, С(CH3COOH) = 0,05 М равно? Ответ подтвердить расчетом.
A. 0,2
B. 0,1
C. 0,05
D. 0,15
10. Значение I для фосфатного буфера при условии, что С(NaH2PO4) = 0,1 М, С(Na2HPO4) = 0,05 М равно? Ответ подтвердить расчетом.
A. 0,25
B. 2,5
C. 0,5
D. 25
11. Значение I для раствора 0,1 М Al2(SO4)3 равно? Ответ подтвердить расчетом.
A. 3
B. 1,5
C. 15
D. 0,3
12. Эффект уменьшения числа ионов сильных электролитов участвующих в химических реакциях объясняется в теории Дебая и Хюккеля
A. электростатическим межионным взаимодействием в растворах
B. сольватацией ионов
C. гидратацией ионов
D. десольватацией ионов
ЗАНЯТИЕ № 12 - 13
Электрохимия
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Решение ситуационных задач
5. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Возникновение электродного потенциала металлического электрода.
2. Факторы, влияющие на величину электродного потенциала. Уравнение Нернста (для 298 К и др. температур).
3. Устройство и принцип действия стандартного водородного электрода. Ряд стандартных электродных потенциалов.
4. Правила записи схем гальванических элементов. Устройство, схема и принцип действия медно-цинкового гальванического элемента. ЭДС гальванического элемента.
5. Концентрационный гальванический элемент. ЭДС концентрационного гальванического элемента.
6. Окислительно-востановительные потенциалы. Уравнение Петерса.
7. Диффузионный потенциал.
8. Потенциометрия, ее применение в лабораторной и клинической практике. Классификация электродов, применяемых в потенциометрии. Стеклянный и хлорсеребряный электроды.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 231 – 266 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 156 – 187 c.
Задача 1
Составьте схему серебряно-кадмиевого гальванического элемента и рассчитайте его ЭДС, если серебряный электрод опущен в раствор его соли с концентрацией ионов Ag+ 0,1 моль/л, а кадмиевый электрод – в раствор его соли с концентрацией ионов Cd2+ 0,001 моль/л при 25°С.
Решение:
(-) Cd │Cd2+ ║Ag+ │Ag (+)
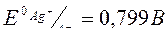 ;
; 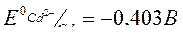 (см. Приложение 3)
(см. Приложение 3)
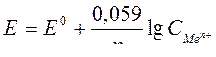
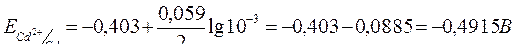
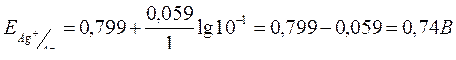
ЭДС = E+ - E- = 0,74 – (-0,4915) = 1,23 B
Ответ: ЭДС = 1,23 B
Задача 2
Рассчитайте величину электродного потенциала водородного электрода, погруженного в раствор с рН, равным 3.
Решение:
E = - 0,059*pH
E = - 0,059*3 = - 0,177 B
или
[H+] = 10-рН = 10-3 моль/л
E = 0,059*lg[H+]
E = 0,059*lg10-3 = - 0,177 B
Ответ: E = - 0,177 B
Задачи для самостоятельной работы
1. Какой металл служит анодом, а какой катодом в:
а) медно - цинковом гальваническом элементе;
б) медно - никелевом гальваническом элементе;
в) медно - кобальтовом гальваническом элементе;
г) олово - цинковом гальваническом элементе;
д) серебряно - цинковом гальваническом элементе;
е) серебряно - кадмиевом гальваническом элементе;
ж) хромо - никелевом гальваническом элементе;
з) золото - никелевом гальваническом элементе?
2. Составьте схему:
а) олово - цинкового гальванического элемента;
б) железо - цинкового гальванического элемента;
в) медно - хромового гальванического элемента;
г) хромо - марганцевого гальванического элемента;
д) кобальт - марганцевого гальванического элемента;
е) кадмий - марганцевого гальванического элемента;
ж) олово - кадмиевого гальванического элемента?
3. Какие металлы следовало бы выбрать для изготовления гальванического элемента с максимальным значением ЭДС?
4. Из четырех металлов: Ag, Cu, Al и Sn выберите пару, которая обеспечит наибольшую ЭДС составленного из них гальванического элемента.
5. Возможно ли изготовить гальванический элемент с серебряными катодом и анодом? Ответ кратко аргументировать.
6. Возможно ли изготовление гальванического элемента, в котором и катодом, и анодом служила бы медь? Ответ кратко аргументировать.
7. Рассчитайте величину электродного потенциала водородного электрода, опущенного в раствор кислоты с рН = 1 (t = 25°C).
8. Каково значение 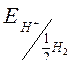 для водородного электрода, погруженного в раствор кислоты с рН = 2 (t = 25°C)?
для водородного электрода, погруженного в раствор кислоты с рН = 2 (t = 25°C)?
9. Рассчитайте значение 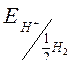 для водородного электрода, погруженного в раствор кислоты с рН = 3 (t = 25°C).
для водородного электрода, погруженного в раствор кислоты с рН = 3 (t = 25°C).
10. Принимая стандартный электродный потенциал водородного электрода равным нулю, рассчитайте значение потенциала водородного электрода, погруженного в чистую воду (t = 25°C).
11. Вычислите ЭДС медно-цинкового гальванического элемента, если концентрации растворов ZnSO4 и CuSO4 равны, соответственно, 0,01 и 1 моль/л (t = 25°C).
12. Вычислите ЭДС медно-цинкового гальванического элемента, если концентрации растворов ZnSO4 и CuSO4 равны, соответственно, 1 и 0,001 моль/л (t = 25°C).
13. Рассчитайте ЭДС медно-цинкового гальванического элемента, если концентрации растворов ZnSO4 и CuSO4 равны соответственно 0,001 и 1 моль/л (t = 25°C).
14. Рассчитайте ЭДС гальванического элемента, образованного цинковым электродом, опущенным в 0,1 M раствор нитрата цинка (II), и свинцовым электродом, опущенным в 2 М раствор нитрата свинца (II) (t = 25°C).
15. Рассчитайте ЭДС гальванического элемента, состоящего из серебряного и цинкового электродов, погруженных в растворы собственных солей; (t=25°C).
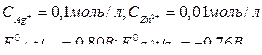
16. Рассчитайте ЭДС (в В при 25°С) концентрационного гальванического элемента, состоящего из серебряных электродов, опущенных в растворы AgNO3 с концентрациями: C1(Ag+) = 0,1 моль/л и C2(Ag+) = 0,01 моль/л; 
17. Электродный потенциал водородного электрода, опущенного в желудочный сок с неизвестной концентрацией водородных ионов, равен - 0,059 В. Рассчитайте рН и Сн+ желудочного сока в моль/л; t=25°C.
18. Потенциал водородного электрода, опущенного в слюну, оказался равным - 0,295 В. Рассчитайте рН слюны и определите, отвечает ли он норме (в норме рН слюны 6,35 - 6,85). t=25°C.
19. Потенциал водородного электрода, опущенного в слюну, оказался равным - 0,3835 В. Рассчитайте рН слюны и определите, отвечает ли он норме (в норме рН слюны 6,35 - 6,85). t=25°C.
20. Потенциал водородного электрода, опущенного в сок поджелудочной железы, оказался равным – 0,472 В. Рассчитайте рН сока поджелудочной железы и определите, отвечает ли он норме (в норме рН этой биожидкости 7,5 - 8,0), t=25°C.
21. Потенциал водородного электрода, опущенного в раствор желчи (из пузыря) оказался равным - 0,354 В при 25°С. Рассчитайте рН желчи.
Задания в тестовой форме
«ЭЛЕКТРОХИМИЯ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Какое свойство электролитов обеспечивает способность их растворов и расплавов проводить электрический ток?
A. низкая температура плавления
B. низкая температура кипения
C. способность диссоциировать на ионы
D. наличие свободных ионов
2. Что представляет собой носители зарядов в проводниках 2 рода?
A. свободные радикалы
B. свободные электроны
C. ионы
D. β-частицы
3. По какой из приведенных формул можно рассчитать удельную электрическую проводимость раствора, если известно сопротивление раствора?
A. 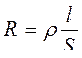
B. 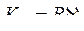
C. 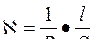
4. Что такое электропроводность растворов?
A. способность диссоциировать как ионы
B. способность проводить электрический ток
C. способность к электролизу
D. ни один из ответов не верен
5. Какую практическую задачу из указанных не возможно решать путем измерения электропроводности растворов?
A. идентификация веществ
B. титрование мутных растворов
C. определение степени диссоциации
D. определение константы диссоциации
6. Какие из перечисленных веществ при добавлении к воде будут значительно увеличивать электропроводность?
A. хлорид натрия
B. глюкоза
C. уксусная кислота
D. стеариновая кислота
7. Какие из перечисленных веществ при добавлении к воде будут увеличивать электропроводность?
A. нитрат калия
B. сахароза
C. мочевина
D. глюкоза
8. При добавлении каких перечисленных веществ к 0,1 н раствору CH3COOH электропроводность будет возрастать?
A. NaOH
B. HCN
C. CO2
D. BaSO4
9. Как изменится электропроводность 20 мл 0,1 н раствора соляной кислоты при добавлении 20 мл 0,1 н раствора гидроксида натрия?
A. сильно увеличится
B. сильно уменьшится
C. немного увеличится
D. немного уменьшится
10. Как изменится электропроводность 0,1 н раствора уксусной кислоты при добавлении к нему 0,2 моль/л CH3COONa?
A. не изменится
B. уменьшится
C. увеличится
D. в начале увеличится, а затем уменьшится
11. Как изменится электропроводность 20 мл 0,1 н раствора соляной кислоты при добавлении 20 мл 0,1 н раствора NaOH
A. увеличится
B. уменьшится
C. не изменится
D. в начале увеличится, а затем уменьшится
12. Что характеризует величина электропроводности растворов
A. силу взаимодействия ионов в растворе
B. способность проводить электрический ток
C. число Фарадея
D. число ионов в растворе
13. Какой из перечисленных факторов влияет на электропроводность растворов?
A. давление
B. концентрация ионов
C. скорость движения электронов
D. температура
14. Какие из перечисленных величин нужно знать для определения удельной электрической проводимости растворов?
A. удельное сопротивление
B. осмотическое давление
C. температура
D. подвижность ионов
15. По какой из написанных формул определяют разбавление раствора?
A. 
B. 
C. 
D. 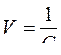
16. В каких единицах выражена СЭ в уравнении 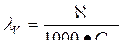
A. %
B. моль/экв.л
C. г/мл
D. моль/кг
17. По каким из приведенных формул можно рассчитать молярную электрическую проводимость раствора, если известна удельная электрическая проводимость?
A. 
B. 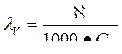
C. 
D. 
18. Какие из перечисленных величин нужно знать для определения предельной молярной электрической проводимости?
A. температура
B. давление
C. молярная концентрация
D. молярная подвижность ионов
19. Каково соотношение между величинами молярной электрической проводимости растворов: 0,1 н р-р NH4OH и 0,1 н р-р NH4Cl
A. 
B. 
C. 
D. 
20. Как графически изображается зависимость молярной электрической проводимости от разбавления для сильных электролитов?


A. λ B. λ
V V

 C. λ D. λ
C. λ D. λ
V V
21. Какая из приведенных формул выражает математический закон Кольрауша?
A. 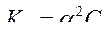
B. 
C. 
D. 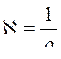
22. Какие из ионов H+ или NH4+ имеют большую молярную подвижность в водных растворах и почему?
A. ионы H+ как самые маленькие по размерам
B. ионы NH4+ за счет наличия донорно-акцепторной связи
C. ионы NH4+ за счет большой полярности
D. ионы H+ за счет “эстафетной” передачи протона между молекулами воды
23. Какие ионы обладают наибольшей подвижностью в водных растворах и почему?
A. многозарядные ионы, способные переносить большое количество электричества
B. ионы H+ и OH- как самые маленькие по размерам
C. ионы H+ и OH- за счет “эстафетной” передачи протона между молекулами воды
D. ионы H+ и OH- вследствие малой сольватации
24. Какой из ионов OH- или Cl- будет обладать большой подвижностью в водных растворах и почему?
A. ионы Cl-, из-за высокой электроотрицательности хлора
B. ионы OH- за счет эстафетной передачи протонов между молекулами воды
C. ионы OH- за счет малой сольватации
D. ионы хлора за счет большей поляризуемости
25. Какая из написанных формул формула Аррениуса?
A. 
B. 
C. 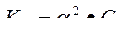
D. 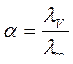
26. Какая из приведенных формул выражает математически закон разведения Оствальда?
A. 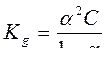
B. 
C. 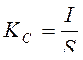
D. 
27. Какая из перечисленных величин не нужна для определения степени диссоциации слабого электролита?
A. температура
B. сопротивление раствора
C. молярные подвижности анионов
D. молярные подвижности катионов
28. Какая из формул выражает константу диссоциации угольной кислоты H2CO3 через степень диссоциации α и молярную концентрацию С?
A. 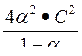
B. 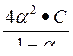
C. 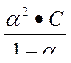
D. 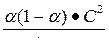
29. Какие из перечисленных величин нужно знать для определения константы диссоциации слабого электролита?
A. сопротивление раствора
B. вещество, из которого изготовлены электроды
C. молярные подвижности ионов
D. объем сосуда, в котором производят измерения
30. Цинковая пластинка, погруженная в раствор собственной соли, заряжается…
A. отрицательно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
B. отрицательно, т.к. энергия гидратации меньше, чем энергия кристаллической решетки
C. положительно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
D. положительно, т.к энергия гидратации меньше, чем энергия кристаллической решетки
31. Медная пластинка, погруженная в раствор собственной соли, заряжается…
A. отрицательно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
B. отрицательно, т.к. энергия гидратации меньше, чем энергия кристаллической решетки
C. положительно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
D. положительно, т.к энергия гидратации меньше, чем энергия кристаллической решетки
32. Электродный потенциал возникает на границе раздела металл – раствор его соли и обозначается…
A. Me | Men+
B. EMe|Men+
C. EMen+|Me
D. Men+ | Me
33. Условное обозначение водородного электрода…
A. Pt(H2) | 2H+
B. Cu(CuSO4) | 2H+
C. Zn(ZnSO4) | 2H+
D. Zn(ZnSO4) | HCl
34. У металлов, стоящих до водорода, стандартный электродные потенциалы…
A. положительные
B. отрицательные
C. равные нулю
35. Электродный потенциал при 298 К (25ºС) рассчитывается по уравнению Нернста:
A. 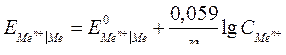
B. 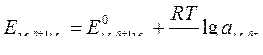
C. 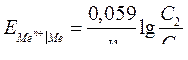
D. 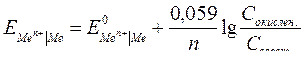
36. Уравнение Нернста для водородного электрода, находящегося в нестандартных условиях СН+ ≠ 1 моль/л при 298 К…
A. 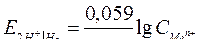
B. 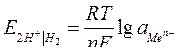
C. 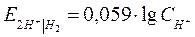
D. 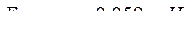
37. В гальваническом элементе анод…
A. заряжен положительно, на нем идет процесс окисления, т.е. отдачи электронов
B. заряжен отрицательно, на нем идет процесс окисления, т.е. отдачи электронов
C. заряжен положительно, на нем идет процесс восстановления, т.е. присоединения электронов
D. заряжен отрицательно, на нем идет процесс восстановления, т.е. присоединения электронов
38. При условном обозначении гальванических цепей записывают…
A. анод слева, катод справа
B. катод слева, анод справа
С. электрод, заряженный отрицательно, слева
D. электрод, заряженный положительно, слева
39. Электродвижущая сила гальванического элемента рассчитывается по формуле…
A. 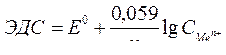
B. 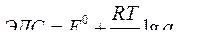
С. 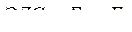
D. 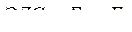
40. Уравнение Нернста для электрода I рода при 25ºС…
A. 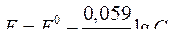
B. 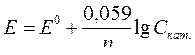
C. 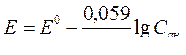
D. 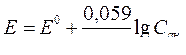
41. Уравнение Нернста для электрода II рода при 25ºС…
A. 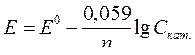
B. 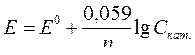
C. 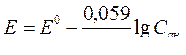
D. 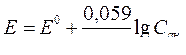
42. Потенциал окислительно-восстановительного электрода при 298 К рассчитывают по уравнению Петерса…
A. 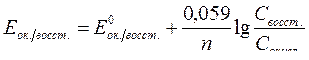
B. 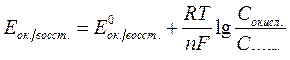
C. 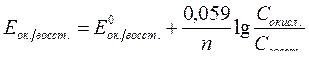
D. 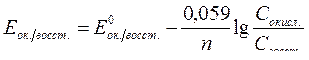
43. В элементе Якоби-Даниэля…
A. на цинковом электроде ионы цинка переходят в раствор
B. на цинковом электроде протекает реакция восстановления
C. на медном электроде осаждаются ионы меди из раствора
D. на медном электроде идет реакция окисления
44. Элемент Якоби-Даниэля схематично можно представить так:
A. (+) Cu | CuSO4 || ZnSO4 | Zn (-)
B. (+) Cu | Cu2+ || Zn2+ | Zn (-)
C. (-) Zn | ZnSO4 || CuSO4 | Cu (+)
D. (-) Zn | Zn2+ || Cu2+ | Cu (+)
45. Величина электродного потенциала металла зависит от…
A. удельной электропроводности
B. природы металла
C. активности ионов металла
D. температуры
46. ЭДС концентрационного гальванического элемента зависит от…
A. природы металла
B. заряда ионов металла
C. удельной электропроводности
D. соотношения концентраций растворов, в которые погружены электроды
47. Потенциал окислительно-восстановительного электрода зависит от ….
A. давления
B. природы окислительно-восстановительной пары
C. соотношения концентраций окисленной и восстановленной форм в растворе
D. заряд электрода
48. Электродвижущая сила со знаком “+” или “-“ гальванического элемента, составленного из стандартного водородного и стандартного данного электрода – это…
A. стандартный электродный потенциал металла
B. стандартный окислительно-восстановительный потенциал
C. стандартный концентрационный потенциал
D. стандартный диффузионный потенциал
49. Формула 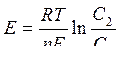 выражает величину…
выражает величину…
A. диффузионного потенциала
B. мембранного потенциала
C. потенциала покоя
D. потенциала действия
50. Потенциометрия – это физико-химический метод анализа, позволяющий определить концентрации ионов на основании…
A. электрической проводимости растворов
B. данных фотоэлектроколориметрии
C. титрования растворов
D. измерения ЭДС гальванической цепи
51. При потенциометрических измерениях гальваническая цепь состоит из…
A. электрода сравнения
B. окислительно-восстановительного электрода
С. исследуемого раствора
D. электрода определения
52. Электрод II рода схематично изображаются так…
A. Me | Men+
B. Me, MeA | An-
C. Pt(H2) | 2H+
D. Pt | 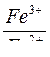
53. Выберите выражения, правильно характеризующие хлорсеребряный электрод.
A. условная запись Ag, AgCl | KClнас.
B. электрод сравнения
C. электрод определения
D. электродный потенциал равен нулю
54. Выберите выражения, правильно характеризующие стеклянный электрод.
A. электрод сравнения
B. электрод определения
C. применяется для определения рН в любых средах и при любых условиях
D. применяется для определения рН растворов
ЗАНЯТИЕ № 14
План занятия
1. Проверка посещаемости и информация
2. Решение ситуационных задач
3. Подведение итогов занятия
Ситуационные задачи
Задача 53.
Кривая кондуктометрического титрования 20 мл раствора смеси кислот 0,1 н раствором гидроксида натрия имеет следующий вид:
Вопрос: Чему равны концентрации сильной и слабой кислоты в растворе? Ответ обоснуйте.
Задача 54.
Кривая кондуктометрического титрования 20 мл раствора смеси кислот 0,1 н раствором гидроксида натрия имеет следующий вид:
Вопрос: Чему равны концентрации сильной и слабой кислоты в растворе? Ответ обоснуйте.
Задача 55.
Кривая кондуктометрического титрования 20 мл раствора смеси кислот 0,1 н раствором гидроксида натрия имеет следующий вид:
Вопрос: Чему равны концентрации сильной и слабой кислоты в растворе? Ответ обоснуйте.
Задача 56.
Водородный электрод погружен в раствор с рН = 0. Затем этот раствор нейтрализовали до рН = 7.
Вопрос: На сколько изменился потенциал водородного электрода? Ответ обоснуйте.
Задача 57.
Цинковый электрод погружен в раствор соли цинка. Затем этот раствор разбавили в 10 раз.
Вопрос: На сколько изменился потенциал цинкового электрода? Ответ обоснуйте.
Эталоны ответов НА ЗАДАНИЯ В ТЕСТОВОЙ ФОРМЕ
«ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
ЛИТЕРАТУРА
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 300 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 350 c.
ПРИЛОЖЕНИЕ 1
ТЕРМОДИНАМИЧЕСКИЕ ВЕЛИЧИНЫ
| ВЕЩЕСТВО | ∆Н0f, 298 кДж/моль | S0298, Дж/моль•К | ∆G0f,298, кДж/моль | С0р, Дж/моль•К |
ПРОСТЫЕ ВЕЩЕСТВА
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
УГЛЕВОДОРОДЫ
ПРИЛОЖЕНИЕ 2
Ионы
Ионная сила раствора, μ
Приложение 3
Кафедра химии

УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ПО ФИЗИЧЕСКОЙ ХИМИИ
для студентов, обучающихся по специальности « Фармация»
ТВЕРЬ
2018
УДК 541.1
ББК 24
Авторы-составители: Бордина Г.Е., Лопина Н.П., Халяпина Я.М.
Под общей редакцией профессора, док.биол.наук. Г.М. Зубаревой
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ГБОУ ВПО Тверская ГМА
Ю.П. Игнатова – канд. мед. наук, доцент кафедры физиологии ГБОУ ВПО Тверская ГМА
Учебно-методическое пособие утверждено ЦКМС ТГМА
Учебно-методическое пособие по физической химии [Текст]: учебное пособие для студентов фармацевтического факультета / Бордина Г.Е., Лопина Н.П. Халяпина Я.М. // Под общей редакцией: доктора биологических наук, профессора Г.М. Зубаревой. – Тверь, 2012. – 119 с.
Авторы-составители – сотрудники кафедры химии и биохимии Тверской государственной медицинской академии:
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
Надежда Петровна Лопина – канд. хим. наук, доцент кафедры химии
Янина Михайловна Халяпина – старший преподаватель кафедры химии
Учебно-методическое пособие составлено коллективом кафедры химии и биохимии Тверской государственной медицинской академии и предназначено в помощь студентам фармацевтического факультета для подготовки к лабораторно-практическим занятиям и экзамену.
УДК 541.1
ББК 24
© Бордина Г.Е., Лопина Н.П., Халяпина Я.М., 2012
ОГЛАВЛЕНИЕ
Предисловие………………………………………………………………...4
I . Химическая термодинамика…………………………………………... 5 – 6
Занятие № 1 Химическая термодинамика. Первое начало термодинамики………………………………………………………………7 – 16
Занятие № 2 Химическая термодинамика. Второе начало термодинамики.……………………………………………………………..17 – 27
Занятие № 3 Химический потенциал. Термодинамика
химического равновесия. Уравнение изотермы
химической реакции………………………………………………………..28 – 37
Занятие № 4 Итоговое занятие по теме «Химическая
термодинамика»………………………………..………………………38 – 39
II . Термодинамика фазовых равновесий……………………………….40
Занятие № 5 Термодинамика фазовых равновесий.
Основные понятия. Правило фаз Гиббса. Диаграммы состояния однокомпонентных систем………………………………………………...41 – 50
Занятие № 6 – 7 Закон Рауля. Диаграммы состояния
бинарных систем. Первый и второй законы Коновалова.
Простая и фракционная перегонка.……………………………………….51 – 63
Занятие № 8 Итоговое занятие по теме «Термодинамика
фазовых равновесий»………………………………………………………64 – 73
III. Термодинамика растворов электролитов.
Термодинамика разбавленных растворов.
Электрохимия……………………………………………………………..74
Занятие № 9 Буферные системы и растворы………..…………………...75 – 83
Занятие № 10 Буферные системы и растворы …………...……………...84 – 87
Занятие № 11 Теория растворов сильных электролитов.
Электрохимия………………………………………….…………………...88 – 93
Занятие № 12 – 13 Электрохимия …………………………......................94 – 108
Занятие № 14 Итоговое занятие по теме «Термодинамика растворов электролитов. Термодинамика разбавленных растворов.
Электрохимия» …………………………………………………………….109 – 110
Литература………………………………………………………………...113
Приложение 1……………………………………………............................114 – 116
Приложение 2……………………………………………............................117
Приложение 3………………………………………………........................118
"Мощь и сила науки – во множестве фактов,
цель – в обобщении этого множества".
Д.И. Менделеев
ПРЕДИСЛОВИЕ
Настоящее учебно-методическое пособие соответствует примерной программе по дисциплине «Физическая и коллоидная химии» для специальности 060301 –фармация, утвержденной Руководителем Департамента образовательных медицинских учреждений и кадровой политики Минздрава России Н.Н. Володиным (Москва, 2002 г.).
Физическая химия является теоретической основой для изучения биохимии, фармацевтической химии, технологии лекарств, токсикологической химии, физиологии, физико-химических методов исследования и анализа, используемых в фармации.
Авторы-составители стремились подобрать задания, охватывающие все теоретические вопросы программы курса физической и коллоидной химии.
Новизна учебно-методического пособия заключается в том, что задания выбраны применительно не к отдельному понятию или закону, а к комплексу знаний.
Учебно-методическое пособие включает 3 модуля. Каждый модуль содержит вопросы к занятию, эталоны решения типовых и ситуационных задач, задачи для самостоятельного решения, тестовые задания с эталонами ответов.
Расчетные задачи сгруппированы по модульному принципу, что соответствует содержанию важнейших тем курса физической и коллоидной химии для медицинских вузов. В каждом модуле даны примеры решения типовых и ситуационных задач. На некоторые задачи ответы не приводятся; авторы-составители пошли на такой шаг вполне сознательно, так как в ряде случаев приведение ответа фактически означает сообщение студенту решения задачи.
Учебно-методическое пособие выполняет обучающую, контролирующую и прикладную функции, дает возможность студенту самому оценить уровень сформированности расчетных умений, развить собственную инициативу и познавательную активность по решению разнообразных химических задач.
Мы заранее благодарны всем коллегам, которые, ознакомившись с данным пособием, сообщат нам о замеченных ими просчетах или недостатках.
Авторы-составители
Дата: 2018-12-21, просмотров: 730.