1. При термических ожогах первой степени (краснота и припухлость) обожженное место надо обработать спиртовым раствором танина, 96%-ным этиловым спиртом или раствором перманганата калия. При ожогах второй и третьей степени (пузыри и язвы) допустимы только обеззараживающие примочки из раствора перманганата калия, после чего необходимо обратиться к врачу.
2. При ожогах кислотами необходимо промыть пораженное место большим количеством проточной воды, а затем 3%-ным раствором гидрокарбоната натрия, после чего – снова водой.
3. При ожогах щелочами нужно промыть очаг поражения проточной водой, а затем разбавленным раствором борной или уксусной кислоты.
4. При попадании щелочи или кислоты в глаза необходимо промыть их проточной водой (3 – 5мин), а затем раствором борной кислоты (в случае попадания щелочи) или гидрокарбоната натрия (в случае попадания кислоты), после чего обратиться к врачу.
5. При ожогах фенолом очаг поражения следует обработать 70%-ным этиловым спиртом, а затем глицерином до исчезновения белых пятен на коже. При отравлении парами фенола категорически запрещается пить молоко.
6. При ожогах бромом его нужно смыть 96%-ным спиртом или разбавленным раствором щелочи, после чего место поражения смазать мазью от ожогов и обратиться к врачу. При отравлении парами брома необходимо несколько раз глубоко вдохнуть пары этилового спирта, а затем выпить молока.
7. При попадании на кожу едких органических веществ, не растворимых в воде, их необходимо смыть большим количеством подходящего растворителя. После оказания первой помощи пострадавший должен быть направлен в медпункт.
ХИМИЧЕСКАЯ ПОСУДА И
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
В лабораторных условиях чаще всего используется стеклянная посуда. Она устойчива к воздействию большинства химических реагентов, легко моется и, что также немаловажно, прозрачная. Стеклянной посудой нельзя пользоваться при работе с фтороводородом и с расплавленной щелочью, в ней нельзя нагревать концентрированные растворы щелочей.
Стаканы изготавливают или из обычного химически стойкого, или из тугоплавкого стекла (термоустойчивые). Нагревать стаканы из обычного стекла на открытом пламени нельзя. Нагревание можно вести только на асбестовой сетке или на водяной бане. Вместимость химических стаканов колеблется от 50 до 2000 мл. Их используют для вспомогательных работ с органическими жидкостями и водными растворами различных соединений.
Пробирки бывают различной величины и диаметра. Обычные лабораторные пробирки изготавливают из легкоплавкого стекла, но для особых работ, например, при высоких температурах применяют пробирки из тугоплавкого стекла или кварца.
В химической лаборатории пробирки используют для проведения реакций с различными веществами. При перемешивании реактивов пробирку держат за верхнюю часть большим, указательным и средним пальцами левой руки, а указательным пальцем правой руки ударяют косым скользящим движением по ее нижней части несколько раз. Нельзя встряхивать пробирку, закрывая ее пальцем, так как при этом загрязняются перемешиваемые вещества, а при проведении опытов с едкими веществами может быть травмирована кожа руки. Если пробирку необходимо нагреть, то ее закрепляют в держателе или в лапке штатива.
При нагревании пробирки с реакционной смесью на открытом пламени необходимо помнить следующее:
1) открытый конец пробирки должен быть повернут в сторону от работающих людей;
2) перед локальным нагреванием пробирки ее необходимо равномерно прогреть по всей длине;
3) для предотвращения вскипания и выплескивания реакционной смеси пробирку следует осторожно нагревать в верхней части пламени до появления первых признаков закипания, затем следует убрать ее из пламени, продолжая нагревать горячим воздухом; по мере необходимости пробирку можно вносить на короткое время в пламя горелки.
Колбы бывают плоскодонные, конические, круглодонные и грушевидные (рис.1).
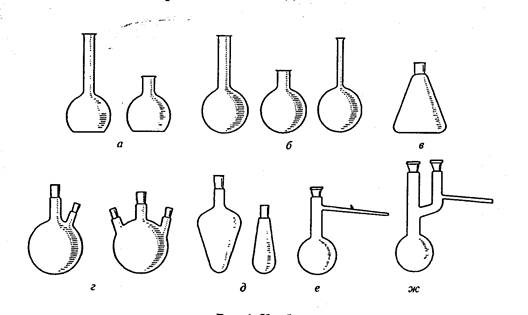
Рис.1. Колбы:
а – плоскодонные; б – круглодонные; в – коническая;
г – двух- и трехгорлые;
д – грушевидные; е – колба Вюрца; ж – колба Кляйзена
Плоскодонные и конические колбы обычно используют в качестве приемников при перегонке жидкостей, для приготовления растворов и кристаллизации. Их нельзя применять при нагревании веществ до высоких температур и использовать при работе при пониженном давлением (из-за опасности разрушения колб). Круглодонные колбы используют для перегонки веществ, в том числе и под вакуумом. Длина и диаметр горла круглодонных колб могут варьировать. Эти колбы бывают двух-, трехгорлыми и т.д. Круглодонные колбы с отводной трубкой называют колбами Вюрца. Они предназначены для перегонки веществ при атмосферном давлении. В отличие от колбы Вюрца колба Кляйзена имеет на горле две шейки, от одной из которых отходит отводная трубка. Колбы Кляйзена применяют для перегонки жидкостей при пониженном давлении.
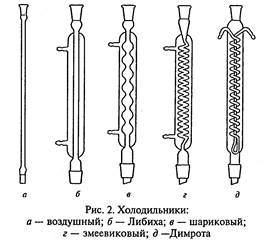
Холодильники (рис.2) служат для охлаждения и конденсации паров, образующихся при кипении органических жидкостей. Чтобы избежать потерь низкокипящих компонентов, колбы снабжают обратными холодильниками, где пары охлаждаются и конденсат возвращается в реакционную смесь.
При перегонке вещество конденсируется в холодильнике и отводится в приемную колбу. Такие холодильники называются нисходящими (они крепятся под углом к столу в сторону приемника).
Простейшим является воздушный холодильник, который представляет собой длинную стеклянную трубку. Он годится только для работы с высококипящими жидкостями, поскольку эффективность воздуха как охлаждающего средства невелика. Воздушный холодильник можно использовать и как нисходящий, но при не слишком большой скорости перегонки, для жидкостей с температурой кипения больше 1500С.
В холодильнике Либиха для охлаждения и конденсации пара используется проточная вода. Его применяют в качестве нисходящего для перегонки жидкостей с температурой кипения менее 1600С. В качестве обратного этот холодильник малоэффективен, так как имеет небольшую охлаждающую поверхность.
Шариковый холодильник используют только как обратный, поскольку его охлаждающая поверхность значительно больше, чем у холодильника Либиха.
Змеевиковый холодильник никогда не следует использовать как обратный, потому что конденсат, который недостаточно хорошо стекает по изгибам змеевика, может быть выброшен из холодильника и послужить причиной несчастного случая. Змеевиковый холодильник, установленный вертикально, является наиболее эффективным нисходящим холодильником, особенно для низкокипящих веществ. Его нельзя устанавливать наклонно, так как конденсат может скапливаться внутри холодильника и не доходить до приемника.
 Воронки. Воронки для фильтрования выпускают различных размеров – диаметром от 35 до 300мм. обычно воронки имеют ровную внутреннюю стенку, но для ускоренного фильтрования иногда применяют воронки с ребристой внутренней поверхностью.
Воронки. Воронки для фильтрования выпускают различных размеров – диаметром от 35 до 300мм. обычно воронки имеют ровную внутреннюю стенку, но для ускоренного фильтрования иногда применяют воронки с ребристой внутренней поверхностью.
 Кроме того, некоторые воронки имеют удлиненный конец, внутренний диаметр которого в верхней части меньше, чем в нижней (рис.3); такая конструкция также ускоряет фильтрование.
Кроме того, некоторые воронки имеют удлиненный конец, внутренний диаметр которого в верхней части меньше, чем в нижней (рис.3); такая конструкция также ускоряет фильтрование.
 Воронки Бюхнера отличаются от обычных воронок тем, что они сделаны из фарфора и имеют перегородку с отверстиями, на которую помещают фильтр (рис.4). Воронку вставляют в колбу Бунзена, из которой затем откачивают воздух.
Воронки Бюхнера отличаются от обычных воронок тем, что они сделаны из фарфора и имеют перегородку с отверстиями, на которую помещают фильтр (рис.4). Воронку вставляют в колбу Бунзена, из которой затем откачивают воздух.
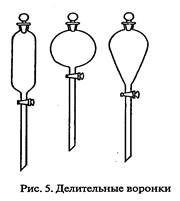
Делительные воронки применяют для разделения несмешивающихся жидкостей и для экстракции. Они бывают цилиндрической, шаровидной или грушевидной формы, с пробиркой в верхней части отводной трубки (рис.5).
Капельные воронки предназначены для медленного прибавления жидкости в реакционную смесь во время проведения синтеза веществ.
Они похожи на делительные, но у них более тонкие стенки и более длинные отводные трубки. Капельные воронки составляют часть прибора и крепятся к горлу колбы на шлифе или при помощи резиновой пробки. Перед работой с капельной или делительной воронкой шлиф стеклянного крана нужно смазать вазелином или специальной смазкой.
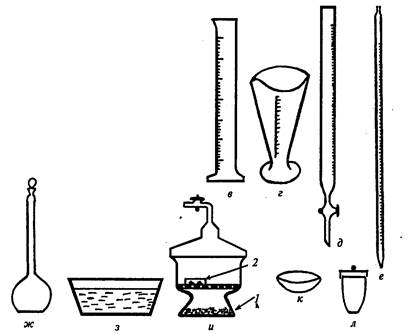 Мерная посуда служит для для измерения объема жидкости. Мерные цилиндры и мензурки (рис.7,в,г) служат для измерения больших объемов – от 5 до 2000мл. Бюретки – приборы для измерения точных объемов жидкости, применяемые преимущественно при титровании (рис.7,д). Пипетками (рис.7,е) отмеряют наиболее точные объемы – от 0,005мл (для микропипеток) до 10–25мл (для градуированных пипеток и пипеток Мора). Мерные колбы (рис.7,ж) предназначены для приготовления растворов точных концентраций. Они имеют длинную шейку, на которой нанесена кольцевая черта, шлиф и притертую пробку. При приготовлении раствора уровень жидкости доводят до кольцевой черты.
Мерная посуда служит для для измерения объема жидкости. Мерные цилиндры и мензурки (рис.7,в,г) служат для измерения больших объемов – от 5 до 2000мл. Бюретки – приборы для измерения точных объемов жидкости, применяемые преимущественно при титровании (рис.7,д). Пипетками (рис.7,е) отмеряют наиболее точные объемы – от 0,005мл (для микропипеток) до 10–25мл (для градуированных пипеток и пипеток Мора). Мерные колбы (рис.7,ж) предназначены для приготовления растворов точных концентраций. Они имеют длинную шейку, на которой нанесена кольцевая черта, шлиф и притертую пробку. При приготовлении раствора уровень жидкости доводят до кольцевой черты.
Кристаллизаторы – это низкобортные сосуды, предназначенные для охлаждения веществ при их получении или кристаллизации (рис. 7, з). Иногда в кристаллизаторах можно проводить выпаривание, но следует помнить, что нагревать их можно только на водяной бане.
Эксикаторы – это емкости из толстостенного стекла (рис.7, и), состоящие из массивного корпуса и притертой к нему стеклянной крышки. Они предназначены для упаривание растворов и высушивания твердых веществ. Различают простые и вакуум-эксикаторы. Из последних через трубку с краном при помощи водоструйного насоса откачивают воздух. Вещество помещают в эксикатор в чашке Петри. В качестве осушителя применяют прокаленный хлорид кальция, оксид фосфора (V), силикагель, натронную известь, гидроксид натрия, сульфат магния или натрия.
Фарфоровая посуда позволяет вести прямой обогрев веществ до температуры 12000С. Недостатком этой посуды является ее большая масса и непрозрачность. Чашки для выпаривания (рис.7, к) применяют для нагревания и выпаривания различных растворов. Этот процесс можно вести на открытом пламени, но равномерное выпаривание растворов обычно происходит на асбестовой сетке или водяной бане. Тигли (рис.7, л) применяют для прокаливания различных веществ и для сжигания органических соединений. Из фарфоровой посуды в химической лаборатории часто применяют стаканы, ложки, шпатели и ступки.
Нагревательные бани. Прямое нагревание на пламени газовой горелки или электрической плитке может приводить к местным перегревам. Этого можно избежать при использовании нагревательных бань. В качестве теплопроводящей среды в банях применяют воду, воздух, песок и масло.
Простейшую воздушную баню можно получить, если между пламенем и нагреваемой колбой поместить асбестовую сетку. Песчаные бани обладают очень большой тепловой инерцией, что затрудняет регуляцию температуры. Наиболее удобны масляные и водяные бани, так как они обеспечивают равномерное нагревание колбы и благодаря незначительной тепловой инерции позволяют точно регулировать температуру реакционной смеси. Выбор бани определяется свойствами нагреваемого вещества или смеси, а также температурой, необходимой для их нагревания. Водяные бани применяют при нагревании веществ до 1000С, масляные – до 1500С, электрические воздушные – до 2500С, песчаные – свыше 4000С. необходимо помнить, что водяные бани нельзя использовать при работе с металлическими натрием и калием.
Основные понятия
Моль - количество вещества, которое содержит 6,02•1023 частиц.
Na=6,02 •1023 – число Авогадро, n= 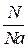
Относительные массы атомов и молекул выражают в атомных единицах массы (а. е. м.). 1 а. е. м. равна 1/12 части атома углерода 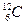 , т, е. 1,66•10-24г. Буквы «а. е. м.» при числовом значении относительной массы обычно не указывают. Например, относительная молекулярная масса воды Мr=18.
, т, е. 1,66•10-24г. Буквы «а. е. м.» при числовом значении относительной массы обычно не указывают. Например, относительная молекулярная масса воды Мr=18.
Молярная масса — масса вещества количеством 1 моль (г/моль).
Количественные расчеты реагентов, находящихся в газообразном состоянии, удобнее производить по объему. Один моль газа при нормальных условиях (р0 = 760 мм рт. ст. или 101,325 кПа и температуре Т0 = 273,15 К или 0 °С) занимает объем V0 = 22,4 л = 22 400 мл — 0,0224 м3. Большинство простых газов (кроме благородных) состоят из двухатомных молекул: H2, O2, Cl2 и т.д.
Пример 1. Определите массу молекулы воды.
Решение: Молярная масса воды М(Н2О) составляет 18 г/моль. Исходя из молярной массы и числа молекул, содержащихся в 1 моль вещества, рассчитываем абсолютную массу молекулы Н2О:
m(H2О) = М(Н2О)/NA = 18/6,02•1023 = 3•10-23 г.
Пример 2. Найдите массу одной молекулы КОН.
Решениe: Массу молекулы можно определить исходя из относительной молекулярной массы в а. е. м. Мr (КОН) = 56 а. е. м., масса одной молекулы гидроксида калия m(КОН) = 56 • 1,66•10-24 = 9,3•10-23 г.
Пример 3. Сколько молей составляют 14 г азота? Какой объем они занимают при н. у.? Сколько в них молекул?
Решение. Определяем число молей n азота:
n = m(N2)/M(N2) = 14/28 = 0,5 моль.
Один моль газа занимает при н. у. объем 22,4 л, а 0,5 моль — 11,2 л.
В 1 моль содержится 6,02•1023 молекул, а в 0,5 моль — 3,01•1023 молекул.
Контрольные вопросы и задания
1. Какие правила работы и техники безопасности необходимо соблюдать в химической лаборатори?
2. Приведите примеры химической посуды и объясните правила работы с ней.
3. Дайте определение основным понятиям и законам химии.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 66 - 73 с.
1. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив.., 2017 г. – 3 – 4, 41 – 44 с.
Задания для самостоятельного решения
1. Вычислить относительную молекулярную массу фосфорной кислоты H3PO4. Ответ: 98
2. Определите количество вещества сульфата алюминия, содержащееся в Al2(SO4)3 массой 17,1 г. Ответ: 0,05 моль
3. Рассчитайте массу молекулярного кислорода количеством вещества 2 моль. Ответ: 64 г.
4. Определите массу атомарного азота количеством вещества 0,5 моль. Ответ: 7 г.
5. Сколько молекул серы содержится в октасере S8 массой 2,56 г? Ответ: 6,02•1021
6. Сколько атомов фосфора содержится в тетрафосфоре Р4 массой 248г? Ответ: 4,8•1024
7. Сколько молекул H2S содержится в сероводороде массой 170 г? Ответ: 3•1024 молекул
8. Сколько атомов кислорода содержится в серной кислоте массой 2,45г? Ответ: 6,02•1022 атомов
9. В каком количестве вещества оксида азота(IV) содержится такое же число атомов азота, что и в азотной кислоте массой 12,6 г? Ответ: 0.2 моль
10. Сколько атомов железа содержится в сульфате железа(III) Fe2(SO4)3 количеством вещества 2 моль? Ответ: 2,4•1024 атомов
11. Сравните число атомов, содержащихся в молекулярном хлоре массой 10 г и молекулярном аргоне массой 10 г. В каком случае и во сколько раз число атомов больше? Ответ:1,7•1023 атомов хлора и 1,5•1023 атомов аргона
12. Какую массу имеют 1,55•1023 молекулы воды? Ответ: 4,6 г
13. Рассчитайте массу 12,04•1023 атомов натрия? Ответ: 46 г.
14. Какое количество вещества составляют: а) 6,02•1025 молекулы; б) 3,01•1020 атома? Ответ: А) 100 моль, Б) 0,005 моль
15. Рассчитайте массу атома: а) магния; б) хлора; в) железа; г) азота. Ответ: А) 3,9•10-23, Б) 5,9•10-23, В) 9,3•10-23, Г) 2,32•10-23
16. Вычислите массу молекулы: а) оксида железа(III); б) гидроксида натрия; в) угольной кислоты; г) сульфата калия. Ответ: А) 2,65•10-22, Б) 6,64•10-23, В) 1,03•10-24, Г) 2,89•10-22
ЗАНЯТИЕ 2
Дата: 2018-12-21, просмотров: 723.