Кафедра химии
ОБЩАЯ ХИМИЯ
Учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и экзамену
для студентов 1 курса фармацевтического факультета
ТВЕРЬ
2017
УДК 54 :615
ББК 24
Авторы-составители: Лопина Н.П., Бордина Г.Е.
Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М.
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ФГБОУ ВО Тверского ГМУ Минздрава России
Ю.П. Игнатова – канд. мед. наук, доцент кафедры физиологии ФГБОУ ВО Тверского ГМУ Минздрава России
Учебно-методическое пособие утверждено ЦКМС ТГМУ
Общая химии. [Текст]: учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и экзамену для студентов 1 курса фармацевтического факультета / Лопина Н.П., Бордина Г.Е. // Под общей редакцией: Зубаревой Г.М. – Тверь: Ред.-издат. центр Твер. гос. мед. унив.., 2017. – 96 с.
Учебно-методическое пособие составлено коллективом кафедры химии Тверского государственного медицинского университета и предназначено в помощь студентам I курса фармацевтического факультета для подготовки к лабораторно-практическим занятиям и экзамену.
Авторы-составители – сотрудники кафедры химии Тверского государственного медицинского университета:
Надежда Петровна Лопина – канд. хим. наук, доцент кафедры химии
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
ОГЛАВЛЕНИЕ
I. СТРОЕНИЕ ВЕЩЕСТВА
II. Учение о растворах
III. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
ПРЕДИСЛОВИЕ
Учебно-методическое пособие соответствует примерной программе по дисциплине «Общая и неорганическая химия» для специальностей 060301 – фармация утвержденной Руководителем Департамента образовательных программ и стандартов профессионального образования Минобразования России (Москва, 2002 г.).
Химия является теоретической основой для изучения биохимии, фармацевтической химии, токсикологической химии, физиологии, анатомия.
Авторы-составители стремились подобрать задания, охватывающие все теоретические вопросы программы курса химии.
Новизна учебно-методического пособия заключается в том, что оно составлено согласно рекомендациям образовательного стандарта III поколения.
Учебно-методическое пособие включает 3 модуля. Каждый модуль содержит вопросы и задания к занятию, эталоны решения задач, задачи для самостоятельного решения, тестовые задания с эталонами ответов.
На некоторые задачи ответы не приводятся; авторы пошли на такой шаг вполне сознательно, так как в ряде случаев приведение ответа фактически означает сообщение студенту решения задачи.
Учебно-методическое пособие выполняет обучающую, контролирующую и прикладную функции, дает возможность студенту самому оценить уровень сформированности расчетных умений, развить собственную инициативу и познавательную активность по решению разнообразных химических задач.
Мы заранее благодарны всем коллегам, которые, ознакомившись с данным пособием, сообщат нам о замеченных ими просчетах или недостатках.
Авторы-составители
I. СТРОЕНИЕ ВЕЩЕСТВА
ЗАНЯТИЕ 1
Правила работы в химической лаборатории. Введение в практикум. Основные понятия и законы химии.
План занятия
1. Проверка посещаемости и информация
2. Объяснение преподавателя
3. Тестовый контроль (проверка исходного школьного уровня знаний)
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ХИМИЧЕСКАЯ ПОСУДА И
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
В лабораторных условиях чаще всего используется стеклянная посуда. Она устойчива к воздействию большинства химических реагентов, легко моется и, что также немаловажно, прозрачная. Стеклянной посудой нельзя пользоваться при работе с фтороводородом и с расплавленной щелочью, в ней нельзя нагревать концентрированные растворы щелочей.
Стаканы изготавливают или из обычного химически стойкого, или из тугоплавкого стекла (термоустойчивые). Нагревать стаканы из обычного стекла на открытом пламени нельзя. Нагревание можно вести только на асбестовой сетке или на водяной бане. Вместимость химических стаканов колеблется от 50 до 2000 мл. Их используют для вспомогательных работ с органическими жидкостями и водными растворами различных соединений.
Пробирки бывают различной величины и диаметра. Обычные лабораторные пробирки изготавливают из легкоплавкого стекла, но для особых работ, например, при высоких температурах применяют пробирки из тугоплавкого стекла или кварца.
В химической лаборатории пробирки используют для проведения реакций с различными веществами. При перемешивании реактивов пробирку держат за верхнюю часть большим, указательным и средним пальцами левой руки, а указательным пальцем правой руки ударяют косым скользящим движением по ее нижней части несколько раз. Нельзя встряхивать пробирку, закрывая ее пальцем, так как при этом загрязняются перемешиваемые вещества, а при проведении опытов с едкими веществами может быть травмирована кожа руки. Если пробирку необходимо нагреть, то ее закрепляют в держателе или в лапке штатива.
При нагревании пробирки с реакционной смесью на открытом пламени необходимо помнить следующее:
1) открытый конец пробирки должен быть повернут в сторону от работающих людей;
2) перед локальным нагреванием пробирки ее необходимо равномерно прогреть по всей длине;
3) для предотвращения вскипания и выплескивания реакционной смеси пробирку следует осторожно нагревать в верхней части пламени до появления первых признаков закипания, затем следует убрать ее из пламени, продолжая нагревать горячим воздухом; по мере необходимости пробирку можно вносить на короткое время в пламя горелки.
Колбы бывают плоскодонные, конические, круглодонные и грушевидные (рис.1).
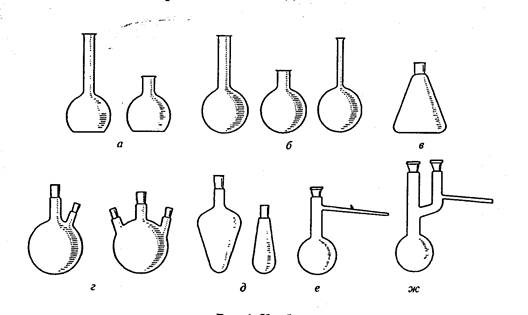
Рис.1. Колбы:
а – плоскодонные; б – круглодонные; в – коническая;
г – двух- и трехгорлые;
д – грушевидные; е – колба Вюрца; ж – колба Кляйзена
Плоскодонные и конические колбы обычно используют в качестве приемников при перегонке жидкостей, для приготовления растворов и кристаллизации. Их нельзя применять при нагревании веществ до высоких температур и использовать при работе при пониженном давлением (из-за опасности разрушения колб). Круглодонные колбы используют для перегонки веществ, в том числе и под вакуумом. Длина и диаметр горла круглодонных колб могут варьировать. Эти колбы бывают двух-, трехгорлыми и т.д. Круглодонные колбы с отводной трубкой называют колбами Вюрца. Они предназначены для перегонки веществ при атмосферном давлении. В отличие от колбы Вюрца колба Кляйзена имеет на горле две шейки, от одной из которых отходит отводная трубка. Колбы Кляйзена применяют для перегонки жидкостей при пониженном давлении.
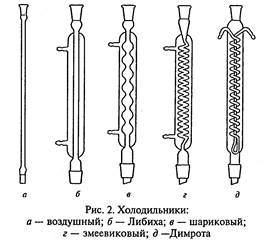
Холодильники (рис.2) служат для охлаждения и конденсации паров, образующихся при кипении органических жидкостей. Чтобы избежать потерь низкокипящих компонентов, колбы снабжают обратными холодильниками, где пары охлаждаются и конденсат возвращается в реакционную смесь.
При перегонке вещество конденсируется в холодильнике и отводится в приемную колбу. Такие холодильники называются нисходящими (они крепятся под углом к столу в сторону приемника).
Простейшим является воздушный холодильник, который представляет собой длинную стеклянную трубку. Он годится только для работы с высококипящими жидкостями, поскольку эффективность воздуха как охлаждающего средства невелика. Воздушный холодильник можно использовать и как нисходящий, но при не слишком большой скорости перегонки, для жидкостей с температурой кипения больше 1500С.
В холодильнике Либиха для охлаждения и конденсации пара используется проточная вода. Его применяют в качестве нисходящего для перегонки жидкостей с температурой кипения менее 1600С. В качестве обратного этот холодильник малоэффективен, так как имеет небольшую охлаждающую поверхность.
Шариковый холодильник используют только как обратный, поскольку его охлаждающая поверхность значительно больше, чем у холодильника Либиха.
Змеевиковый холодильник никогда не следует использовать как обратный, потому что конденсат, который недостаточно хорошо стекает по изгибам змеевика, может быть выброшен из холодильника и послужить причиной несчастного случая. Змеевиковый холодильник, установленный вертикально, является наиболее эффективным нисходящим холодильником, особенно для низкокипящих веществ. Его нельзя устанавливать наклонно, так как конденсат может скапливаться внутри холодильника и не доходить до приемника.
 Воронки. Воронки для фильтрования выпускают различных размеров – диаметром от 35 до 300мм. обычно воронки имеют ровную внутреннюю стенку, но для ускоренного фильтрования иногда применяют воронки с ребристой внутренней поверхностью.
Воронки. Воронки для фильтрования выпускают различных размеров – диаметром от 35 до 300мм. обычно воронки имеют ровную внутреннюю стенку, но для ускоренного фильтрования иногда применяют воронки с ребристой внутренней поверхностью.
 Кроме того, некоторые воронки имеют удлиненный конец, внутренний диаметр которого в верхней части меньше, чем в нижней (рис.3); такая конструкция также ускоряет фильтрование.
Кроме того, некоторые воронки имеют удлиненный конец, внутренний диаметр которого в верхней части меньше, чем в нижней (рис.3); такая конструкция также ускоряет фильтрование.
 Воронки Бюхнера отличаются от обычных воронок тем, что они сделаны из фарфора и имеют перегородку с отверстиями, на которую помещают фильтр (рис.4). Воронку вставляют в колбу Бунзена, из которой затем откачивают воздух.
Воронки Бюхнера отличаются от обычных воронок тем, что они сделаны из фарфора и имеют перегородку с отверстиями, на которую помещают фильтр (рис.4). Воронку вставляют в колбу Бунзена, из которой затем откачивают воздух.
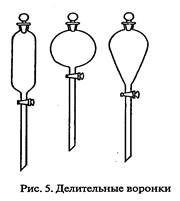
Делительные воронки применяют для разделения несмешивающихся жидкостей и для экстракции. Они бывают цилиндрической, шаровидной или грушевидной формы, с пробиркой в верхней части отводной трубки (рис.5).
Капельные воронки предназначены для медленного прибавления жидкости в реакционную смесь во время проведения синтеза веществ.
Они похожи на делительные, но у них более тонкие стенки и более длинные отводные трубки. Капельные воронки составляют часть прибора и крепятся к горлу колбы на шлифе или при помощи резиновой пробки. Перед работой с капельной или делительной воронкой шлиф стеклянного крана нужно смазать вазелином или специальной смазкой.
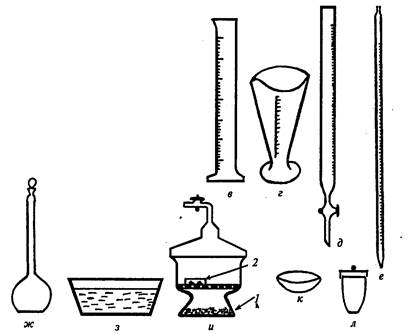 Мерная посуда служит для для измерения объема жидкости. Мерные цилиндры и мензурки (рис.7,в,г) служат для измерения больших объемов – от 5 до 2000мл. Бюретки – приборы для измерения точных объемов жидкости, применяемые преимущественно при титровании (рис.7,д). Пипетками (рис.7,е) отмеряют наиболее точные объемы – от 0,005мл (для микропипеток) до 10–25мл (для градуированных пипеток и пипеток Мора). Мерные колбы (рис.7,ж) предназначены для приготовления растворов точных концентраций. Они имеют длинную шейку, на которой нанесена кольцевая черта, шлиф и притертую пробку. При приготовлении раствора уровень жидкости доводят до кольцевой черты.
Мерная посуда служит для для измерения объема жидкости. Мерные цилиндры и мензурки (рис.7,в,г) служат для измерения больших объемов – от 5 до 2000мл. Бюретки – приборы для измерения точных объемов жидкости, применяемые преимущественно при титровании (рис.7,д). Пипетками (рис.7,е) отмеряют наиболее точные объемы – от 0,005мл (для микропипеток) до 10–25мл (для градуированных пипеток и пипеток Мора). Мерные колбы (рис.7,ж) предназначены для приготовления растворов точных концентраций. Они имеют длинную шейку, на которой нанесена кольцевая черта, шлиф и притертую пробку. При приготовлении раствора уровень жидкости доводят до кольцевой черты.
Кристаллизаторы – это низкобортные сосуды, предназначенные для охлаждения веществ при их получении или кристаллизации (рис. 7, з). Иногда в кристаллизаторах можно проводить выпаривание, но следует помнить, что нагревать их можно только на водяной бане.
Эксикаторы – это емкости из толстостенного стекла (рис.7, и), состоящие из массивного корпуса и притертой к нему стеклянной крышки. Они предназначены для упаривание растворов и высушивания твердых веществ. Различают простые и вакуум-эксикаторы. Из последних через трубку с краном при помощи водоструйного насоса откачивают воздух. Вещество помещают в эксикатор в чашке Петри. В качестве осушителя применяют прокаленный хлорид кальция, оксид фосфора (V), силикагель, натронную известь, гидроксид натрия, сульфат магния или натрия.
Фарфоровая посуда позволяет вести прямой обогрев веществ до температуры 12000С. Недостатком этой посуды является ее большая масса и непрозрачность. Чашки для выпаривания (рис.7, к) применяют для нагревания и выпаривания различных растворов. Этот процесс можно вести на открытом пламени, но равномерное выпаривание растворов обычно происходит на асбестовой сетке или водяной бане. Тигли (рис.7, л) применяют для прокаливания различных веществ и для сжигания органических соединений. Из фарфоровой посуды в химической лаборатории часто применяют стаканы, ложки, шпатели и ступки.
Нагревательные бани. Прямое нагревание на пламени газовой горелки или электрической плитке может приводить к местным перегревам. Этого можно избежать при использовании нагревательных бань. В качестве теплопроводящей среды в банях применяют воду, воздух, песок и масло.
Простейшую воздушную баню можно получить, если между пламенем и нагреваемой колбой поместить асбестовую сетку. Песчаные бани обладают очень большой тепловой инерцией, что затрудняет регуляцию температуры. Наиболее удобны масляные и водяные бани, так как они обеспечивают равномерное нагревание колбы и благодаря незначительной тепловой инерции позволяют точно регулировать температуру реакционной смеси. Выбор бани определяется свойствами нагреваемого вещества или смеси, а также температурой, необходимой для их нагревания. Водяные бани применяют при нагревании веществ до 1000С, масляные – до 1500С, электрические воздушные – до 2500С, песчаные – свыше 4000С. необходимо помнить, что водяные бани нельзя использовать при работе с металлическими натрием и калием.
Основные понятия
Моль - количество вещества, которое содержит 6,02•1023 частиц.
Na=6,02 •1023 – число Авогадро, n= 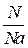
Относительные массы атомов и молекул выражают в атомных единицах массы (а. е. м.). 1 а. е. м. равна 1/12 части атома углерода 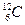 , т, е. 1,66•10-24г. Буквы «а. е. м.» при числовом значении относительной массы обычно не указывают. Например, относительная молекулярная масса воды Мr=18.
, т, е. 1,66•10-24г. Буквы «а. е. м.» при числовом значении относительной массы обычно не указывают. Например, относительная молекулярная масса воды Мr=18.
Молярная масса — масса вещества количеством 1 моль (г/моль).
Количественные расчеты реагентов, находящихся в газообразном состоянии, удобнее производить по объему. Один моль газа при нормальных условиях (р0 = 760 мм рт. ст. или 101,325 кПа и температуре Т0 = 273,15 К или 0 °С) занимает объем V0 = 22,4 л = 22 400 мл — 0,0224 м3. Большинство простых газов (кроме благородных) состоят из двухатомных молекул: H2, O2, Cl2 и т.д.
Пример 1. Определите массу молекулы воды.
Решение: Молярная масса воды М(Н2О) составляет 18 г/моль. Исходя из молярной массы и числа молекул, содержащихся в 1 моль вещества, рассчитываем абсолютную массу молекулы Н2О:
m(H2О) = М(Н2О)/NA = 18/6,02•1023 = 3•10-23 г.
Пример 2. Найдите массу одной молекулы КОН.
Решениe: Массу молекулы можно определить исходя из относительной молекулярной массы в а. е. м. Мr (КОН) = 56 а. е. м., масса одной молекулы гидроксида калия m(КОН) = 56 • 1,66•10-24 = 9,3•10-23 г.
Пример 3. Сколько молей составляют 14 г азота? Какой объем они занимают при н. у.? Сколько в них молекул?
Решение. Определяем число молей n азота:
n = m(N2)/M(N2) = 14/28 = 0,5 моль.
Один моль газа занимает при н. у. объем 22,4 л, а 0,5 моль — 11,2 л.
В 1 моль содержится 6,02•1023 молекул, а в 0,5 моль — 3,01•1023 молекул.
Контрольные вопросы и задания
1. Какие правила работы и техники безопасности необходимо соблюдать в химической лаборатори?
2. Приведите примеры химической посуды и объясните правила работы с ней.
3. Дайте определение основным понятиям и законам химии.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 66 - 73 с.
1. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив.., 2017 г. – 3 – 4, 41 – 44 с.
Задания для самостоятельного решения
1. Вычислить относительную молекулярную массу фосфорной кислоты H3PO4. Ответ: 98
2. Определите количество вещества сульфата алюминия, содержащееся в Al2(SO4)3 массой 17,1 г. Ответ: 0,05 моль
3. Рассчитайте массу молекулярного кислорода количеством вещества 2 моль. Ответ: 64 г.
4. Определите массу атомарного азота количеством вещества 0,5 моль. Ответ: 7 г.
5. Сколько молекул серы содержится в октасере S8 массой 2,56 г? Ответ: 6,02•1021
6. Сколько атомов фосфора содержится в тетрафосфоре Р4 массой 248г? Ответ: 4,8•1024
7. Сколько молекул H2S содержится в сероводороде массой 170 г? Ответ: 3•1024 молекул
8. Сколько атомов кислорода содержится в серной кислоте массой 2,45г? Ответ: 6,02•1022 атомов
9. В каком количестве вещества оксида азота(IV) содержится такое же число атомов азота, что и в азотной кислоте массой 12,6 г? Ответ: 0.2 моль
10. Сколько атомов железа содержится в сульфате железа(III) Fe2(SO4)3 количеством вещества 2 моль? Ответ: 2,4•1024 атомов
11. Сравните число атомов, содержащихся в молекулярном хлоре массой 10 г и молекулярном аргоне массой 10 г. В каком случае и во сколько раз число атомов больше? Ответ:1,7•1023 атомов хлора и 1,5•1023 атомов аргона
12. Какую массу имеют 1,55•1023 молекулы воды? Ответ: 4,6 г
13. Рассчитайте массу 12,04•1023 атомов натрия? Ответ: 46 г.
14. Какое количество вещества составляют: а) 6,02•1025 молекулы; б) 3,01•1020 атома? Ответ: А) 100 моль, Б) 0,005 моль
15. Рассчитайте массу атома: а) магния; б) хлора; в) железа; г) азота. Ответ: А) 3,9•10-23, Б) 5,9•10-23, В) 9,3•10-23, Г) 2,32•10-23
16. Вычислите массу молекулы: а) оксида железа(III); б) гидроксида натрия; в) угольной кислоты; г) сульфата калия. Ответ: А) 2,65•10-22, Б) 6,64•10-23, В) 1,03•10-24, Г) 2,89•10-22
ЗАНЯТИЕ 2
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Самостоятельная работа (написание электронных, электронно-графических формул)
4. Тестовый контроль
5. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
1). Главное квантовое число (n) – характеризует энергию электрона. Это число равно любому положительному значению n = 1,2,3… 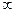 . При n = 1, электрон находится в самом низком энергетическом состоянии. С увеличением n энергия электрона возрастает, одновременно происходит удаление частицы от ядра. Т.е. наряду с энергией главное квантовое число характеризует орбитальный радиус. При
. При n = 1, электрон находится в самом низком энергетическом состоянии. С увеличением n энергия электрона возрастает, одновременно происходит удаление частицы от ядра. Т.е. наряду с энергией главное квантовое число характеризует орбитальный радиус. При 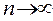 , энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома. Минимальная энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Эта величина характеризует электроотрицательность атома. Энергия ионизации уменьшается с возрастанием главного квантового числа и орбитального радиуса.
, энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома. Минимальная энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Эта величина характеризует электроотрицательность атома. Энергия ионизации уменьшается с возрастанием главного квантового числа и орбитального радиуса.
2). Орбитальное квантовое число (l) (побочное) – определяет форму атомных орбиталей, а также энергетические (орбитальные) подуровни главного энергетического уровня при данном n (главном квантовом числе). Орбитальное квантовое число l = 0,1,2…(n-1). Для каждого n орбитальное число принимает значение между 0 и (n -1).
При l = 0 – форма орбитали сферическая и называется s – орбиталью
При l = 1 – имеет форму гантели и называется р – орбиталью
При l = 2 – форма орбитали четырехлопастная и называется d – орбиталью
При l = 3 – форма орбитали шестилепестковая и называется f – орбиталью
| Главное квантовое число | Орбиталь | Обозначение орбитали |
| n | n- 1 | |
| 1 | 0 | s |
| 2 | 0,1 | s, р |
| 3 | 0,1,2 | s, р, d |
Для обозначения состояния электрона, главное квантовое число ставят перед символом побочного (орбитального) квантового числа. Например: 4s обозначает n=4; l = 0; 2р обозначает n=2; l = 1.
3) Магнитное (азимутное) квантовое число (ml) – характеризует направление (ориентацию) электронной орбитали (связанного с ним магнитного момента), а также число атомных орбиталей на энергетическом подуровне.
Магнитное квантовое число равно значению от – l до + l, включая 0, оно показывает число атомных орбиталей в данном подуровне, т.е. всего 2l + 1. Например:
S – подуровень, где l = 0, ml = 1, содержит 1 S – орбиталь;
р – подуровень, где l = 1, ml = -1,0,+1, содержит 3р-орбитали, ориентрированные в пространстве по координатным осям x,y,z;
d - подуровень; l = 2, ml = -2,-1,0,+1,+2, содержит 5 d - орбиталей, симметрично ориентированных в пространстве
f – подуровень, где l = 3, ml = -3,-2,-1,0,+1,+2,+3, содержит (7) 7 f – орбиталей разных симметричных ориентации.
Таким образом, с помощью 3 квантовых чисел n, l, ml полностью описывается движение электрона вокруг ядра.
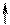
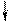
 4) Спиновое квантовое число – характеризует собственное вращательное движение электрона имеет значение
4) Спиновое квантовое число – характеризует собственное вращательное движение электрона имеет значение 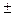 1/2, которое отвечает вращение по часовой и против часовой стрелки. Это вращение описывается понятием "спин". Его обозначают
1/2, которое отвечает вращение по часовой и против часовой стрелки. Это вращение описывается понятием "спин". Его обозначают 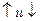 . Электроны, находящиеся на одной орбитали, обладают противоположными спинами
. Электроны, находящиеся на одной орбитали, обладают противоположными спинами 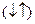 , называются спаренными .
, называются спаренными .
Таким образом, состояние электрона в атоме полностью описывается с помощью 4-х квантовых чисел. Они характеризуют спин, энергию, объем, форму пространства, в котором вероятно пребывание электрона около ядра. При переходе атома из одного состояния в другое меняется квантовое число и перестраиваются электронные облака.
Дальнейшее изучение сложных атомов позволило понять основные принципы заполнения атомных орбиталей.
ЗАДАНИЯ В ТЕСТОВОЙ ФОРМЕ
Инструкция: укажите один или несколько вариантов правильных ответов
1. Число каких элементарных частиц является определяющим для понятия «химический элемент»
1) протоны
2) нейтроны
3) электроны
2. Число каких элементарных частиц является определяющим для понятия «изотоп»
1) протоны
2) нейтроны
3) электроны
3. Число каких элементарных частиц является определяющим для понятия «ион»
1) протоны
2) нейтроны
3) электроны
4. Ядро атома криптона 8036 Kr содержит
1) 80 р и 36 n
2) 36 p и 44 n
3) 36 р и 44 e
5. Какая частица имеет большее число протонов, чем электронов
1) атом натрия
2) ион натрия
3) сульфит-ион
6. Ион, имеющий в своем составе 18 электронов и 16 протонов, имеет заряд, равный
1) -18
2) -2
3) +8
7. Максимальное число электронов, которое могут занимать 3 s -орбиталь, равно
1) 1
2) 2
3) 8
8. Максимальное число электронов, которое могут занимать 2 р-орбиталь, равно
1) 3
2) 6
3) 8
9. Какие из перечисленных обозначений орбиталей не верны
1) 2s, 4p
2) 2p, 3d
3) 1p, 2d
10. Какие из перечисленных обозначений не верны
1) 2s3 2d1
2) 2s2 2p3
3) 3d5 4s1
11. Атом какого элемента имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s1
1) Na
2) K
3) Ca
12. Электронная формула иона Zn 2+ соответствует формуле
1) 1s2 2s2 2p6 3s2 3p6 3d10
2) 1s2 2s2 2p6 3s2 3p6 3d8 4s2
3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
13. Сколько неспаренных электронов имеет ион Со3+
1) 3
2) 4
3) 5
14. Три частицы: Ne 0 , Na + и F - имеют одинаковое
1) число нейтронов
2) число электронов
3) массовые числа.
15. Восемь электронов на внешней электронной оболочке имеет
1) Si
2) O2-
3) Fe2+.
16. «Проскок» электрона наблюдается в электронной формуле атома
1) 22Ti
2) 11Na
3) 29Cu.
17. С учетом возможных возбужденных состояний, атомы серы могут проявлять валентности, равные
1) II, IV, VI
2) I, III, V
3) I, II, III, IV, V, VI.
Задания для самостоятельного решения
1. Составьте электронную формулу атома железа 26Fe.
2. Составьте электронную формулу атома мышьяка 33As.
3. Составьте электронную формулу атома марганца 25Mn.
4. Составьте электронную формулу атома брома 35Br.
5. Составьте электронную формулу атома скандия 21Sc.
6. Составьте электронную формулу атома германия 32Ge.
7. Какому элементу соответствует приведенный фрагмент электронной формулы …4s24p5? Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
8. Какому элементу соответствует приведенный фрагмент электронной формулы …3р63d24s2? Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
9. Какому элементу соответствует приведенный фрагмент электронной формулы …4s24p4? Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
10. Какому элементу соответствует приведенный фрагмент электронной формулы …3d34s2? Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
11. Какому элементу соответствует приведенный фрагмент электронной формулы …3d64s2? Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента?
12. Какому элементу соответствует приведенный фрагмент электронной формулы …3d84s2? Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
ЗАНЯТИЕ 3
Д.И. Менделеева
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Тестовый контроль
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ЗАНЯТИЕ 4
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Тестовый контроль
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ЗАНЯТИЕ 5
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ЗАНЯТИЕ 6
План занятия
1. Проверка посещаемости и информация.
2. Контрольная работа по теме «Химическая связь».
3. Подведение итогов занятия.
Пример контрольной работы
1. Составьте электронную формулу атома скандия.
2. Какому элементу соответствует приведенный фрагмент электронной формулы … 3d64s2. Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
3. Дайте определение следующим понятиям: энергия сродства к электрону, насыщаемость ковалентной связи.
4. В рамках метода валентных связей составьте схему образования молекулы хлора.
5. В рамках метода молекулярных орбиталей составьте энергетическую диаграмму атомных и молекулярных орбиталей.
ЗАНЯТИЕ 7
Комплексные соединения
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Основные положения координационной теории:
1. В большинстве к.с. различают внутреннюю и внешнюю сферы.
2. Во внутренней сфере центральное место занимает комплексообразователь - чаще всего катион металла, реже - анион или какой-либо нейтральный атом (акцептор электронных пар).
3. Комплексообразователь окружен лигандами (аддендами) - противоположно заряженными ионами или нейтральными молекулами (донорами электронных пар).
4. Число свободных орбиталей, предоставляемых комплексообразователем для неподеленных электронных пар лигандов, называется координационным числом (к.ч.) комплексообразователя.
5. Комплексообразователь и лиганды образуют внутреннюю, т.н. координационную, сферу к.с. В формулах внутренняя сфера заключается в квадратные скобки.
6. Заряд внутренней сферы к.с. равен алгебраической сумме зарядов всех частиц, образующих внутреннюю сферу к.с.
7. Ионы, не разместившиеся во внутренней сфере к.с. образует внешнюю сферу. Суммарный заряд ионов внешней сферы нейтрализует заряд внутренней сферы к.с.
K 3[Fe(CN)6] - красная кровяная соль

CN- CN-
K+ CN- лиганды
K+
Fe3- комплексообразователь
K+ CN-
CN- CN-
внешняя сфера внутренняя сфера
к.ч. ( Fe 3- ) = 6
[Fe +3 ( C N -1 )6]x
x = (+3) + 6(-1)
x = -3
Эталоны решения задач
Пример 1. Чему равно координационное число и степень окисления комплексообразователя, заряд комплексного иона в соединениях: [Zn(NH3)2]Cl2, K4[Pb(S2O3)3], K2[HgBr4]?
Решение.
[Zn(NH3)2]Cl2 - к.ч. 2, +2, +2
K4[Pb(S2O3)3] - к.ч. 3, +2, - 4
K2[HgBr4] – к.ч. 4, +2, - 2
Пример 2. Какое из двух комплексных соединений характеризуется максимальной устойчивостью, если их константы нестойкости равны: а) 10-7, б) 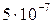 ?
?
Решение:
Чем меньше константа нестойкости, тем более устойчиво комплексное соединение.
10-7 < 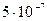 , значит, более устойчиво комплексное соединение а).
, значит, более устойчиво комплексное соединение а).
Пример 3. Раствор какого из комплексных соединений будет иметь большее осмотическое давление при равных значениях молярной концентрации:
а) [Ag(NH3)2]Cl; б) K2[Cu(CN)4] ?
Решение:
При одинаковой молярной концентрации большее осмотическое давление будет у раствора того вещества, которое при диссоциации дает большее число ионов.
 [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (2 иона из одной молекулы)
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (2 иона из одной молекулы)
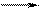 K2[Cu(CN)4] 2K+ + [Cu(CN)4]2- (3 иона из одной молекулы)
K2[Cu(CN)4] 2K+ + [Cu(CN)4]2- (3 иона из одной молекулы)
Поэтому, большее осмотическое давление будет у раствора б).
Контрольные вопросы и задания
1. Дайте понятие комплексного соединения (КС).
2. Перечислите основные положения теории Вернера:
- внешняя и внутренняя сфера,
- комплексообразователь,
- лиганды,
- координационное число центрального атома.
3. Что относится к моно-, би- и полидентатные лиганды?
4. Какова природа химической связи в КС?
5. Охарактеризуйте устойчивость КС (константы нестойкости комплексов и устойчивости).
6. Какие лиганды и комплексообразователи относят к жестким и мягким?
7. Какова способность атомов различных элементов к комплексообразованию?
8. Приведите классификацию КС.
9. Как образюется КС и каковы их химические свойства?
10. Охарактеризуйте биологическую роль и применение КС.
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 119 – 132 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 649 – 681 с.
2. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 107 – 111 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 33 – 40 с.
ЗАДАНИЯ В ТЕСТОВОЙ ФОРМЕ
Инструкция: Укажите один или несколько вариантов правильных ответов
1. Координационное число комплексообразователя в соединении [ Co ( NH 3 )6] Cl 3 равно(1):
1) 3
2) 4
3) 5
4) 6
2. Координационное число комплексообразователя в соединении [ Ni ( H 2 O )4] Cl 2 равно(1):
1) 2
2) 3
3) 4
4) 5
3. Координационное число комплексообразователя в соединении [ Ag ( NH 3 )2] Cl равно(1):
1) 2
2) 3
3) 4
4) 5
4. Координационное число комплексообразователя в соединении K 2 [ C о( C 2 O 4 )2] равно(1):
1) 2
2) 3
3) 4
4) 5
5. Координационное число комплексообразователя в соединении K 3 [ Al ( C 2 O 4 )3] равно(1):
1) 3
2) 4
3) 5
4) 6
6. Координационное число комплексообразователя в соединении K 3 [ Fe ( CN )5( NH 3 )] равно(1):
1) 3
2) 4
3) 5
4) 6
7. Степень окисления комплексообразователя в комплексной соли [ Pt ( NH 3 )3 Cl ] Cl равна(1):
1) +1
2) +2
3) +3
4) +4
8. Степень окисления комплексообразователя в комплексной соли K 2 [ PbJ 4 ] равна(1):
1) -1
2) 0
3) +1
4) +2
9. Степень окисления комплексообразователя в комплексной соли Na 3 [ C о( NO 2 )6] равна(1):
1) -3
2) 0
3) +2
4) +3
10. Степень окисления комплексообразователя в комплексной соли [ Co ( NH 3 )5( NO 2 )] Cl 2 равна(1):
1) 0
2) +1
3) +2
4) +3
11. Степень окисления комплексообразователя в комплексной соли K [ J ( J 2 )2] равна(1):
1) -1
2) 0
3) +1
4) +2
12. Степень окисления комплексообразователя в комплексной соли K 3 [ Fe ( CN )5( NH 3 )] равна(1):
1) -1
2) 0
3) +1
4) +2
13. Напишите уравнение реакции первичной диссоциации комплексной соли Na 3 [ C о( NO 2 )6]. При диссоциации формульной единицы должны образовываться анионы в количестве равном(1):
1) 1
2) 3
3) 6
4) 7
14. Напишите уравнение реакции первичной диссоциации комплексной соли [ Co ( NH 3 )6] Cl 3 . При диссоциации формульной единицы должны образовываться анионы в количестве равном(1):
1) 1
2) 2
3) 3
4) 6
15. Напишите уравнение реакции первичной диссоциации комплексной соли K 4 [ Fe ( CN )6]. При диссоциации формульной единицы должны образовываться анионы в количестве равном(1):
1) 1
2) 4
3) 6
4) 10
16. Напишите уравнение реакции первичной диссоциации комплексной соли K 4 [ Pb ( S 2 O 3 )3]. При диссоциации формульной единицы должны образовываться анионы в количестве равном (1):
1) 8
2) 6
3) 4
4) 1
17. Напишите уравнение реакции первичной диссоциации комплексной соли [ Zn ( NH 3 )4] Cl 2 . При диссоциации формульной единицы должны образовываться анионы в количестве равном (1):
1) 7
2) 6
3) 4
4) 2
18. Напишите уравнение реакции первичной диссоциации комплексной соли [ Co ( NH 3 )4] Cl 2 . При диссоциации формульной единицы должны образовываться анионы в количестве равном (1):
1) 1
2) 2
3) 4
4) 6
19. Напишите уравнение реакции вторичной диссоциации соли [ Cu ( NH 3 )4] Cl 2 и укажите выражение константы устойчивости комплексного иона(1):
1) 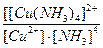
2) 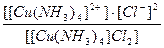
3) 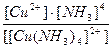
20. Напишите уравнение реакции вторичной диссоциации соли K 2 [ HgBr 4 ] и укажите выражение константы нестойкости комплексного иона(1):
1) 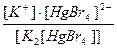
2) 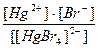
3) 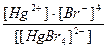
21. Напишите уравнение реакции вторичной диссоциации соли [ Cu ( NH 3 )4] SO 4 и укажите выражение константы нестойкости комплексного иона(1):
1) 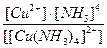
2) 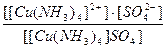
3) 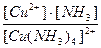
22. Напишите уравнение реакции вторичной диссоциации соли K 3 [ Fe ( CN )6] и укажите выражение константы устойчивости комплексного иона(1):
1) 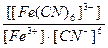
2) 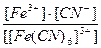
3) 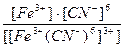
23. Напишите уравнение реакции вторичной диссоциации соли K 4 [ Fe ( CN )6] и укажите выражение константы нестойкости комплексной частицы(1):
1) 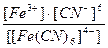
2) 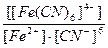
3) 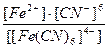
24. Напишите уравнение реакции вторичной диссоциации соли Na [ Au ( CNS )4] и укажите выражение константы нестойкости комплексной частицы(1):
1) 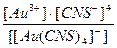
2) 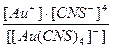
3) 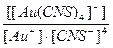
25. Из пяти комплексных соединений наименее устойчиво то, у которого константа устойчивости ( 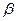 ) равна(1):
) равна(1):
1) 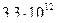
2) 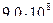
3) 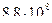
4) 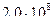
26. Из пяти комплексных соединений максимальной устойчивостью внутренней сферы обладает то, у которого константа устойчивости 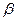 равна(1):
равна(1):
1) 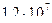
2) 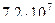
3) 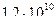
4) 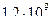
27. Из пяти комплексных соединений наименьшей устойчивостью характеризуется, то у которого константа устойчивости ( 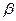 ) равна(1):
) равна(1):
1) 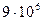
2) 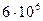
3) 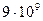
4) 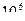
28. Из пяти комплексных соединений наименее устойчиво, то у которого константа нестойкости КН равна(1):
1) 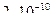
2) 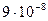
3) 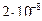
4) 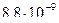
29. Из пяти комплексных соединений наиболее устойчиво, то у которого константа нестойкости КН равна(1):
1) 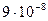
2) 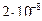
3) 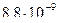
4) 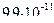
30. Максимально возможная дентатность аминокислоты глицина
H 2 N - CH 2 - COOH в качестве лиганда равна(1):
1) 1
2) 2
3) 3
4) 4
31. 







 Максимальная дентатность ЭДТА равна(1):
Максимальная дентатность ЭДТА равна(1):
HOOC CН2 N CH2 CH2 N CH2 COOH

 HOOC CH2 CH2 COOH
HOOC CH2 CH2 COOH
1) 3
2) 4
3) 5
4) 6
32. Максимальная дентатность аминокислоты лизина


 H2N CH COOH в качестве лиганда равна(1):
H2N CH COOH в качестве лиганда равна(1):
 (CH2)4
(CH2)4
NH2
1) 1
2) 2
3) 3
4) 4
33.  Определите максимально возможную дентатность аспарагиновой кислоты в качестве лиганда HOOC― CH ―CH2 ―COOH (1):
Определите максимально возможную дентатность аспарагиновой кислоты в качестве лиганда HOOC― CH ―CH2 ―COOH (1):
NH2
1) 1
2) 2
3) 3
4) 4
34. Максимальная дентатность аминокислоты аланина


 H2N CH COOH в качестве лиганда равна(1):
H2N CH COOH в качестве лиганда равна(1):
CH3
1) 1
2) 2
3) 3
5) 4
35. Максимальная дентатность аминокислоты цистеина


 H2N CH COOH в качестве лиганда равна(1):
H2N CH COOH в качестве лиганда равна(1):
 CH2
CH2
SH
1) 1
2) 2
3) 3
4) 4
36. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Ca2+, NH3
2) Ca2+, H2O
3) Cu2+, H2O
4) Cu2+, NH3
37. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Mg2+, NH3
2) Al3+, NH3
3) Pt4+, NH3
4) Pt4+, NO3-
38. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Pb2+, OH-
2) Pb4+, NO3-
3) Zn2+, OH-
4) Zn2+, CN-
39. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Cu2+, CH3 - NH2
2) Cu2+, Cl-
3) Cu2+, H2O
4) Al3+, NH3
40. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц(1):
1) Na+, NH3
2) Li+, CN-
3) Ca2+, H2O
4) Co2+, NH3
41. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Hg2+, J-
2) Hg2+, NO3
3) Hg2+, Cl-
4) Cd2+, H2O
42. Процесс умягчения воды с помощью трилона Б описывают уравнения(2):
1) 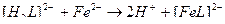
2) 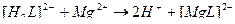
3) 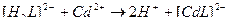
4) 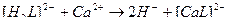
43. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах следующих веществ(2):
1) 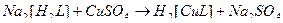
2) 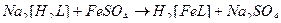
3) 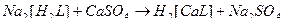
4) 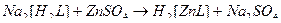
44. Наиболее устойчивые комплексные ионы образуются в результате процессов проходящих в водных растворах(2):
1) 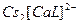 ↔
↔ 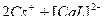
2) 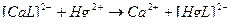
3) 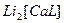 ↔
↔ 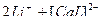


4) 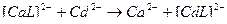
45. Наиболее устойчивые комплексные ионы образуются в результате процессов проходящих в водных растворах(2):
1) 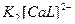 ↔
↔ 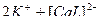
2) 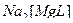 ↔
↔ 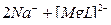


3) 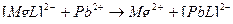


4) 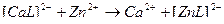
46. Высокая токсичность цианидов для человека и животных объясняется(2):
1) их хорошей растворимостью в биологических жидкостях
2) малой распространенностью в живой природе
3) способностью вытеснять из комплексных соединений более жесткие лиганды
4) ингибированием фермента цитохромоксидазы
47. В состав комплексных соединений хелатного типа могут входить лиганды(2):
1) СО-
2) NH2 – CH2 – COOH
3) NH3
4) NH2 – CH2 – CH2 – CH2 – NH2
48. Токсичность угарного газа для организма человека и животных можно объяснить тем, что СО(1):
1) образует с атомами металлов нейтральные комплексы
2) практически нерастворим в H2O
3) способен взаимодействовать с О2
4) образует с гемоглобином комплекс на 2 порядка более устойчивый по сравнению с оксигемоглобином
49. Токсическое действие нитратов на организмы человека и животных можно объяснить тем, что под их воздействием(1):
1) происходит окисление белка глобина
2) разрушается железо – порфириновый комплекс
3) изменяется координационное число катиона железа
4) гемоглобин превращается в метгемоглобин
50. В состав зеленого пигмента растений хлорофилла входит(1):
1) свободный катион Fe2+
2) свободный катион Mg2+
3) железо – порфириновый комплекс
4) магний – порфириновый комплекс
51. В состав дыхательных ферментов цитохромоксидаз входят комплексы, содержащие(1):
1) Fe3+, Cu2+
2) Co3+, Fe2+
3) Mg2+, Zn2+
4) Fe3+, Pb2+
52. Сложный белок метгемоглобин(3):
1) не способен к переносу к О2
2) взаимодействует с СО2
3) образуется из гемоглобина при окислении Fe2+ в составе гема до Fe3+
4) в норме в организме отсутствует
53. Сложный белок крови гемоглобин(2):
1) содержит магний – порфириновый комплекс
2) содержит в составе железо – порфиринового комплекса Fe2+
3) содержит в составе железо – порфиринового комплекса Fe3+
4) в капиллярах легких превращается в оксигемоглобин
ЗАНЯТИЕ 8
Комплексные соединения
План занятия
1. Проверка посещаемости и информация
2. Контрольная работа по теме «Комплексные соединения»
3. Лабораторная работа 1. «Комплексные соединения и их свойства»
4. Подведение итогов занятия
Пример контрольной работы
1. Координационное число комплексообразователя в соединении [ Ni ( H 2 O )4] Cl 2 равно
1) 2
2) 3
3) 4
4) 5
2. Степень окисления комплексообразователя в комплексной соли K [ J ( J 2 )2] равна
1) -1
2) 0
3) +1
4) +2
3. Напишите уравнение реакции первичной диссоциации комплексной соли K 4 [ Fe ( CN )6]. При диссоциации формульной единицы должны образовываться анионы в количестве равном
1) 1
2) 4
3) 6
4) 10
II . Учение о растворах
ЗАНЯТИЕ 9 - 10
Растворы. Концентрация растворов. Массовая доля. Молярная концентрация.
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Лабораторная работа 2 “Приготовление растворов заданной концентрации”
5. Контрольная работа
6. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Раствор – устойчивая гомогенная система переменного состава, состоящая из двух и более компонентов, между которыми существуют достаточно сильные взаимодействия.
Концентрация – важнейшая характеристика раствора. Она определяет содержание вещества в растворе. В зависимости от возможных вариантов выражения содержания вещества различают массовый и объемный способы выражения концентрации. К массовому способу относят массовую долю, а к объемному – молярную концентрацию и молярную концентрацию эквивалента.
Массовая доля ω(Х) – это отношение массы растворенного вещества к массе раствора:
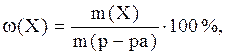
где Х – растворенное вещество;
ω(Х) – массовая доля вещества Х в растворе (массовая доля – величина безразмерная, выражается в долях от единицы или в процентах);
m(Х) – масса вещества, г;
m(р-ра) – масса раствора, г;
масса раствора связана с объемом следующим образом
m(р-ра)=V.ρ
где V – объем раствора, мл,
ρ – плотность раствора, г/мл.
m(р-ра)=m(Х)+m (H2O)
Пример 1. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4 . 7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение.
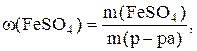
Определяем m (р-ра):
m(р-ра)=m(FeSO4.7H2O)+m(H2O)=41,7+258,3=300г.
Определяем массу FeSO4:
m(FeSO4)=n(FeSO4).M(FeSO4),
а поскольку n(FeSO4)=n(FeSO4.7H2O), то
m(FeSO4)=n(FeSO4.7H2O).M(FeSO4)= 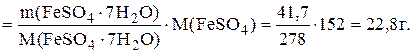
Вычисляем ω(FeSO4):
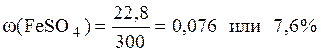
Ответ: ω(FeSO4)=0,076 или 7,6%.
ЗАНЯТИЕ 11
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Закон эквивалентов
Химический эквивалент – весовое количество химического элемента, сочетающееся с 1 весовой частью водорода или заменяющее 1 весовую часть водорода в соединениях.
Первоначальная формулировка закона – химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
Современная формулировка закона эквивалентов состоит из двух частей:
1. количества вещества эквивалентов элементов, образующих химическое соединение, равны;
2. количества вещества эквивалентов всех участвующих в реакции веществ равны.
Количество вещества эквивалента – это условная структурная единица которой является эквивалент.
Количества вещества эквивалента обозначается – n(1/zX), где Х – вещество Х, 1/z – фактор эквивалентности вещества Х.
Величина z фактора эквивалентности кислот в предельном случае определяется числом атомов водорода, которые могут быть замещены в молекуле кислот.
Пример 1. Определить факторы эквивалентности для кислот: а) HCl, б) H2SO4, в) H3PO4.
Решение.
а) z=1, фактор эквивалентности – 1; б) z=2, фактор эквивалентности – 1/2; в) z=3, фактор эквивалентности – 1/3.
В случае многоосновных кислот фактор эквивалентности зависит от конкретной реакции:
а) H2SO4+2КОН= К2SO4+2Н2О.
В этой реакции в молекуле серной кислоты замещается два атома водорода, следовательно, z=2, фактор эквивалентности – 1/2.
б) H2SO4+КОН= КНSO4+Н2О.
В этом случаи в молекуле серной кислоты замещается один атом водорода, следовательно, z=1, фактор эквивалентности – 1.
Для фосфорной кислоты, в зависимости от реакции, значения факторов эквивалентности могут быть: 1, 1/2, 1/3.
Величина z фактора эквивалентности оснований определяется в предельном случае числом гидроксильных групп.
Пример 2. Определить факторы эквивалентности оснований: а) КОH, б) Cu(ОH)2, в) Al(ОH)3.
Решение.
а) z=1, фактор эквивалентности – 1; б) z=2, фактор эквивалентности – 1/2; в) z=3, фактор эквивалентности – 1/3.
Фактор эквивалентности многокислотных оснований может изменяться в зависимости от количества замещаемых групп.
Ответ: КОH=1, Cu(ОH)2=1/2, Al(ОH)3=1/3.
Значения факторов эквивалентности солей определяются по катиону. Величина z в случае солей равна q∙n, где q – заряд катиона металла, n – число катионов в формуле соли.
Пример 3. Определить фактор эквивалентности солей: а) КNO3, б) Na3PO4, в) Cr2(SО4)3.
Решение.
а) z=q∙n=1∙1, фактор эквивалентности – 1;
б) z=1∙3=3, фактор эквивалентности – 1/3;
в) z=3∙2=6, фактор эквивалентности – 1/6.
Ответ: КNO3=1, Na3PO4=1/3, Cr2(SО4)3=1/6.
Определение значений факторов эквивалентности для других классов соединений сложнее, чем для кислот, оснований, солей. В этих случаях для нахождения факторов эквивалентности используют положения закона эквивалентов о равенстве количеств веществ эквивалентов реагентов и продуктов реакции.
Для определения факторов эквивалентности оксидов можно использовать их реакции с водой, кислотами, основаниями.
Пример 4. Определить фактор эквивалентности оксидов: а) К2О, б) SO3, в) P2O5.
Решение.
а) К2О+Н2О=2КОН
Из уравнения реакции видно, что из одного моль К2О образовалось 2 моль эквивалентов КОН. Следовательно, фактор эквивалентности равен ½.
б) SO3+Н2О= H2SO4
Из одного моль SO3 образовалось 2 моль эквивалентов кислоты. Фактор эквивалентности – ½.
в) P2O5+3Н2О=2H3PO4
Из одного моль P2O5 образовалось 6 моль эквивалентов фосфорной кислоты. Фактор эквивалентности оксида – 1/6.
Ответ: К2О=½, SO3=½, P2O5=1/6.
ЗАНЯТИЕ 12
План занятия
1. Проверка посещаемости и информация
2. Контрольная работа по теме “Молярная концентрация эквивалента”
3. Устный опрос и коррекция знаний
4. Самостоятельная работа по написанию уравнений ступенчатой диссоциации кислот, солей и оснований.
5. Лабораторная работа 3 «Растворы электролитов и ионные равновесия»
6. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Закон разбавления Освальда
Существует взаимосвязь между константой К и степенью ионизации слабых электролитов α:
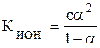
Для слабых электролитов α – величина малая, поэтому выражение
(1–α)→1,
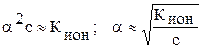
Зная Кион, легко вычислить концентрацию ионов, степень ионизации электролита и наоборот.
Пример 1. Вычислить концентрацию ионов Н+ и СN- – в 0,1м растворе, если КHCN = 7,2∙10-10.
Решение.
1) В водном растворе синильная кислота распадается на ионы:
HCN↔H+ + CN-
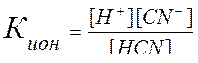
2) Обозначим концентрацию ионов через x, тогда [Н+]=[СN-]=х, а концентрация неионизированных молекул [CHN]=с–х:
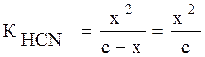
так как с–х→с,
х=[Н+]=[СN-]= 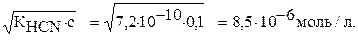
Ответ: концентрация ионов [Н+]=[СN-]=8,5∙10-6моль/л.
Пример 2. Вычислить степень ионизации 0,1 М раствора HCN, если
КHCN = 7,2 •10-10.
Решение.
1) Степень ионизации рассчитаем по формуле:
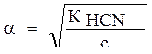
2) Подставим значения:
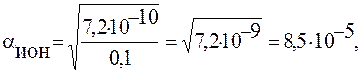
или 8,5∙10-5∙102 = 0,0085%.
Этот пример можно решить и по-другому. Если известна концентрация ионов (см. пример выше), то α можно вычислить так:
с α = [Н+] = [СN-] = 8,5∙10-6 моль/л.
Тогда
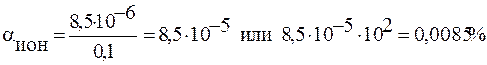
Ответ: αион(HCN)=0,0085%.
Пример 3. Степень ионизации 0,1м раствора гидроксида аммония равна 1,33%. Вычислить концентрацию ионов ОН- и константу ионизации.
Решение.
1) В водном растворе NH4OH распадается на ионы:
NH4OH↔NH4++OH-.
2) Степень ионизации α рассчитываем:
α = сион/собщ;
подставим числовые значения:
1,33∙10-2 = сион/0,1
[ОН-] = сион = 1,33∙10-3 моль/л.
3) Подставляя в выражение Кион
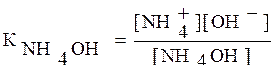
числовые значения, получаем:
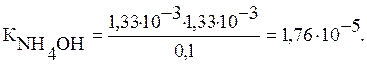
Ответ: Кион=1,76∙10-5.
Пример 4. Во сколько раз изменится концентрация ионов водорода [Н+], если к 1л 0,1н раствора муравьиной кислоты НСООН добавить 0,1м формиата натрия НСООNa (учитывая, что степень ионизации формиата при таком разбавлении близка к 100%)?
Решение.
1) Определяем концентрацию ионов водорода в 0,1м растворе муравьиной кислоты до прибавления соли:
НСООН↔НСОО- + Н+
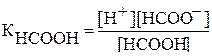
Концентрация ионов водорода может быть вычислена по формуле:
[Н+] = 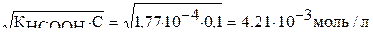
2) Рассчитываем концентрацию ионов водорода после добавления соли.
Обозначим концентрацию ионов водорода через х, тогда концентрация формиат-ионов будет равна (х+0,1), а неионизированных молекул муравьиной кислоты (0,1–х).
Подставляем значения в формулу КНСООН:
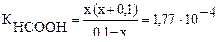
асчет можно упростить, принимая во внимание, что значение х по сравнению с 0,1 мало и им можно пренебречь.
Тогда получим:
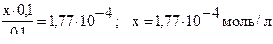
3) Рассчитываем, во сколько раз изменилась концентрация ионов Н+:
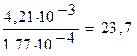
Ответ: концентрация ионов Н+ уменьшилась в 23,7 раза.
Контрольные вопросы и задания
1. Что такое растворы? Характеристика составных частей растворов?
2. Каков механизм образования растворов?
а)отделение молекул от поверхностей
б)диффузия молекул
в)образование сольватов
3. Электролиты и неэлектролиты. Определение и примеры.
4. Что такое электролитическая диссоциация?
5. Степень электролитической диссоциации; факторы, влияющие на степень диссоциации. Сильные, средние и слабые электролиты. Определение и примеры.
6. Опишите равновесие в растворах слабых электролитов. Формулы константы диссоциации слабой кислоты и слабого основания(константа кислотности, константа основности). Факторы, влияющие на величину константы диссоциации.
7. Покажите связь между константой диссоциации и степенью диссоциации (закон разбавления Освальда).
8. Охарактеризуйте ступенчатый характер ионизации.
9. Перечислите теории кислот и оснований:
а)теория Аррениуса
б)теория Бренстеда и Лоури
в)теория Льюиса
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 83 – 88 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 255 – 257 с.
2. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 41 – 53 с.
Задания для самостоятельного решения
1. Определить константу ионизации уксусной кислоты СН3СООН, если степень ионизации 0,12м. раствора ее равна 1,21%.
Ответ: 1,75·10-5.
2. Определить степень ионизации азотистой кислоты НNО2, если концентрация раствора ее 0,12м. и Кион = 6,90·10-4.
Ответ: 7,6%.
3. Определить степень ионизации (αион) гидроксида аммония, если концентрация раствора равна 0,1м, Кион = 1,74·10-5
Ответ: 1,33%.
4. Концентрация ионов водорода [Н+] и ацетат-ионов [СН3СОО-] равна 0,00132 моль/л. Вычислить константу ионизации, если раствор 0,1м.
Ответ: 1,74·10-5.
5. Степень ионизации (αион) 0,14м. раствора муравьиной кислоты НСООН равна 4,24%. Вычислить константу ионизации этой кислоты.
Ответ: 2,6·10-4.
6. Определить константу ионизации уксусной кислоты СН3СООН, если степень ионизации ее в 0,2м. растворе равна 0,932%.
Ответ: 1,74·10-5.
7. Чему равна концентрация ацетат-ионов [СН3СОО-] в 0,001м. растворе уксусной кислоты, Кион = 1,74·10-5 ,если степень ионизации равна 13,2%?
Ответ: 1,32·10-4моль/л.
8. Вычислить степень и константу ионизации 1,028м. водного раствора гидроксида аммония NH4OH. Концентрация ионов гидроксида [ОН-] в нем равна 0,00426моль/л.
Ответ: 0,00413 или 0,413%, К=1,76·10-5
9. Определить и сопоставить концентрации ионов водорода [Н+] в растворах 0,1м. НСl и 0,1м. уксусной кислоты, Кион укс = 1,74·10-5 , Кион HCl= 1·107
Ответ: 0,1моль/л; 1,32·10-3моль/л.
10. Вычислить концентрацию ионов водорода [Н+] 6%-ного раствора хлороводородной кислоты, r=0,8г/мл.
Ответ: 1,32моль/л.
11. Какова концентрация гидроксид-иона [ОН-] в 5%-ном растворе уксусной кислоты, Кион = 1,74·10-5, r=1г/мл?
Ответ: 2,66·10-12моль/л.
12. Определить концентрацию ионов водорода [Н+] в 0,2м. растворе муравьиной кислоты НСООН, если αион = 3%.
Ответ: 6·10-3моль/л.
13. Константа ионизации уксусной кислоты равна 1,74·10-5, степень ионизации равна 1,36%. Вычислить молярную концентрацию.
Ответ: ~ 0,1м.
14. Определить концентрацию ионов водорода [Н+] в 0,012м. растворе бензойной кислоты (Кион С6Н5СООН = 6,3·10-5).
Ответ: ~ 8,7·10-4моль/л.
15. Вычислить концентрацию ацетат-ионов [СН3СОО-] в 0,001м. растворе уксусной кислоты, Кион = 1,74·10-5
Ответ: 1,32·10-4моль/л.
16. Вычислить степень ионизации муравьиной кислоты в 0,48м. растворе ее, если [Н+] = 0,01моль/л.
Ответ: 0,02 или 2%.
17. Рассчитать, как изменится степень ионизации 0,2м. водного раствора уксусной кислоты, если его разбавить в 2 раза, Кион = 1,74·10-5
Ответ: увеличивается в 1,4 раза.
18. Вычислить, как изменится степень ионизации αион 0,15н. раствора муравьиной кислоты при разбавлении в 3 раза, Кион = 1,8·10-4
Ответ: увеличится в 1,73 раза.
19. 0,1м. раствор цианистоводородной кислоты разбавили в 10 раз. Как изменилась при этом степень ионизации? Кион = 7,9·10-10
Ответ: увеличится в 3,16 раза.
20. Вычислить степень ионизации 0,22н. раствора муравьиной кислоты, в 500мл которого растворили 3,4г формиата натрия НСООNa, Кион = 1,8·10-4
Ответ: 0,18%.
ЗАНЯТИЕ 13
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Написанию уравнений реакций гидролиза солей
4. Контрольная работа по теме «Гидролиз солей»
5. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Гидролиз солей
Гидролиз солей – это реакция обменного разложения солей водой, в результате которой из ионов растворенной соли и воды образуются молекулы слабых кислот или оснований (либо слабодиссоциирующие гидроанионы кислых солей или гидроксокатионы основных солей). Эта реакция на опыте подтверждается тем, что растворы средних солей имеют щелочную, кислую или нейтральную реакцию, хотя их формулы и не содержат ни ионов водорода, ни гидроксид ионов. Это объясняется взаимодействием соли с Н2О. Реакция гидролиза пишется иногда в молекулярной форме, а чаще в ионной.
Гидролиз солей происходит в 3-х следующих случаях.
1. Соль образована слабой кислотой и сильным основанием (Na2CO3).
2. Соль образована сильной кислотой и слабым основанием (AlCl3).
3. Соль образована слабой кислотой и слабым основанием (CH3COONH4).
Если соль образована сильной кислотой и сильным основанием (NaCl), то она гидролизу не подвергается. Ионы таких солей не могут образовывать с Н2О слабых электролитов.
КCl + Н2О → гидролиз не протекает, реакция среды нейтральная.
Правила:
1. Гидролиз – процесс обратимый.
2. Процесс ступенчатый (обычно пишут число ступеней гидролиза на одну ступень меньше, чем это возможно).
Na2CO3+Н2О↔NaHCO3+NaOH – молекулярное уравнение.
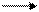

NaOH H2CO3
Na2CO3 ↔ 2Na+ + CO3-2
CO3-2 + Н2О ↔ HCO3- + OH- - среда щелочная.
Исключение – соли H2S, гидролиз этих солей идет по двум ступеням до конца.
MgCl2 + Н2О ↔ MgОНCl + НCl
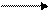

Mg(ОН)2 НCl
MgCl2 ↔ Mg+2 + 2Cl-
Mg+2 + Н2О ↔ MgОН+ + Н+ - среда кислая.
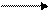
 СH3COONH4 + Н2О ↔ СH3COOH + NH4OH
СH3COONH4 + Н2О ↔ СH3COOH + NH4OH
СH3COOH NH4OH
СH3COO- + Н2О ↔ СH3COOH + OH-
NH4+ + Н2О ↔ NH4OH + Н+
Среда близка к нейтральной и значение рН зависит от степени диссоциации образующихся слабой кислоты и слабого основания.
Контрольные вопросы и задания
1. Дайте формулировку гидролиза солей. Какие виды гидролиза существуют?
2. Вывести константу гидролиза.
3. Показать зависимость гидролиза от внешних факторов.
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 88 – 92 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 87 – 88 с.
2. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 225 – 233 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 52 – 53 с.
Задания для самостоятельного решения
1. Какие из солей подвергаются гидролизу: MnSO4, Ca(NO3)2, Pb(CН3ОО)2, Li2S, Fe(NO3)2, BaCl2, CH3COOK, ZnCl2, K2SO4, NaAlO2, CuCl2, Al2(CO3)3? Напишите молекулярные и ионные уравнения гидролиза.
2. Какие вещества: H2SO4 или щелочь можно добавить к раствору MnSO4, чтобы увеличить степень гидролиза.
3. Какие вещества NaOH, HCl, LiOH можно добавить к раствору соли Li2S, чтобы степень гидролиза уменьшить.
4. В каких случаях при гидролизе солей образуется:
а) кислые соли
б) основные соли.
Приведите примеры.
5. Составьте молекулярное уравнение гидролиза соли, выражаемого следующим ионным уравнением: Cu2++ H2O↔СuOH+ + H+.
6. В каком растворе концентрация ОН- будет больше при растворении одинакового количества Na2CO3:
а) в горячей Н2О
б) в холодной горячей Н2О.
Пояснить.
7. Перечислите факторы, влияющие на гидролиз.
ЗАНЯТИЕ 14
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ЗАНЯТИЕ 15
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Лабораторной работы 3 «Расчет величины произведения растворимости слабых электролитов»
5. Контрольная работа на тему “ПР и рН”
6. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ЗАНЯТИЕ 16
Метод электронного баланса
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Самостоятельная работа по составлению уравнений окислительно-восстановительных реакций методами электронного баланса
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
И подбор коэффициентов
Для составления уравнений редокс-реакций используют различные приемы, но чаще всего применяют метод электронного баланса и метод ионно-электронный. По первому коэффициенты подбирают по изменению степени окисления атомов или ионов окислителя и восстановителя, а по второму подбор коэффициентов производят по стадиям. Сначала составляют общую схему реакции, затем пишут отдельные ионно-электронные полуредокс-уравнения, а затем суммируют их, подбирая наименьшее кратное от числа отдаваемых и принимаемых ионами электронов.
Метод электронного баланса
►Написать уравнение и подобрать коэффициенты в реакции, которая протекает при растворении меди Cu в азотной кислоте HNO3.
Решение.
1) Пишут общее уравнение редокс-реакции:
Cu+HNO3→Cu(NO3)2+NO+H2O
2) При составлении расчетного баланса уравнивают число отдаваемых и принимаемых электронов:
 Cu–2е→Cu+2 3
Cu–2е→Cu+2 3
N+5+3е→N+2 2
3) Найдя наименьшее кратное 6, проставляем коэффициенты в общее уравнение реакции:
3Cu+2HNO3→3Cu(NO3)2+2NO+H2O
Для окисления меди пошло две молекулы азотной кислоты, а для образования трех молекул нитрата меди Cu(NO3)2 – 6 молекул азотной кислоты. Всего потребуется 8 молекул азотной кислоты, а из этого числа молекул HNO3 образуются четыре молекулы воды, и окончательный вид уравнения будет такой:
3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O
Контрольные вопросы и задания
1. Окислительно-восстановительные реакции. Определение. Основные понятия:
- окисление,
- восстановление,
- окислитель (типичные окислители),
- восстановитель (типичные восстановители),
- сопряженная окислительно-восстановительная пара.
2. Приведите классификацию окислительно-восстановительных реакций:
- межмолекулярные,
- внутримолекулярные,
- диспропорционирования,
- коммутации.
3. Какие факторы влияют на протекание окислительно-восстановительных реакций (привести примеры реакций):
- концентрация реагента,
- температура реакции,
- наличие катализатора,
- рН среды.
4. Методы составления уравнений окислительно-восстановительных реакций:
- метод электронного баланса (примеры).
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 156 – 171 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 92 – 98 с.
2. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 234 – 245 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 57 – 70 с.
Задания для самостоятельного решения
1. Определите степень окисления выделенных элементов и укажите, какую роль могут выполнять данные частицы в ОВР (только окислителя, только восстановителя или двойной характер).
а) KNO2, Cr2О3, СаН2, НClO4, SO42-, NO3-;
б) KMnO4, NH3, H2O2, Al2(SO4)3, ClO2, SO32-;
в) HNO3, N2H4, C2H5OH, ZnCl2, ClO4, SbO33-;
г) H3PO4, Na3AsO3, SiO2,CH4, NaClO4, CrO2, PH3;
д) MnO2, N2O5, AsH3, Na3SbO4, KClO3, Zn(NO3)2, IO4-;
е) HIO4, Cl2O7, OF2, Na2SnO2, Al(NO3)3, SO32-, K2Cr2O7;
ж) Na2FeO4, HClO2, HCOH, CrO42-, NaBiO3, MnO2, SnO32-;
з ) O2, KClO4, C2H4, SO42-, F-, NiSO4, Fe3+, HClO, SbH3;
и) BiCl3, AgNO3, AuCl3, HgCl2, CrO33-, MnO4, Cr2O72-;
к) Na2SnO3, NO2, KBrO3, Br2, CO2, [Cr(OH)6]3-, ClO2, NO2-.
2. Указать окислитель и восстановитель, подобрать коэффициенты в следующих уравнениях:
а) CrCl3+H2O2+NaOH→Na2CrO4+…
б) KMnO4+H2O2+H2SO4→MnSO4+…
в) Na2O2+KJ+H2SO4→J2+…
г) Mo(NO3)3+Na2O2+NaOH→Na2MoO4+…
д) KMnO4+HCl(конц.)→Cl2+…
е) К2Cr2О7+HCl(конц.)→Cl2+…
3. Подобрать коэффициенты методом электронного баланса в реакциях диспропорционирования:
а) K2MnO4+H2О→KMnO4+MnO2+КOH
б) Se+КOH→K2SeO3+K2Se+H2О
в) КOH+Cl2→KClO3+KCl+H2О
г) Cl2+КOH(хол)→KCl+KClO+H2O
д) TiCl3→TiCl2+TiCl4
е) HNO2→HNO3+NO+H2O
4. Закончить уравнения и подобрать коэффициенты методом электронного баланса:
а) КNO3+Zn+KOH+H2O=NH3+K2[Zn(OH)4]+…
б) К2Cr2О7+KNO2+H2SO4=…
в) KMnO4+Zn+H2SO4=…
г) KMnO4+Zn+KOH=K2MnO4+K2[Zn(OH)4]+…
д) Cr2(SO4)3+H2O2+KOH=K2CrO4+…
е) FeCl2+KClO3+HCl=FeCl3+…
5. Составьте схему электронного баланса (метод степеней окисления), подберите коэффициенты, определите тип ОВР.
а) KIO3+ Na2SO3+ H2SO4=I2+ Na2SO4+ K2SO4+H2O
б) Bi2O3+Cl2+KOH=KCl+KBiO3+ H2O
в) Zn+ HNO3= Zn(NO3)2+NH4NO3+ H2O
г) (NH4)2Cr2O7=N2+Cr2O3+ H2O
д) NO2+NaOH=NaNO2+ NaNO3+ H2O
е) HNO3= NO2+O2+ H2O
ж) KClO3=KCl+ KClO4
з) NaFeO2 +Cl2+NaOH= Na2FeO4+Na Cl+ H2O
и) PH3+ KMnO4+HCl= H3PO4 +MnCl2+KCl+ H2O
к) Al+ NaOH+ H2O=Na3[Al(OH)6] + H2
ЗАНЯТИЕ 17
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Самостоятельная работа по составлению уравнений окислительно-восстановительных реакций методами электронного баланса
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
ЗАНЯТИЕ 18
План занятия
1. Проверка посещаемости и информация
2. Контрольная работа по теме «ОВР»
3. Лабораторная работа 4. «Реакции с изменением степени окисления элементов»
4. Подведение итогов занятия
Пример контрольной работы
1. Указать окислитель и восстановитель, подобрать коэффициенты в следующем уравнении:
KMnO4 + HCl (конц.) → Cl2
2. Подобрать коэффициенты методом электронного баланса в реакции диспропорционирования:
TiCl3 → TiCl2 + TiCl4
3. закончить уравнение и подобрать коэффициенты методом электронного баланса:
Cr2(SO4)3 + H2O2 + KOH → K2CrO4
4. Вычислить эквиваленты окислителя и восстановителя в следующей реакции:
KJO3 + Na2SO3 + H2SO4 → J2 + Na2SO4 + K2SO4 + H2O
ЗАНЯТИЕ 19
План занятия
1. Проверка посещаемости и информация
2. Заслушивание реферативных докладов
3. Подведение итогов занятия
Темы докладов
1. Место химии в системе естественных наук и фармацевтического образования.
2. Значение химии для развития медицины и фармации.
3. Номенклатура основных классов неорганических веществ.
4. Спектры атомов как источник информации об их строении.
5. Периодический закон как пример действия законов материалистической диалектики – перехода количества в качество и единства и борьбы противоположностей.
6. Характерные структуры трех, четырех, пяти и шестиатомных молекул.
7. Химическое строение и электронные спектры поглощения молекул (УФ, видимая и ближняя ИК – области). Изучение строения радикалов методом электронного парамагнитного резонанса (ЭПР). Изучение распределения электронной плотности в молекулах с помощью ядерного магнитного резонанса (ЯМР); представление о химическом сдвиге ЯМР сигнала.
8. Комплексные кислоты, основания, соли. Пикомплексы. Карбонилы металлов. Биологическая роль КС. Металлоферменты, понятие о строении их активных центров. Химические основы применения в фармации и медицине.
9. Роль ионных, в том числе кислотно-основных взаимодействий при метаболизме лекарств, в анализе лекарственных препаратов, при приготовлении лекарственных смесей. Химическая несовместимость лекарственных веществ.
10. Роль окислительно-восстановительных процессов в метаболизме.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
а) основной список
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 350 c.
б) дополнительный список
1. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 340 с.
2. Пузаков С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 976 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 100 с.
4. Тетрадь для лабораторных работ по общей химии для очного фармацевтического факультета. [Текст] / Твер. гос. мед. унив.; под ред. Г.М. Зубаревой. – Тверь: Типография “Печатница”, 2010 г. – 250 с.
ЭТАЛОНЫ ОТВЕТОВ К ТЕСТОВЫМ ЗАДАНИЯМ
Занятие 2.
| 1 | 1 | 9 | 3 | 17 | 1 |
| 2 | 2 | 10 | 1 | ||
| 3 | 3 | 11 | 2 | ||
| 4 | 2 | 12 | 1 | ||
| 5 | 2 | 13 | 2 | ||
| 6 | 2 | 14 | 2 | ||
| 7 | 2 | 15 | 2 | ||
| 8 | 2 | 16 | 3 | ||
Занятие 7.
| 1 | 4 | 16 | 4 | 31 | 4 | 46 | 3 4 |
| 2 | 3 | 17 | 4 | 32 | 3 | 47 | 2 4 |
| 3 | 1 | 18 | 2 | 33 | 3 | 48 | 4 |
| 4 | 3 | 19 | 1 | 34 | 2 | 49 | 4 |
| 5 | 4 | 20 | 3 | 35 | 3 | 50 | 4 |
| 6 | 4 | 21 | 1 | 36 | 4 | 51 | 1 |
| 7 | 2 | 22 | 1 | 37 | 3 | 52 | 1 3 4 |
| 8 | 4 | 23 | 3 | 38 | 4 | 53 | 2 4 |
| 9 | 4 | 24 | 1 | 39 | 1 | ||
| 10 | 4 | 25 | 4 | 40 | 4 | ||
| 11 | 1 | 26 | 3 | 41 | 1 | ||
| 12 | 4 | 27 | 4 | 42 | 2 4 | ||
| 13 | 1 | 28 | 2 | 43 | 1 4 | ||
| 14 | 3 | 29 | 4 | 44 | 2 4 | ||
| 15 | 1 | 30 | 2 | 45 | 3 4 | ||
Кафедра химии
ОБЩАЯ ХИМИЯ
Учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и экзамену
для студентов 1 курса фармацевтического факультета
ТВЕРЬ
2017
УДК 54 :615
ББК 24
Авторы-составители: Лопина Н.П., Бордина Г.Е.
Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М.
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ФГБОУ ВО Тверского ГМУ Минздрава России
Ю.П. Игнатова – канд. мед. наук, доцент кафедры физиологии ФГБОУ ВО Тверского ГМУ Минздрава России
Учебно-методическое пособие утверждено ЦКМС ТГМУ
Общая химии. [Текст]: учебно-методическое пособие для подготовки к лабораторно-практическим занятиям и экзамену для студентов 1 курса фармацевтического факультета / Лопина Н.П., Бордина Г.Е. // Под общей редакцией: Зубаревой Г.М. – Тверь: Ред.-издат. центр Твер. гос. мед. унив.., 2017. – 96 с.
Учебно-методическое пособие составлено коллективом кафедры химии Тверского государственного медицинского университета и предназначено в помощь студентам I курса фармацевтического факультета для подготовки к лабораторно-практическим занятиям и экзамену.
Авторы-составители – сотрудники кафедры химии Тверского государственного медицинского университета:
Надежда Петровна Лопина – канд. хим. наук, доцент кафедры химии
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
ОГЛАВЛЕНИЕ
I. СТРОЕНИЕ ВЕЩЕСТВА
II. Учение о растворах
III. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
ПРЕДИСЛОВИЕ
Учебно-методическое пособие соответствует примерной программе по дисциплине «Общая и неорганическая химия» для специальностей 060301 – фармация утвержденной Руководителем Департамента образовательных программ и стандартов профессионального образования Минобразования России (Москва, 2002 г.).
Химия является теоретической основой для изучения биохимии, фармацевтической химии, токсикологической химии, физиологии, анатомия.
Авторы-составители стремились подобрать задания, охватывающие все теоретические вопросы программы курса химии.
Новизна учебно-методического пособия заключается в том, что оно составлено согласно рекомендациям образовательного стандарта III поколения.
Учебно-методическое пособие включает 3 модуля. Каждый модуль содержит вопросы и задания к занятию, эталоны решения задач, задачи для самостоятельного решения, тестовые задания с эталонами ответов.
На некоторые задачи ответы не приводятся; авторы пошли на такой шаг вполне сознательно, так как в ряде случаев приведение ответа фактически означает сообщение студенту решения задачи.
Учебно-методическое пособие выполняет обучающую, контролирующую и прикладную функции, дает возможность студенту самому оценить уровень сформированности расчетных умений, развить собственную инициативу и познавательную активность по решению разнообразных химических задач.
Мы заранее благодарны всем коллегам, которые, ознакомившись с данным пособием, сообщат нам о замеченных ими просчетах или недостатках.
Авторы-составители
I. СТРОЕНИЕ ВЕЩЕСТВА
ЗАНЯТИЕ 1
Правила работы в химической лаборатории. Введение в практикум. Основные понятия и законы химии.
План занятия
1. Проверка посещаемости и информация
2. Объяснение преподавателя
3. Тестовый контроль (проверка исходного школьного уровня знаний)
4. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Дата: 2018-12-21, просмотров: 761.