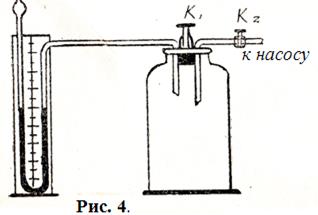
 Схема лабораторной установки, используемой при выполнении работы, показана на рис. 4. Основными элементами установки являются толстостенный сосуд ёмкостью 15-20 литров,
Схема лабораторной установки, используемой при выполнении работы, показана на рис. 4. Основными элементами установки являются толстостенный сосуд ёмкостью 15-20 литров, 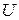 - образный манометр и насос. Стеклянный сосуд соединён трубками и резиновыми шлангами с насосом и с манометром. При нажатии клапана
- образный манометр и насос. Стеклянный сосуд соединён трубками и резиновыми шлангами с насосом и с манометром. При нажатии клапана 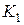 сосуд может сообщаться с атмосферой. Кран
сосуд может сообщаться с атмосферой. Кран 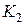 служит для подачи воздуха в сосуд oт насоса.
служит для подачи воздуха в сосуд oт насоса.
Для того, чтобы проанализировать процессы, происходящие в сосуде, мысленно выделим один моль газа, объём которого 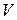 — молярный объём,
— молярный объём, 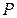 — давление,
— давление, 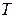 — температура.
— температура.
До начала эксперимента воздух в сосуде находится при атмосферном давлении. С помощью насоса быстро накачивают немного воздуха и закрывают кран 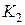 . Теперь давление воздуха в сосуде выше атмосферного, о чём можно судить по разности уровней жидкости в манометре. Но кроме давления повысилась и температура воздуха, так как над газом совершена работа внешними силами (адиабатическое сжатие при быстром накачивании в сосуд дополнительной массы газа).
. Теперь давление воздуха в сосуде выше атмосферного, о чём можно судить по разности уровней жидкости в манометре. Но кроме давления повысилась и температура воздуха, так как над газом совершена работа внешними силами (адиабатическое сжатие при быстром накачивании в сосуд дополнительной массы газа).
По истечении 2-3 минут разность уровней жидкости в манометре уменьшается до некоторой величины 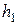 . Это объясняется тем, что температура воздуха в сосуде понизилась и сравнялась с температурой окружающей среды (процесс изохорический). При этом молярный объём будет
. Это объясняется тем, что температура воздуха в сосуде понизилась и сравнялась с температурой окружающей среды (процесс изохорический). При этом молярный объём будет 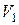 , давление
, давление 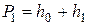 и температура
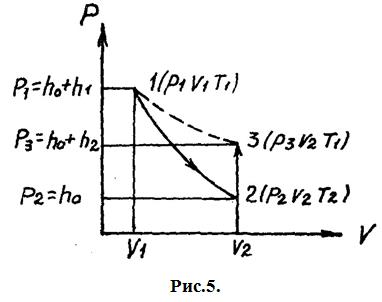
и температура 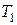 . Состояние газа, соответствующее этим параметрам, обозначено точкой 1 на рис. 5.
. Состояние газа, соответствующее этим параметрам, обозначено точкой 1 на рис. 5.
 После этого газ переводится в новое состояние, для чего открывают на некоторое время клапан
После этого газ переводится в новое состояние, для чего открывают на некоторое время клапан 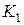 (пока уровни жидкости в манометре не сравняются) (рис. 4). Воздух в сосуде быстро расширяется ( процесс адиабатический) и его давление становится равным атмосферному
(пока уровни жидкости в манометре не сравняются) (рис. 4). Воздух в сосуде быстро расширяется ( процесс адиабатический) и его давление становится равным атмосферному 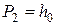 . При этом температура воздуха в баллоне понизится до некоторого значения
. При этом температура воздуха в баллоне понизится до некоторого значения 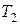 , а мысленно выделенное количество газа займёт другой объём
, а мысленно выделенное количество газа займёт другой объём 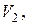 причём
причём 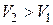 .
.
Температура 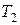 будет ниже температуры окружающей среды
будет ниже температуры окружающей среды 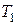 , так как при расширении газа совершается работа за счёт внутренней энергии газа (воздуха). Новое состояние газа, характеризуемое параметрами
, так как при расширении газа совершается работа за счёт внутренней энергии газа (воздуха). Новое состояние газа, характеризуемое параметрами 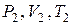 , соответствует на графике (рис.5) точке 2. Точки 1 и 2 принадлежат одной адиабате. Для адиабатического перехода из состояния 1 в состояние 2 справедливо уравнение Пуассона (7).
, соответствует на графике (рис.5) точке 2. Точки 1 и 2 принадлежат одной адиабате. Для адиабатического перехода из состояния 1 в состояние 2 справедливо уравнение Пуассона (7).
После закрытия клапана 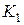 давление внутри сосуда в течение 3-4 минут возрастает вследствие того, что воздух, охладившийся при адиабатическом расширении, станет нагреваться за счёт теплообмена через стенки сосуда с окружающей средой (изохорический процесс). Когда температура воздуха внутри сосуда станет равной температуре окружающей среды
давление внутри сосуда в течение 3-4 минут возрастает вследствие того, что воздух, охладившийся при адиабатическом расширении, станет нагреваться за счёт теплообмена через стенки сосуда с окружающей средой (изохорический процесс). Когда температура воздуха внутри сосуда станет равной температуре окружающей среды 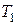 , давление внутри сосуда перестанет возрастать. После этого делают отсчёт по шкале манометра. Давление воздуха в сосуде в этот момент
, давление внутри сосуда перестанет возрастать. После этого делают отсчёт по шкале манометра. Давление воздуха в сосуде в этот момент 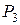 окажется выше атмосферного на величину, измеряемую разностью уровней жидкости в манометре
окажется выше атмосферного на величину, измеряемую разностью уровней жидкости в манометре 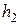 :
:
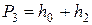 . (24)
. (24)
Объём воздуха в сосуде 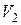 не изменится, так как кран был закрыт. Это новое состояние газа, характеризуемое параметрами
не изменится, так как кран был закрыт. Это новое состояние газа, характеризуемое параметрами 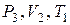 , соответствует на графике точке 3. Из сравнения состояний газа, изображаемых на графике точками 1 и 3, следует, что в этих состояниях газ имел одинаковую температуру
, соответствует на графике точке 3. Из сравнения состояний газа, изображаемых на графике точками 1 и 3, следует, что в этих состояниях газ имел одинаковую температуру 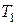 , т. е. точки 1 и 3 принадлежат одной и той же изотерме. Поэтому для этих состояний применим закон Бойля-Мариотта
, т. е. точки 1 и 3 принадлежат одной и той же изотерме. Поэтому для этих состояний применим закон Бойля-Мариотта
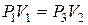 .
.
Возводя это уравнение в степень 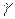 и деля его почленно на уравнение Пуассона (7), получаем:
и деля его почленно на уравнение Пуассона (7), получаем:
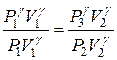 ,
,
откуда
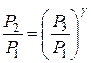 .
.
Логарифмируя это равенство и разрешая его относительно 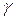 , находим:
, находим:
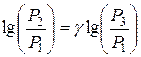 ,
,
откуда
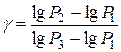 . (25)
. (25)
Подставив в это выражение значения 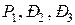 , получим:
, получим:
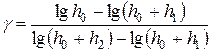 . (26)
. (26)
При приближённом вычислении разность логарифмов можно заменить разностями самих чисел, стоящих под знаками логарифмов. При этом условии выражение (26) приводится к виду:
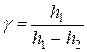 . (27)
. (27)
Таким образом, измерив величины 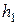 и
и 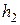 , можно определить
, можно определить 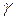 , т. е. величину отношения теплоёмкости идеального газа при постоянном давлении к теплоёмкости этого же газа при постоянном объёме.
, т. е. величину отношения теплоёмкости идеального газа при постоянном давлении к теплоёмкости этого же газа при постоянном объёме.
Порядок выполнения работы
1. Составить таблицу для записи результатов.
2. Открыв кран 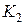 , накачивают воздух в баллон до тех пор, пока разность уровней жидкости в манометре не будет равна 25-30 см (3-4 качка насосом Камовского). При накачивании воздуха надо следить за тем, чтобы понижающийся в манометре уровень жидкости не доходил до изогнутого нижнего края манометрической трубки.
, накачивают воздух в баллон до тех пор, пока разность уровней жидкости в манометре не будет равна 25-30 см (3-4 качка насосом Камовского). При накачивании воздуха надо следить за тем, чтобы понижающийся в манометре уровень жидкости не доходил до изогнутого нижнего края манометрической трубки.
3. Закрывают кран 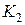 и ждут 2-3 мин., пока температура внутри баллона не станет равной температуре окружающей среды (давление в сосуде перестанет изменяться). После этого отсчитывают разность уровней жидкости в трубке манометра
и ждут 2-3 мин., пока температура внутри баллона не станет равной температуре окружающей среды (давление в сосуде перестанет изменяться). После этого отсчитывают разность уровней жидкости в трубке манометра 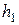 . Отсчёт следует делать по нижнему краю мениска.
. Отсчёт следует делать по нижнему краю мениска.
4. Быстрым нажатием открывают клапан 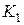 , тем самым соединяя баллон с атмосферой. Выдерживают клапан открытым до тех пор, пока уровни жидкости в манометре не сравняются. При этом температура в баллоне понизится. Подождав 2-3 мин., пока температура в баллоне снова не станет равной температуре окружающей среды, отсчитывают показания манометра
, тем самым соединяя баллон с атмосферой. Выдерживают клапан открытым до тех пор, пока уровни жидкости в манометре не сравняются. При этом температура в баллоне понизится. Подождав 2-3 мин., пока температура в баллоне снова не станет равной температуре окружающей среды, отсчитывают показания манометра 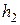 .
.
5. Опыт повторить не менее 5 раз, результаты записать в таблицу.
| Номер опыта | 
| 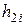
| 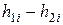
| 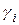
| 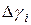
| 
|
| 1 | ||||||
| … | ||||||
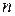
|
6. Рассчитывают 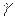 по формуле (27).
по формуле (27).
Обработка результатов
1. Вычислить доверительный интервал 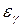 по заданной доверительной вероятности
по заданной доверительной вероятности 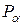 .
.
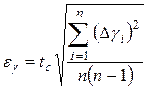 .
.
2. Оценить границу абсолютной допустимой ошибки линейки  .
.
3. Вычислить относительную приборную ошибку, допущенную при определении 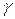 .
.
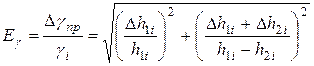 ,
,
где 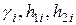 берутся из таблицы и соответствуют случаю, когда
берутся из таблицы и соответствуют случаю, когда
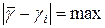 .
.
4. Вычислить абсолютную приборную погрешность 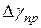 :
:
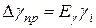 .
.
5. Сравните абсолютную приборную погрешность 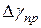 и доверительный интервал
и доверительный интервал 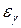 . Если они одного порядка, то ошибка измерения
. Если они одного порядка, то ошибка измерения 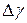 вычисляется по формуле:
вычисляется по формуле:
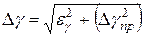
Если они отличаются хотя бы на порядок, то берётся наибольшая ошибка.
6. Окончательный результат запишите в виде:
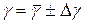 .
.
Контрольные вопросы
1. Сформулируйте первое начало термодинамики, запишите его и объясните физический смысл всех членов уравнения.
2. Какие процессы называются изохорическими, изобарическими, изотермическими и адиабатическими?
3. Запишите первый закон термодинамики для каждого из этих процессов.
4. Что называется молярной теплоёмкостью? От чего она зависит для идеального газа?
5. Запишите уравнения Пуассона. Что называется коэффициентом Пуассона? Каково его значение для идеального одно- и многоатомного газа?
6. Какая существует связь между внутренней энергией идеального газа и его температурой?
7. Какие процессы происходят с газом в баллоне при выполнении лабораторной работы? Назовите каждый процесс и закон, его описывающий, и напишите математическое выражение этих законов.
8. Постройте графики изопроцессов происходящих в баллоне с газом при выполнении данной лабораторной работы. Приведите примеры изопроцессов из области технологии общественного питания (товароведения и торговой техники).
Рекомендуемая литература
1. Геворкян Р.Г., Шепель В.В. Курс физики. 1959
2. Зисман Г.А., Тодес О.М. Курс общей физики, т. 1. – М.: Наука, 1974. 337 с.
3. Рымкевич А.П. Сборник задач по физике. – М.: Просвещение, 1994. 224 с.
4. Савельев И.В. Курс общей физики, т 1. – М. : Наука, 1987.
5. Трофимова Г.И. Курс физики. Учебник для ВУЗов. М. : Высшая школа, 1989.
6. Шубин А.С. Курс общей физики. – М.: Высшая школа, 1976. – 480 с.
Фролов Марат Александрович
Ашихина Людмила Анатольевна
Лабораторный практикум
по дисциплине «Физика» для студентов
Дата: 2018-12-21, просмотров: 660.