1. Определить по табл. 1 для условий опыта 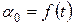 .
.
2. Вычислить и записать в таблицу 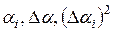 .
.
3. Вычислить доверительный интервал 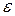 по заданной доверительной вероятности
по заданной доверительной вероятности 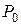 .
.
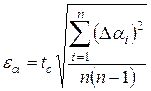 .
.
4. Оценить границу абсолютной допустимой ошибки манометра.
5. Вычислить относительную приборную ошибку, допущенную при определении 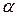 .
.
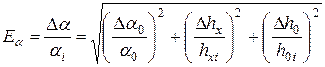 ,
,
где 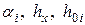 берутся из таблицы и соответствуют случаю, когда
берутся из таблицы и соответствуют случаю, когда 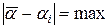 ,
, 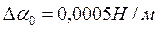 .
.
6. Вычислить абсолютную приборную погрешность 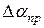 :
:
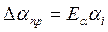 .
.
7. Сравните абсолютную приборную погрешность 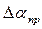 и доверительный интервал
и доверительный интервал 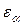 . Если они одного порядка, то ошибка измерения
. Если они одного порядка, то ошибка измерения 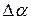 вычисляется по формуле:
вычисляется по формуле:
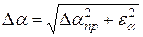 .
.
Если они отличаются хотя бы на порядок, то берётся наибольшая ошибка.
8. Окончательный результат запишите в виде:
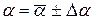 .
.
Контрольные вопросы
1. Приведите примеры, подтверждающие существование поверхностного натяжения жидкостей. Как можно уменьшить поверхностное натяжение?
2. Дайте (сформулируйте) определение коэффициента поверхностного натяжения. В каких единицах он измеряется в системе СИ?
3. Объясните, почему горячая мыльная вода лучше моет посуду и бельё, чем холодная чистая вода или холодная мыльная вода.
4. Объясните, почему вода поднимается в стеклянных капиллярах, а ртуть в тех же капиллярах опускается по отношению к свободной поверхности жидкости.
5. Чему равен коэффициент поверхностного натяжения жидкости (например, воды) при критической температуре?
6. Объясните сущность метода Ребиндера и укажите порядок выполнения данной лабораторной работы.
7. Укажите основные причины ошибок определения коэффициента поверхностного натяжения жидкости применяемым методом.
ЛАБОРАТОРНАЯ РАБОТА №7
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ПОСТОЯННОМ ОБЪЁМЕ МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
1. Цель работы: Изучение изопроцессов, закономерностей адиабатического процесса и экспериментальное определение показателя адиабаты для воздуха при комнатной температуре.
Краткая теория.
Основные закономерности адиабатического процесса изучаются на примере поведения идеального газа.
Идеальный газ — это некий абстрактный газ, удовлетворяющий следующим условиям: 1) соударения молекул такого газа происходят как соударения упругих шаров; 2) размеры молекул пренебрежимо малы; 3) между молекулами отсутствуют силы взаимного притяжения и отталкивания.
 Всякий реальный газ по мере убывания его плотности приближается по свойствам к идеальному. Обычный воздух при комнатной температуре и атмосферном давлении можно приближённо считать идеальным газом. Состояние некоторой массы газа определяется значениями трёх параметров: давления
Всякий реальный газ по мере убывания его плотности приближается по свойствам к идеальному. Обычный воздух при комнатной температуре и атмосферном давлении можно приближённо считать идеальным газом. Состояние некоторой массы газа определяется значениями трёх параметров: давления  , объема
, объема  и температуры
и температуры 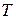 . В том случае, когда из этих трёх параметров при изменении состояния газа один остаётся постоянным, процесс перехода называется изопроцессом.
. В том случае, когда из этих трёх параметров при изменении состояния газа один остаётся постоянным, процесс перехода называется изопроцессом.
Для идеального газа строго выполняются законы Бойля-Мариотта,
Гей-Люссака и Шарля. Эти законы описывают состояния газа для случаев, когда один из параметров остаётся постоянным.
Закон Бойля-Мариотта описывает изотермический процесс, т. е. процесс, протекающий при постоянной температуре ( 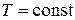 ): для данной массы газа при постоянной температуре произведение давления газа на объём есть величина постоянная
): для данной массы газа при постоянной температуре произведение давления газа на объём есть величина постоянная
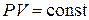 .
.
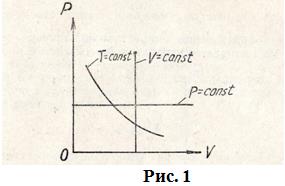
Графически это соотношение изображается гиперболой (рис. 1). Каждому значению температуры соответствует своя кривая. Эти кривые называются изотермами.
Закон Гей-Люссака описывает изобарический процесс, т. е. процесс, протекающий при постоянном давлении ( 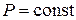 ): отношение объёма данной массы газа к температуре, при которой он находится, есть величина постоянная:
): отношение объёма данной массы газа к температуре, при которой он находится, есть величина постоянная:
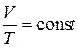 . (2)
. (2)
Закон Шарля описывает изохорический процесс, т. е. процесс, протекающий при постоянном объёме ( 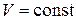 ): отношение давления газа к температуре, при которой он находится, есть величина постоянная:
): отношение давления газа к температуре, при которой он находится, есть величина постоянная:
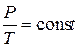 . (3)
. (3)
Графически соотношения (2) и (3) изображены в координатах 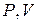 на рис. 1.
на рис. 1.
Первое начало термодинамики выражает закон сохранения энергии и формулируется следующим образом: количество тепла 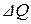 сообщённое системе, идёт на приращение внутренней энергии
сообщённое системе, идёт на приращение внутренней энергии 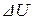 системы и на совершение системой работы
системы и на совершение системой работы 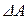 против внешних сил:
против внешних сил:
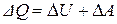 . (4)
. (4)
Для бесконечно малого изменения состояния системы уравнение (4) примет вид:
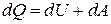 . (5)
. (5)
Адиабатическим процессом называется процесс, протекающий без теплообмена с внешней средой. Близкими к адиабатическому могут быть быстро протекающие процессы, так как количество тепла, которым обменивается система с внешней средой, будет тем меньше, чем меньшее время длится процесс.
Для адиабатического процесса 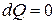 , тогда из (5) следует:
, тогда из (5) следует:
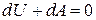
или
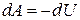 , (6)
, (6)
т. е. работа в адиабатическом процессе совершается за счёт убыли внутренней энергии.
Для идеального газа при адиабатическом процессе функциональная связь между давлением и объёмом определяется уравнением Пуассона:
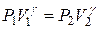 , (7)
, (7)
 где
где 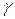 — показатель степени, численно равный отношению молярных теплоёмкостей данного газа, т. е.:
— показатель степени, численно равный отношению молярных теплоёмкостей данного газа, т. е.:
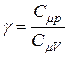 . (8)
. (8)
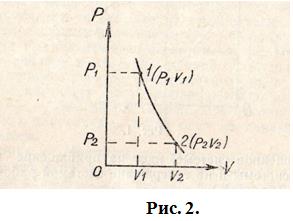
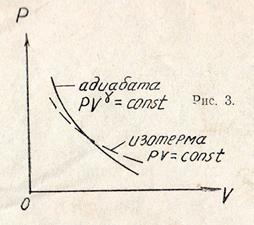
Кривая, изображающая адиабатический процесс в координатах 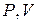 называется адиабатой (рис. 2).
называется адиабатой (рис. 2).
Теплоёмкость газа — это физическая величина, численно равная количеству тепла, которое необходимо сообщить системе для нагревания её на один Кельвин (градус):
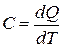 . (9)
. (9)
В системе СИ теплоёмкость имеет размерность 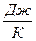 .
.
Различают удельную и молярную теплоёмкости.
Теплоёмкость единицы массы вещества называют удельной теплоёмкостью:
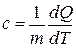 . (10)
. (10)
Она обозначается буквой 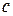 и имеет и имеет размерность
и имеет и имеет размерность 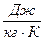 .
.
Теплоёмкость одного моля вещества называется молярной:
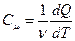 , (11)
, (11)
где 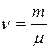 — число молей вещества;
— число молей вещества; 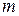 — масса вещества;
— масса вещества; 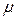 — молярная масса. Молярная теплоёмкость имеет размерность
— молярная масса. Молярная теплоёмкость имеет размерность 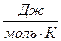 .
.
Теплоёмкость моля вещества и удельная теплоёмкость связаны очевидным соотношением:
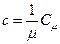 .
.
Величина теплоёмкости газов существенно зависит от условий, при которых протекает процесс: при постоянном объёме или при постоянном давлении.
Если нагревание газа происходит при постоянном объёме, то газ не совершает работы против внешних сил, так как 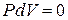 . Из уравнения первого начала термодинамики следует:
. Из уравнения первого начала термодинамики следует:
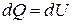 , (12)
, (12)
т. е. при изохорическом процессе всё тепло, сообщенное газу, идёт на приращение его внутренней энергии. Напомним, что внутренняя энергия идеального газа является функцией только температуры. Следовательно, для одного моля идеального газа имеем:
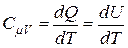 . (13)
. (13)
Внутренняя энергия одного моля идеального газа определяется уравнением:
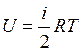 , (14)
, (14)
где 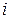 — число степеней свободы молекулы данного газа (число независимых координат, которые полностью определяют положение молекулы в пространстве, называется числом степеней свободы молекулы);
— число степеней свободы молекулы данного газа (число независимых координат, которые полностью определяют положение молекулы в пространстве, называется числом степеней свободы молекулы); 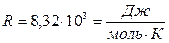 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Для бесконечно малого изменения температуры из уравнения (14) следует:
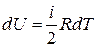 ,
,
откуда
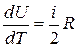 . (15)
. (15)
С учётом (15) выражение (13) приводится к виду
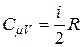 . (16)
. (16)
Если нагревание газа происходит при постоянном давлении, то согласно первому началу термодинамики тепло 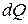 , сообщённое газу, затрачивается не только на увеличение его внутренней энергии
, сообщённое газу, затрачивается не только на увеличение его внутренней энергии 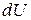 , но и на совершение газом работы
, но и на совершение газом работы 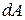 , то есть:
, то есть:
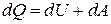 . (17)
. (17)
Для изобарического процесса 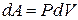 , поэтому (17) можно записать в виде:
, поэтому (17) можно записать в виде:
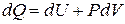
Теплоёмкость моля газа при постоянном давлении равна:
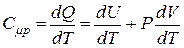 . (18)
. (18)
Первое слагаемое правой части этого равенства равно молярной теплоёмкости газа при постоянном объёме. Запишем уравнение состояния идеального газа для случая бесконечно малого изменения его параметров:
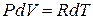 ,
,
откуда
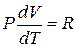 . (19)
. (19)
Таким образом, второе слагаемое равенства (18) численно равно универсальной газовой постоянной 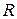 .
.
Выражение молярной теплоёмкости газа при постоянном давлении с учётом (15) и (19) приводится к виду:
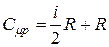 , (20)
, (20)
а так как
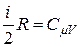 , (21)
, (21)
то
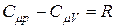 . (22)
. (22)
Это выражение называется уравнением
Майера.
Анализ формул (16) и (20) приводит к выводу, что для идеального газа 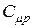 и
и 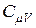 не зависят от параметров состояния газа
не зависят от параметров состояния газа 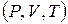 , а определяются только числом степеней свободы молекул. Для реальных газов этот вывод удовлетворительно согласуется с опытом при невысоких температурах. При более высоких температурах становится существенной зависимость теплоёмкости и, следовательно, показателя адиабатического процесса
, а определяются только числом степеней свободы молекул. Для реальных газов этот вывод удовлетворительно согласуется с опытом при невысоких температурах. При более высоких температурах становится существенной зависимость теплоёмкости и, следовательно, показателя адиабатического процесса 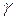 от температуры, что необходимо учитывать при расчётах.
от температуры, что необходимо учитывать при расчётах.
Разделив почленно (20) на (16), имеем:
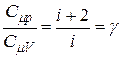 . (23)
. (23)
Так как 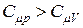 , то показатель адиабаты
, то показатель адиабаты 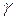 всегда больше единицы.
всегда больше единицы.
Поэтому адиабата круче спадает к оси абсцисс, чем изотерма (рис. 3).
 Соотношение (23) позволяет вычислить величину
Соотношение (23) позволяет вычислить величину  для любого газа, если известно число степеней свободы молекул этого газа. Например, для одноатомных газов
для любого газа, если известно число степеней свободы молекул этого газа. Например, для одноатомных газов 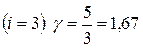 ; для двухатомных газов
; для двухатомных газов 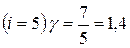 .
.
Этот результат можно проверить на опыте, что и является целью настоящей работы.
Дата: 2018-12-21, просмотров: 634.