Это один из наиболее сложных электрохимических методов. Сегодня циклическая вольтамперометрия используется довольно часто, поскольку позволяет получить богатую экспериментальную информацию о кинетике и термодинамике многих химических систем. Главная особенность в том, что потенциал изменяется циклически, т.е. например, сначала происходит окисление исследуемого вещества, а затем его восстановление на поверхности твердого электрода согласно приведенным уравнениям реакций:
Red – ne = Ox+n
Ox +n + ne = Red
Таким образом, происходит циклическое изменение состояния исследуемого вещества. Графическим отображением происходящих на рабочем электроде электрохимических реакций является циклическая вольтамперограмма, которая состоит из двух ветвей: анодной и катодной. Таким образом, циклическая вольтамперометрия – это совокупность анодного (окисление) и катодного (восстановление) процессов, проходящих на электроде. Вид вольтамперограммы зависит от многих факторов: особенности строения двойного электрического слоя исследуемого вещества, геометрии электрода, параметров ячейки и т.д.
Реальные циклические вольтамперограммы показаны на рис.1.7.
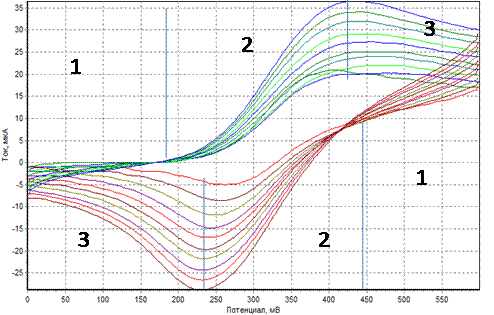
Рис. 1.7. Циклическая вольтамперная кривая зависимости силы тока( I ) от потенциала (Е).
На первом этапе кривой мы можем наблюдать присутствие начального или остаточного тока, который практически не изменяется при линейном увеличении потенциала (1), что связанно с заряжением двойного электрического слоя на рабочем электроде. Когда потенциал достигает стандартного потенциала редокс-соединения сила тока начинает возрастать, при этом происходит переход вещества в растворе из восстановленной формы в окисленную (2). Сила анодного тока растет до определенного значения, образуя характерный пик на вольтамперограмме, а затем снижается из-за того, что восстановленной формы в приэлектродном пространстве становится мало, так как идет отдача электронов при переходе восстановленной формы в окисленную (3). В результате чего на вольтамперограмме наблюдается пик, который называется анодный пик.
Аналогично идет процесс образования катодного пика при изменении направления потенциала в противоположную сторону (1-3). Уменьшение силы катодного тока происходит за счет передачи электронов от электрода к окисленной форме вещества.
Регистрируемый ток состоит из следующих токов:
1) Фарадеевский ток – электрический ток, связанный с переносом электронов через границу электрод/ОВ-система,.
2) Емкостной ток. Является одной из главных специфических помех в вольтамперометрии. Емкостная составляющая может намного превышать значения фарадеевского тока, что усложняет зависимость от времени и потенциала. Также данная составляющая не несет в себе никакой информации, так как не зависит от содержания определяемых веществ.
3) Существенное влияние на измеряемый ток оказывает омическое сопротивление. Его влияние приводит к «размыванию» информационных волн и пиков на вольтамперограмме, уменьшению их величины, к затруднению аппаратурного разделения фарадеевского и емкостного тока. Влияние омического сопротивления может частично уменьшаться при использовании трехэлектродной ячейки.
4) Ток, связанный с шумовой помехой. Шумы могут возникать как и в самой ячейке, так и в измерительном аппарате. Их возникновение бывает связано с разными причинами: хаотическое движение заряженных частиц, хаотическая конвекция в объеме раствора, вызванная флуктуациями пространственно-временного распределения температуры и плотности по объему. Также на шумы может влиять случайный характер процесса диссоциации-ассоциации (в случае слабых электролитов) [1].
Принципиальная электрическая схема для регистрации циклических вольтамперограмм изображена на рисунке 1.8. Она состоит из электрохимической ячейки с тремя электродами (вспомогательный, рабочий и электрод сравнения), погруженными в раствор электролита и связанными с потенциостатом.
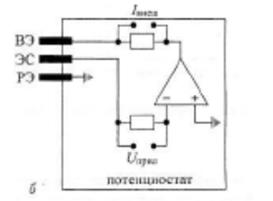
Рис. 1.8. Ячейка с тремя электродами для циклической вольтамперометрии
В целом между катодной и анодной вольтамперометрией нет принципиальных различий, небольшая разница заключается в направлении развертки потенциала: катодная развертка направлена в сторону более отрицательных потенциалов, а анодная – в сторону более положительных.
Направление поляризации электрода и метод концентрирования зависят от свойств и природы определяемого вещества. Катодная и анодная вольтамперограммы изображены на рис.1.9.
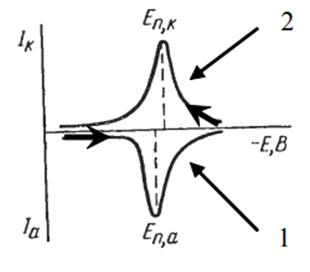
Рис.1.9.Катодная (1) и анодная (2) вольтамперограмма, полученные на твердом электрод
При катодной вольтамперометрии на электроде идет процесс восстановления ионов определяемого элемента на поверхности электрода:
Ме n+ + ne = Ме0
При анодной вольтамперометрии наблюдается обратный процесс:
Ме0 – ne = Ме n+
Дата: 2018-12-21, просмотров: 1689.