Для вольтамперометрических измерений используется трехэлектродная ячейка, изображенная на рис.1.3.
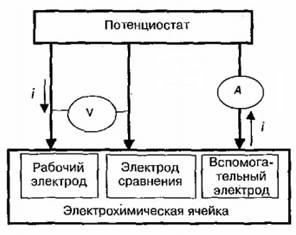
Рис.1.3. Принципиальная схема трехэлектродной ячейки
Индикаторный электрод должен обратимо реагировать на изменение состава анализируемого раствора, чтобы по наличию (или отсутствию) аналитического сигнала и его интенсивности можно было судить о том, есть ли определяемый компонент в растворе и в каком количестве. Индикаторный электрод не должен реагировать с компонентами раствора, поэтому для их изготовления чаще всего применяют химически инертные токопроводящие материалы: благородные металлы (золото, платина), ртуть, углеродные материалы (графит, стеклоуглерод). Непременным условием вольтамперометрического анализа является применение индикаторного микроэлектрода, например ртутного с поверхностью ртутной капли не более 0,1см2 , и вспомагательного макроэлектрода, поверхность которого в сотни раз выше, чем индикаторного.
Плотность тока (1.4) на макроэлектроде будет незначительной, и это не будет вызывать отклонение равновесного потенциала электрода. В этом случае электрод будет неполяризуемым, т.е. Eа = const (в случае макроанода) или Ек = const (в случае макрокатода).
Плотность тока на микроэлектроде будет значительной, и это вызовет поляризацию электрода; таким образом, все прилагаемое напряжение на ячейку будет тратиться на поляризацию микроэлектрода.
Если потенциал рабочего электрода измеряют относительно потенциала электрода сравнения, условно приняв последний за нуль, то в этом случае U= Eа для рабочего микроанода и U= Ек для рабочего микрокатода.
При этом электрод сравнения должен обладать постоянным и не зависящим от состава раствора потенциалом. Иногда даже не обязательно знать его численное значение, достаточно, чтобы оно воспроизводилось от опыта к опыту и не изменялось при протекании через ячейку небольших токов. Из других требований существенными являются низкое электрическое сопротивление в схеме, отсутствие влияния на состав анализируемого раствора и простота конструкции.
На практике в качестве электрода сравнения чаще всего используют хлорсеребряный и каломельный электроды (рис. 1.4).
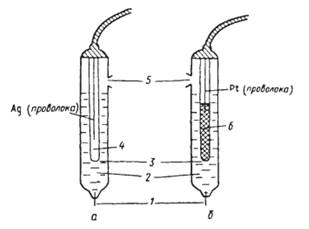
Рис.1.4.Электроды сравнения хлоридсеребряные (а) и каломельный (б) с двойным солевым мостиком: 1-асбестовое волокно, обеспечивающее контакт с анализируемым раствором, 2-внешний раствор KCl (насыщ.), 3- крошечное отверстие для контакта, 4- внутренний раствор KCl (насыщ.), AgCl (тв), 5- отверстие для ввода раствора KCl , 6- паста из смеси Hg 2 Cl 2 , Hg и KCl (насыщ.)
Таким образом, регистрируемая вольтамперограмма I=f(E) отражает электрохимический процесс, происходящий на индикаторном электроде.
Вольтамперограмму, полученную на ртутном электроде, называют полярограммой.
Характеристика вольтамперограммы
Вид вольтамперограммы определяется составом раствора. В случае электропревращения на электроде ионов двух электроактивных веществ она имеет вид, представленный на рис.1.5. На кривой можно отметить три основных участка.
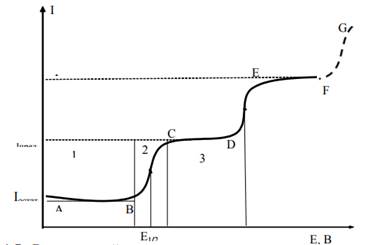
Рис.1.4. Вид типичной вольтамперограммы водного раствора, содержащего два электроактивных веществ
Участок АВ характеризуется плавной, почти горизонтальной линией и указывает на отсутствие разряда определяемых ионов.
Ток в этом случае незначительный, он называется остаточным током и обусловлен двумя причинами:
· восстановлением на электроде примеси более электроположительной, чем определяемый ион (фарадеев ток, Iфар);
· образованием двойного электрического слоя на границе электрод – раствор (ѐмкостный ток или ток заряжения Iзар) Iост = Iфар + Iзар (1.4)
С увеличением потенциала электрода величина этого тока возрастает.
Участок ВС характеризуется резким подъемом тока при незначительном увеличении потенциала электрода. Величина силы тока здесь определяется количеством разряжающихся ионов, которые диффундируют к поверхности электрода из глубины раствора. Диффузия ионов обусловлена градиентом концентрации, имеющим место в связи с уменьшением концентрации в приэлектродном слое за счет восстановления ионов на поверхности электрода. С увеличением потенциала количество ионов, разряжающихся на поверхности электрода, будет увеличиваться, следовательно, будет расти и градиент концентрации.
С дальнейшим незначительным увеличением потенциала наступает момент, когда все ионы данного вида, подходящие к поверхности электрода, мгновенно разряжаются. Градиент концентрации в этом случае будет иметь максимально предельное значение. Количество ионов, диффундирующих к электроду и разряжающихся на его поверхности в каждый момент времени, также будет максимальным. Дальнейшее увеличение потенциала не приведет к увеличению числа разряжающихся ионов. Наступит явление концентрационной поляризации, характеризующееся тем, что рост потенциала не сопровождается изменением величины силы тока. Сила тока будет иметь предельное значение. На кривой получаем почти горизонтальную площадку CD. Сила тока, при которой достигается полный разряд всех ионов данного вида, поступающих в приэлектродное пространство за счет диффузии, называется предельным диффузионным током. Условия проведения анализа должны способствовать достижению предельного диффузионного тока, т.е. концентрация разряжающихся ионов, как правило, не должна превышать 10-2 моль/л. Силу предельного диффузионного тока можно рассчитать по уравнению Ильковича:
Id = 607 n C D1/2 m 2/3 t 1/6 (1.3.1)
где n – число электронов, участвующих в электрохимическом восстановлении (окислении) определяемого иона: D – коэффициент диффузии; m – масса ртути, вытекающая из капилляра в секунду; t – период капания ртути.
При дальнейшем увеличении напряжения разряжаются ионы другого электроактивного вещества (участок DE). При анализе водных растворов, что часто имеет место, дальнейшее увеличение напряжения приводит к разряду ионов водорода или молекул воды с выделением водорода:
2Н+ + 2е = Н2,
2Н2О + 2е = Н2 + 2ОН-
Поскольку концентрация растворителя велика, предельного тока выделения водорода достичь не удается, и кривая будет иметь вид, показанный пунктиром на рис.1.4 (участок FG). Уравнение вольтамперограммы для случая восстановления ионов металла имеет вид
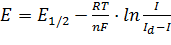 (1.3.2)
(1.3.2)
Это уравнение Гейровского – Ильковича, где Е1/2 – потенциал полуволны (В), т.е. потенциал, отвечающий точке перегиба на полярографической волне, когда сила тока составляет половину величины его предельного значения;
I – ток, соответствующий данному потенциалу Е в данной точке кривой;
Id – предельный диффузионный ток. По значению предельного диффузионного тока судят о количестве вещества, а по потенциалу полуволны – о природе иона.
Ориентировочно Е1/2 можно найти, опустив перпендикуляр из середины полярографической волны на ось потенциалов (рис.1.4).
Нахождение потенциала полуволны является основой качественного полярографического и вольтамперометрического анализов.
Дата: 2018-12-21, просмотров: 1185.