По химической природе веществ, участвующих в реакции, электроды подразделяются на электроды 1-го рода, электроды 2-го рода и окислительно-восстановительные электроды.
Электроды 1-го рода.
В этой системе восстановленной формой является металл, а окисленной формой ионы этого металла. Электроды 1-го рода представляют собой металл, погруженный в раствор соли этого металла:
Cu2++2e  Cuтв
Cuтв
Cu2+/Cu
 (1.2.1.1)
(1.2.1.1)
Эти электроды обратимы по катиону.
Электроды 2-го рода
Система, в которой восстановленная форма – металл и анионы соли. Электроды 2-го рода представляют собой металл, покрытый малорастворимой солью этого металла и погруженный в раствор, содержащий анионы этой малорастворимой соли. Окисленная форма – труднорастворимая соль:
AgCl+e  Agтв+Cl-
Agтв+Cl-
Cl-,AgCl/Ag
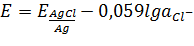 (1.2.1.2)
(1.2.1.2)
Обратимы по аниону.
Окислительно-восстановленные электроды представляют собой благородные металлы, поверхность которых служит лишь обменной базой для протекания электрохимической реакции. Сами электроды в реакции участия не принимают. Это, например, платиновые, золотые, палладиевые и другие электроды. Они чувствительны к любой окислительно-восстановительной системе:
Fe3++e  Fe2+
Fe2+
Fe3+,Fe2+/Pt
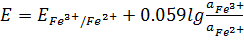 (1.2.1.3)
(1.2.1.3)
По своему функциональному назначению электроды подразделяются на индикаторные (или рабочие), электроды сравнения и вспомогательные.
К индикаторным (рабочим) относятся электроды, электрические характеристики которых прямо или косвенно связаны с активностью анализируемых ионов. На этом электроде протекает требуемая электрохимическая реакция, благодаря чему мы получаем необходимую аналитическую информацию.
Электрод сравнения – это электрод, относительно которого измеряется потенциал индикаторного электрода. Электрод сравнения обладает постоянным, не зависимым от компонентов среды, потенциалом.
Вспомогательный электрод в 3-электродной ячейке исполняет роль приемника или стока электронов, обеспечивая тем самым протекание электрического тока при неравновесных измерениях.
Электродным потенциалом называют ЭДС электрохимической цепи, построенной из стандартного водородного электрода и электрода окислительно-восстановительной полуреакции. Например, для элемента Pt, H2/H+//Zn2+/Zn
в соответствии с реакцией H2+Zn2+↔2H++Zn стандартный электродный потенциал E0= -0,76 (В). Величины электродных потенциалов зависят от концентрации всех компонентов, участвующих в окислительно-восстановительной полуреакции. Эта зависимость выражается уравнением Нернста (1.2.1.2), (1.2.1.3).
Электрохимическая ячейка
Для любого рода электрохимических измерений необходима электрохимическая цепь с электрохимической ячейкой, составной частью которой является анализируемый раствор
 .
.
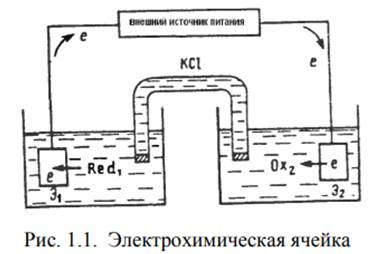
На рис. 1.1 представлена простейшая электрохимическая ячейка. Она состоит из пары электродов, погруженных в раствор электролита. Перенос электронов от восстановителя Red1 к окислителю Ох2 осуществляется с помощью пары электродов и проводников во внешней цепи. Если соединить электроды внешним проводником, а растворы солевым мостиком, то электроны, полученные электродом Э1 от восстановителя, перейдут по внешнему проводнику к электроду Э2 и будут отданы им окислителю. Схематично процессы, происходящие в электрохимической ячейке можно записать
Red1+Ox2↔Ox1+Red2
Механизм переноса электричества в разных участках электрической цепи различен. В металлических проводниках электричество переносят электроны, в растворе – ионы, а на поверхности электродов цепь замыкается за счет перехода от ионной проводимости к электронной в результате электрохимической реакции.
Ток, возникающий в процессе окисления Red1 → Ох1 на аноде, называют анодным Iа, а ток восстановления Ох2 → Red2 на катоде – катодным Iк. И катодный и анодный токи обусловлены процессом электролиза (электрохимическими реакциями), поэтому их называют фарадеевскими токами, IF .
Электрохимические реакции могут иметь обратимый и необратимый характер. Электрохимические реакции являются обратимыми, если при переносе заряда отсутствует перенапряжение, т.е. при наложении небольшого тока не происходит сдвига потенциала. Ток должен быть достаточно мал, чтобы не образовывать концентрационной поляризации.
На рис. 1.2. приведены поляризационные кривые для обратимого и необратимого процессов. В случае обратимого процесса DE (DE = Ea- Ek) достаточно мало, в случае необратимого процесса DE велико.
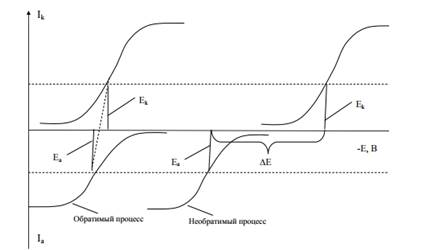
Рис.1.2. Вид поляризационных кривых для обратимого и необратимого процесса.
Методы анализа, основанные на расшифровке поляризационных кривых (вольтамперограмм), полученных в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют вольтамперометрическими. Вольтамперограмма (графическое представление электрохимического процесса как функция I=f(E)) позволяет одновременно получить информацию о качественном и количественном составе пробы, компоненты которой восстанавливаются или окисляются на микроэлектроде, а также о характере электродного процесса.
Дата: 2018-12-21, просмотров: 758.