Введение
В последние десятилетия была отмечена развитие промышленности и сельского хозяйства, одновременно с недостаточной политикой управления отходами водные экосистемы страдают от серьезного ущерба загрязнений, что приводит к резкому падению мировых запасов пресной воды и нанесению потенциального вреда здоровью людей. Для осуществления надлежащего регулирования выбросов промышленных сточных вод и сельскохозяйственных сточных вод требуется эффективная и надежная система мониторинга для оценки токсичности и острой токсичности сточных вод [1,2].
Для успешного решения этой задачи используют современные высокоэффективные методы химического анализа, к числу которых относятся вольтамперометрические методы. Современная вольтамперометрия – высокочувствительный и экспрессный метод определения неорганических, органических веществ, пригодный для анализа геохимических, биохимических, медицинских, фармацевтических и других объектов. Это один из наиболее универсальных методов определения следовых количеств веществ. Применение вольтамперометрических методов анализа позволяет определять концентрации веществ порядка 10-6 – 10-8 моль/л, а в ряде случаев вплоть до 10-9 – 10-10 моль/л.
Цель работы: Изучить вольтамперометрический метод анализа.
Литературый обзор
Теоретические основы вольтамперометрии
Вольтамперометрия относится к электрохимическим методам анализа и исследования, которые основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном слое. Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента и поддающийся правильному измерению, может служить аналитическим сигналом. Сигнал в индикаторной электрохимической системе формируется на границе фаз электрод-раствор и зависит от состояния поверхности электрода, которая определяется природой материала, его дефектностью и механической неоднородностью. Модифицируя поверхность электрода, можно целенаправленно изменять его свойства и достигать необходимых аналитических и метрологических характеристик вольтамперометрического определения.
1.2Основные термины и понятия в вольтамперометрии
Электрохимическая реакция – это гетерогенная реакция на электроде, при которой ионы или электроны переходя через границу раздела фаз, обуславливают протекание электрического тока.
Электрод – система, состоящая из двух контактирующих между собой электропроводящих фаз, обладающих разной формой проводимости: электронной (металл) и ионной (раствор).
Электрохимическая ячейка
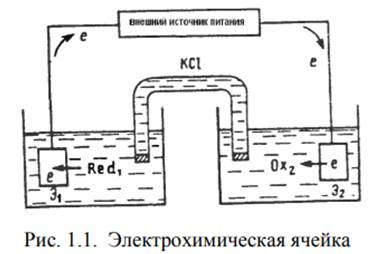
Для любого рода электрохимических измерений необходима электрохимическая цепь с электрохимической ячейкой, составной частью которой является анализируемый раствор
 .
.
На рис. 1.1 представлена простейшая электрохимическая ячейка. Она состоит из пары электродов, погруженных в раствор электролита. Перенос электронов от восстановителя Red1 к окислителю Ох2 осуществляется с помощью пары электродов и проводников во внешней цепи. Если соединить электроды внешним проводником, а растворы солевым мостиком, то электроны, полученные электродом Э1 от восстановителя, перейдут по внешнему проводнику к электроду Э2 и будут отданы им окислителю. Схематично процессы, происходящие в электрохимической ячейке можно записать
Red1+Ox2↔Ox1+Red2
Механизм переноса электричества в разных участках электрической цепи различен. В металлических проводниках электричество переносят электроны, в растворе – ионы, а на поверхности электродов цепь замыкается за счет перехода от ионной проводимости к электронной в результате электрохимической реакции.
Ток, возникающий в процессе окисления Red1 → Ох1 на аноде, называют анодным Iа, а ток восстановления Ох2 → Red2 на катоде – катодным Iк. И катодный и анодный токи обусловлены процессом электролиза (электрохимическими реакциями), поэтому их называют фарадеевскими токами, IF .
Электрохимические реакции могут иметь обратимый и необратимый характер. Электрохимические реакции являются обратимыми, если при переносе заряда отсутствует перенапряжение, т.е. при наложении небольшого тока не происходит сдвига потенциала. Ток должен быть достаточно мал, чтобы не образовывать концентрационной поляризации.
На рис. 1.2. приведены поляризационные кривые для обратимого и необратимого процессов. В случае обратимого процесса DE (DE = Ea- Ek) достаточно мало, в случае необратимого процесса DE велико.
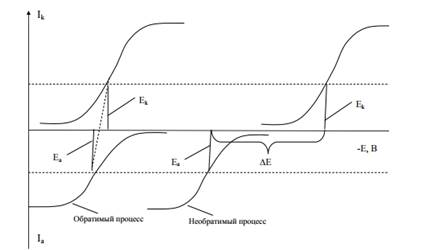
Рис.1.2. Вид поляризационных кривых для обратимого и необратимого процесса.
Методы анализа, основанные на расшифровке поляризационных кривых (вольтамперограмм), полученных в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют вольтамперометрическими. Вольтамперограмма (графическое представление электрохимического процесса как функция I=f(E)) позволяет одновременно получить информацию о качественном и количественном составе пробы, компоненты которой восстанавливаются или окисляются на микроэлектроде, а также о характере электродного процесса.
Выводы
1.Метод вольтамперометрия обладает высокой чувствительностью, что позволяет использовать метод для определения ионов тяжелых металлов в природных и сточных водах.
2. Метод вольтамперометрия может быть для обнаружения промежуточных частиц, возникающих в ходе электродных реакций, но и для выявления характера отдельных стадий и установления механизма процесса в целом.
3. Метод позволяет исследовать процессы восстановления и окисления на одном и том же электроде в одном растворе. С помощью вольтамперограмм можно определить потенциалы восстановления и окисления данного соединения.
Список литературы
1. Брайнина Х. З. Инверсионная вольтамперометрия твердых фаз/ Х. З. Брайнина. М.: Химия, 1972. 192 с.
2. Будников Г. К. Основы современного электрохимического анализа/ Г.К. Будников, М. Р. Вяселев, В. Н. Майстренко. М.: Мир, 2003. 592 с.
3.Дамаскин Б. Б. Электрохимия/ Б. Б. Дамаскин, О. А. Петрий, Г. А. Цирлина. М.: Химия, 2006. 672 с.
4.Электрохимия/ Ф. Миомандр, С. Садки, П. Одебер, Р. Меалле- Рено. М.: Техносфера, 2008. 360 с.
5. Новый справочник химика и технолога. Аналитическая химия. Ч. II./ под ред. И. П. Калинкина. СПб.: Профессионал, 2002. 964 с.
6. Плэмбек Дж. Электрохимические методы анализа: пер. с англ. Дж Плэмбек. М.: Мир, 1985. 496 с.
7.Электроаналитические методы/ под ред. Ф. Шольца. М.: Бином, 2010. 328 с
Введение
В последние десятилетия была отмечена развитие промышленности и сельского хозяйства, одновременно с недостаточной политикой управления отходами водные экосистемы страдают от серьезного ущерба загрязнений, что приводит к резкому падению мировых запасов пресной воды и нанесению потенциального вреда здоровью людей. Для осуществления надлежащего регулирования выбросов промышленных сточных вод и сельскохозяйственных сточных вод требуется эффективная и надежная система мониторинга для оценки токсичности и острой токсичности сточных вод [1,2].
Для успешного решения этой задачи используют современные высокоэффективные методы химического анализа, к числу которых относятся вольтамперометрические методы. Современная вольтамперометрия – высокочувствительный и экспрессный метод определения неорганических, органических веществ, пригодный для анализа геохимических, биохимических, медицинских, фармацевтических и других объектов. Это один из наиболее универсальных методов определения следовых количеств веществ. Применение вольтамперометрических методов анализа позволяет определять концентрации веществ порядка 10-6 – 10-8 моль/л, а в ряде случаев вплоть до 10-9 – 10-10 моль/л.
Цель работы: Изучить вольтамперометрический метод анализа.
Литературый обзор
Теоретические основы вольтамперометрии
Вольтамперометрия относится к электрохимическим методам анализа и исследования, которые основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном слое. Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента и поддающийся правильному измерению, может служить аналитическим сигналом. Сигнал в индикаторной электрохимической системе формируется на границе фаз электрод-раствор и зависит от состояния поверхности электрода, которая определяется природой материала, его дефектностью и механической неоднородностью. Модифицируя поверхность электрода, можно целенаправленно изменять его свойства и достигать необходимых аналитических и метрологических характеристик вольтамперометрического определения.
1.2Основные термины и понятия в вольтамперометрии
Электрохимическая реакция – это гетерогенная реакция на электроде, при которой ионы или электроны переходя через границу раздела фаз, обуславливают протекание электрического тока.
Электрод – система, состоящая из двух контактирующих между собой электропроводящих фаз, обладающих разной формой проводимости: электронной (металл) и ионной (раствор).
Дата: 2018-12-21, просмотров: 814.