Любое вещество может находиться в трех агрегатных состояниях – га- зообразном, жидком и твердом. Изменение агрегатного состояния проис- ходит при определенных температурах. Температура перехода зависит от давления, но при постоянном давлении они вполне определенны.
Переход металла из жидкого состояния в твердое с образованием кри- сталлической структуры называется первичной кристаллизацией. Плавле- ние – процесс, обратный кристаллизации.
В природе все самопроизвольно протекающие превращения (кристал- лизация и плавление) обусловлены тем, что новые состояния в новых ус- ловиях являются энергетически более устойчивыми, обладают меньшим запасом энергии.
Энергетическое состояние системы, имеющее огромное число охва- ченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией G, называемой свободной энергией. В условиях постоянного давления:
G = U
- T × S,
2.1
где – U – внутренняя энергия системы (вещества), т. е. полная энергия, равная сумме кинетической и потенциальной энергии частиц, составляю- щих данную систему; Т – абсолютная температура в системе, S – энтро- пия, т. е. мера внутренней неупорядоченности в системе.
Чем больше свободной энергии системы, тем система менее устойчи- ва. С изменением внешних условий свободная энергия системы изменяет- ся по сложному закону, но различно для жидкого и кристаллического со- стояний. Схематический характер изменения свободной энергии жидкого и твердого состояний в зависимости от температуры показан на рис. 2.1.
| 1 |
| 2 |
| Ts |
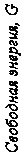 Температура, Т
Температура, Т
Рис. 2.1. Изменение свободной энергии жидкого (1) и кристаллического (2)
состояний в зависимости от температуры
Из графика видно, что при температуре ТS свободные энергии жидко- го и твердого состояний равны, металл находится в равновесии. ТS – рав- новесная или теоретическая температура кристаллизации, при которой GЖ = GТВ.
Для начала кристаллизации необходимо уменьшение свободной энер- гии системы. Охлаждение жидкости ниже равновесной температуры кри- сталлизации называется переохлаждением. Разница между равновесной ТS и реальной ТК температурой кристаллизации называется степенью переох- лаждения ∆Т. Степень переохлаждения зависит от природы металла, она увеличивается с повышением частоты металла и ростом скорости охлаж- дения. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах «Время – Температура» (рис. 2.2).
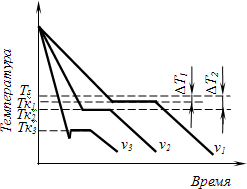
Рис. 2.2. Кривые охлаждения при кристаллизации
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры. При достижении температуры кристаллизации на кривой «температура–время» появляется горизонтальная площадка, так как отвод тепла компенсируется выделяющейся при кристаллизации скры- той теплотой кристаллизации. Жидкий металл обладает большей внутрен- ней энергией, чем твердый, поэтому при кристаллизации выделяется теп- лота. По окончании кристаллизации температура снова начинает снижать- ся и твердое кристаллическое вещество охлаждается.
Дата: 2018-12-21, просмотров: 825.