Все вещества в зависимости от температуры и давления могут нахо- диться в трех агрегатных состояниях: твердом, жидком и газообразном.
В чистых металлах при повышении температуры происходит измене- ние агрегатного состояния: при превышении температуры плавления твер- дое состояние сменяется жидким, при превышении температуры кипения жидкое состояние переходит в газообразное. Эти температуры перехода зависят от давления.
Температура плавления – особенно важная константа свойств метал- ла – колеблется для различных металлов в весьма широких пределах: от минус 38,9 °С для ртути, самого легкоплавкого металла, находящегося при комнатной температуре в жидком состоянии, до 3390 °С – для самого ту- гоплавкого металла – вольфрама.
При постоянном давлении температуры плавления, плотность и неко- торые теплофизические характеристики вполне определенны и для наибо- лее распространенных в технике металлов приведены в таблице 1.1.
В газообразном состоянии частицы вещества не связаны между собой молекулярными силами притяжения и хаотически движутся, заполняя весь возможный объем. При обычных давлениях и температурах среднее рас- стояние между молекулами в газах примерно в десять раз больше, чем в твердых телах и жидкостях. Поэтому газы имеют значительно меньшие
плотности, чем твердые тела и жидкости. При обычных температурах газы
– хорошие диэлектрики, так как их атомы и молекулы электрически ней- тральны.
При нагреве газа до высоких температур происходит его ионизация: концентрация заряженных частиц увеличивается, причем объемные плот- ности положительных и отрицательных электрических зарядов заряжен- ных частиц становятся практически одинаковыми. Термически ионизиро- ванный газ отличается от обычного газа рядом особенностей, позволяю- щих считать его четвертым (после твердого, жидкого и газообразного) со- стоянием вещества – плазмой. В технике широкое применение получила
«холодная» или низкотемпературная плазма (~103–104 К).
Таблица 1.1
Плотность, теплоемкость, температура плавления и теплота плавления некоторых металлов
| Металл | Плотность, 103 кг/м3 | Теплоемкость, кДж/(кг*град) при 20 °С | Температура плавления, qпл , °С | Теплота плавления, L, кДж/кг |
| Алюминий | 1,738 | 0,88 | 658,7 | 0,32–0,39 |
| Вольфрам | 19,35 | 0,24 | 3420 | – |
| Железо | 7,874 | 0,45 | 1539 | 0,293 |
| Кобальт | 8,90 | 0,45 | 1493 | – |
| Магний | 1,848 | 1,3 | 651 | 0,373 |
| Медь | 8,96 | 0,39 | 1083 | 0,214 |
| Никель | 8,91 | 0,46 | 1453 | 0,24–0,30 |
| Олово | 7,29 | 0,23 | 231,9 | 0,059 |
| Свинец | 11,35 | 0,13 | 327,3 | 0,0225 |
| Сталь | 7,7–7,9 | 0,46 | 1300–1400 | 0,205 |
| Чугун | 7,0 | 0,5 | 1100–1200 | 0,096–0,14 |
Жидкости представляют собой вещества в конденсированном агрегат- ном состоянии, промежуточном между твердым и газообразном. Жидко- сти подобно твердым телам обладают малой сжимаемостью и большой плотностью, но в то же время подобно газам не обладают упругостью формы и легко текут.
В жидкостях среднее расстояние между молекулами сравнимо с раз- мерами самих молекул (~10 Нм = 10–10 м), поэтому силы межмолекуляр- ного взаимодействия весьма значительны. Подобно частицам твердого те- ла молекулы жидкости совершают тепловые колебания около некоторых положений равновесия. Однако если в твердых телах эти положения рав- новесия неизменны (т. е. имеет место дальний порядок), то в жидкостях
они время от времени изменяются: по истечении некоторого времени мо- лекула жидкости перескакивает в новое положение равновесия, перемеща- ясь на расстояние, сравнимое с расстоянием между молекулами.
Эти перемещения молекул жидкости обусловливают ее текучесть. Та- ким образом, несмотря на то, что в жидкостях не соблюдается дальний по- рядок, как у твердых тел, для них имеет место «ближний порядок»: в среднем для каждой молекулы жидкости число ближайших соседей и их взаимное расположение одинаковы. Ψσρδ см3
В твердом состоянии физические тела характеризуются стабильно- стью формы. При изменении формы в твердых телах возникают упругие силы, препятствующие этому изменению. В твердых телах элементарные частицы (атомы, молекулы или ионы) совершают малые тепловые колеба- ния около некоторых фиксированных положений равновесия, т. е. имеет место «дальний порядок», вследствие которого элементарные частицы твердого тела могут располагаться по узлам кристаллических решеток.
Правильное регулярное расположение атомов в твердом теле, характе- ризующееся периодической повторяемостью в трех измерениях, образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, на- зывают твердыми телами. Металлы являются телами кристаллическими.
Наиболее простой кристаллической решеткой у металлов является ку- бическая, имеющая две разновидности: кубическую объемноцентрирован- ную (ОЦК) и кубическую гранецентрированную (ГЦК).
а






| b |











| с |
с
а) б) в)
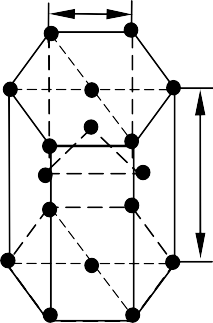
Рис. 1.3. Кристаллические решетки:
а) кубическая объемно–центрированная (ОЦК), б) кубическая гранецентрированная (ГЦК),
в) гексагональная плотноупакованная (ГПУ)
У обоих типов этих решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах. Остальные атомы нахо- дятся или в центре объема куба (1 атом на пересечении диагоналей в ре- шетке ОЦК), или в центре каждой из его граней (6 атомов в решетке ГЦК). Кристаллические решетки ОЦК имеют альфа-железо (Feα), хром, ванадий, вольфрам и другие металлы. Решетку ГЦК имеют гамма-железо (Feγ), алюминий, медь, никель и другие металлы.
Другой разновидностью кристаллических решеток у металлов являет- ся гексагональная плотноупакованная решетка (ГПУ). Ячейка этой решет- ки представляет собой шестигранную призму с центрированными основа- ниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. ГПУ решетку имеют магний, цинк, бериллий и другие металлы (рис. 1.3).
Плоскости, параллельные координатным плоскостям и находящиеся на расстоянии а, в, с, разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед на- зывают элементарной ячейкой. Вершины параллелепипеда называют уз- лами пространственной решетки. Размер элементарной ячейки оценива- ют отрезками а, в, с. Их называют периодами решетки. Дополнительными характеристиками кристаллической решетки являются координационное число и коэффициент компактности.
Координационное число К – число ближайших равноудаленных частиц (атомов) от любого атома в кристаллической решетке (для ОЦК – К8, для ГЦК – К12). Коэффициент компактности – отношение объема всех частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки (для ОЦК – 0,68, для ГЦК – 0,74).
Упорядоченность расположения атомов в кристаллической решетке позволяет четко выделить кристаллографические направления и плоскости (рис. 1.4). Кристаллографические направления – лучи, выходящие из ка- кой-нибудь точки отсчета, вдоль которых на определенном расстоянии друг от друга располагаются атомы.
Точками отсчета могут служить вершины куба, при этом кристалло- графическими направлениями являются его ребра и диагонали грани.

| z |
| (111) |
| (110) |
| (010) |
| y |
| ] |
| x |
 z (001)
z (001)
(010)
[ 010 ]
x
(100)
y
[110
Рис. 1.4.Основные кристаллографические направления и плоскости
Кристаллографические плоскости – плоскости, на которых лежат атомы, например, грани куба или его диагональной плоскости. Кристалло- графические направления и плоскости принято обозначать индексами Миллера. Для определения индекса какого–либо направления следует най- ти координаты ближайшего к точке отсчета атома, лежащего на этом на- правлении, выраженные через параметр решетки.
Пример. Координаты ближайшего атома вдоль оси ох выразятся через
100. Этими цифрами принято обозначать индекс направления вдоль оси ох и параллельных ему направлениях [100]. Индексы направлений вдоль оси оу и оz и параллельных им направлений выразятся соответственно через
[010] и [001], а направления вдоль диагонали грани хоz, хоу, уоz и диаго- нали куба получат индексы соответственно [101], [110], [011], [111].
Для определения индекса кристаллографической плоскости следует вначале найти координаты ближайших точек ее пересечения с осями коор- динат, проведенными из точки отсчета 0. Затем обратные величины най- денных координат следует записать в обычной последовательности в круглых скобках. Использование понятий о кристаллографических на- правлениях и плоскостях и об их индексах позволяет описывать различные явления, происходящие в кристаллических телах, а также особенности свойств кристаллических тел вдоль различных направлений и плоскостей.
Физические и прочностные свойства металлов вдоль различных кри- сталлографических направлений зависят от числа атомов, расположенных на этих направлениях. В действительности в кристаллической решетке на различных направлениях находится разное число атомов. Например, в ку- бических решетках (рис. 1.4) вдоль диагонали куба ОЦК решетки [111] или диагонали грани решетки ГЦК [110], [101], [011] размещается больше атомов, чем по направлениям вдоль ребер кубов [100], [010], [001].
Из этого следует, что в кристаллических веществах должна наблю- даться анизотропия, т. е. неодинаковость свойств вдоль различных кри- сталлографических направлениях.
Анизотропия – это зависимость свойств кристалла от направления, возникающая в результате упорядоченного расположения атомов в про- странстве. Анизотропия механических и других свойств наблюдается при испытании образцов, вырезанных вдоль различных кристаллографических направлений. Не всем свойствам кристаллических тел присуще явление анизотропии, так, например, теплоемкость, от направления не зависит.
Анизотропия проявляется только в пределах одного кристаллического зерна. Реальные металлы являются телами поликристаллическими, со- стоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями и плоскостями.
В связи с этим, недостаток какого-либо свойства по одному из направ- лений приложения силы в одних зернах компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются изотропными телами, т. е. телами с примерно одинако- выми свойствами по всем направлениям.
Дата: 2018-12-21, просмотров: 861.