Пентозофосфатный путь представляет собой прямое окисление глюкозы и протекает в цитоплазме клеток. Наибольшая активность ферментов пентозофосфатного пути обнаружена в клетках печени, жировой ткани, коры надпочечников, молочной железы в период лактации, зрелых эритроцитах. Низкий уровень этого процесса выявлен в скелетных и сердечной мышцах, мозге, щитовидной железе, легких.
Пентозофосфатный путь называют также апотомическим путём, так как в его реакциях происходит укорочение углеродной цепи гексозы на один атом, который включается в молекулу СО2.
Пентозофосфатный путь выполняет в организме две важнейшие метаболические функции: он является главным источником НАДФН для синтеза жирных кислот, холестерола, стероидных гормонов, микросомального окисления; в эритроцитах НАДФН используется для восстановления глутатиона – вещества, препятствующего пероксидному гемолизу; он является главным источником пентоз для синтеза нуклеотидов, нуклеиновых кислот, коферментов (АТФ, НАД, НАДФ, КоА-SН и др.).
В пентозофосфатном пути можно выделить две фазы - окислительную и неокислительную. Исходным субстратом окислительной фазы является глюкозо-6-фосфат, который непосредственно подвергается дегидрированию с участием НАДФ-зависимой дегидрогеназы. Продукт реакции гидролизуется (реакция 2), а образующийся 6-фосфоглюконат дегидрируется и декарбоксилируется (реакция 3). Таким образом, происходит укорочение углеродной цепи моносахарида на один углеродный атом («апотомия»), и образуется рибулозо-5-фосфат.
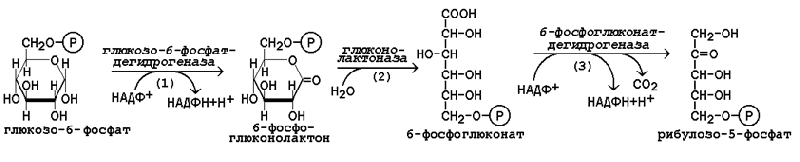 Рисунок 1. Реакции окислительной фазы пентозофосфатного пути.
Неокислительная фаза пентозофосфатного пути начинается с реакций изомеризации. В ходе этих реакций одна часть рибулозо-5-фосфата изомеризуется в рибозо-5-фосфат, другая - в ксилулозо-5-фосфат (рисунок 16.2, реакции 4 и 5).
Рисунок 1. Реакции окислительной фазы пентозофосфатного пути.
Неокислительная фаза пентозофосфатного пути начинается с реакций изомеризации. В ходе этих реакций одна часть рибулозо-5-фосфата изомеризуется в рибозо-5-фосфат, другая - в ксилулозо-5-фосфат (рисунок 16.2, реакции 4 и 5).
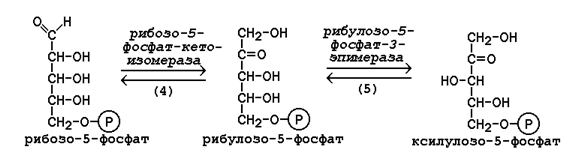 Рисунок 2. Реакции изомеризации рибулозо-5-фосфата.
Следующая реакция протекает при участии фермента транскетолазы, коферментом которой является тиаминдифосфат (производное витамина B1). В этой реакции происходит перенос двухуглеродного фрагмента с ксилулозо-5-фосфата на рибозо-5-фосфат: Рисунок 2. Реакции изомеризации рибулозо-5-фосфата.
Следующая реакция протекает при участии фермента транскетолазы, коферментом которой является тиаминдифосфат (производное витамина B1). В этой реакции происходит перенос двухуглеродного фрагмента с ксилулозо-5-фосфата на рибозо-5-фосфат:
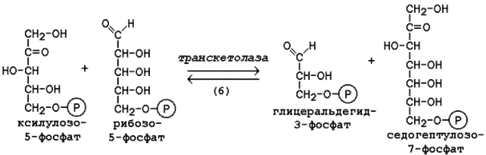 Образовавшиеся продукты взаимодействуют между собой в реакции, которая катализируется трансальдолазой и заключается а переносе остатка дигидроксиацетона на глицеральдегид-3-фосфат.
Образовавшиеся продукты взаимодействуют между собой в реакции, которая катализируется трансальдолазой и заключается а переносе остатка дигидроксиацетона на глицеральдегид-3-фосфат.
 Продукт этой реакции эритрозо-4-фосфат участвует во второй транскетолазной реакции вместе со следующей молекулой ксилулозо-5-фосфата: Продукт этой реакции эритрозо-4-фосфат участвует во второй транскетолазной реакции вместе со следующей молекулой ксилулозо-5-фосфата:
 Таким образом, три молекулы пентозофосфатов в результате реакций неокислительной стадии превращаются в две молекулы фруктозо-6-фосфата и одну молекулу глицеральдегид-3-фосфата. Фруктозо-6-фосфат может изомеризоваться в глюкозо-6-фосфат, а глицеральдегид-3-фосфат может подвергаться окислению в гликолизе или изомеризоваться в дигидроксиацетонфосфат. Последний вместе с другой молекулой глицеральдегид-3-фосфата может образовывать фруктозо-1,6-дифосфат, который также способен переходить в глюкозо-6-фосфат.
Посредством пентозофосфатного пути может происходить полное окисление глюкозо-6-фосфата до шести молекул СО2. Все эти молекулы образуются из С-1-атомов шести молекул глюкозо-6-фосфата, а из образовавшихся при этом шести молекул рибулозо-5-фосфата снова регенерируются пять молекул глюкозо-6-фосфата: Таким образом, три молекулы пентозофосфатов в результате реакций неокислительной стадии превращаются в две молекулы фруктозо-6-фосфата и одну молекулу глицеральдегид-3-фосфата. Фруктозо-6-фосфат может изомеризоваться в глюкозо-6-фосфат, а глицеральдегид-3-фосфат может подвергаться окислению в гликолизе или изомеризоваться в дигидроксиацетонфосфат. Последний вместе с другой молекулой глицеральдегид-3-фосфата может образовывать фруктозо-1,6-дифосфат, который также способен переходить в глюкозо-6-фосфат.
Посредством пентозофосфатного пути может происходить полное окисление глюкозо-6-фосфата до шести молекул СО2. Все эти молекулы образуются из С-1-атомов шести молекул глюкозо-6-фосфата, а из образовавшихся при этом шести молекул рибулозо-5-фосфата снова регенерируются пять молекул глюкозо-6-фосфата:
 Таким образом, полное окисление 1 молекулы глюкозы в пентозофосфатном пути сопровождается восстановлением 12 молекул НАДФ.
Таким образом, полное окисление 1 молекулы глюкозы в пентозофосфатном пути сопровождается восстановлением 12 молекул НАДФ.
|
| Глюконеогенез. |
| Глюконеогенез - биосинтез глюкозы из различных соединений неуглеводной природы. Биологическая роль глюконеогенеза заключается в поддержании постоянного уровня глюкозы в крови, что необходимо для нормального энергообеспечения тканей, для которых характерна непрерывная потребность в углеводах. Особенно это касается центральной нервной системы. Роль глюконеогенеза возрастает при недостаточном поступлении углеводов с пищей. Так, в организме голодающего человека может синтезироваться до 200 г глюкозы в сутки. Глюконеогенез быстрее, чем другие метаболические процессы, реагирует на изменения диеты: введение с пищей большого количества белков и жиров активизирует процессы глюконеогенеза; избыток углеводов, наоборот, тормозит новообразование глюкозы. Интенсивные физические нагрузки сопровождаются быстрым истощением запасов глюкозы в организме. В этом случае глюконеогенез является основным путём пополнения углеводных ресурсов, предупреждая развитие гипогликемии. Глюконеогенез в организме тесно связан также с процессами обезвреживания аммиака и поддержанием кислотно-основного баланса.
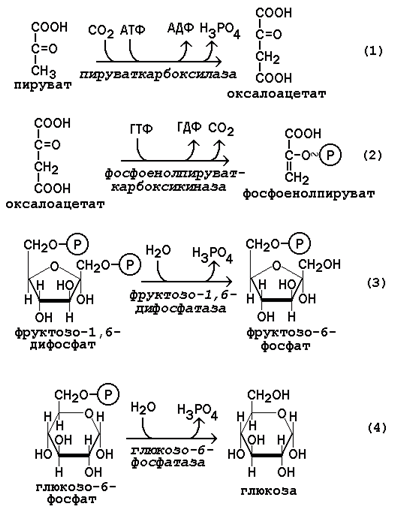
Основным местом биосинтеза глюкозы de novo является печень. Глюконеогенез протекает также в корковом слое почек. Принято считать, что вклад почек в глюконеогенез в физиологических условиях составляет около 10% глюкозы, синтезируемой в организме; при патологических состояниях эта доля может значительно возрастать. Незначительная активность ферментов глюконеогенеза обнаружена в слизистой тонкого кишечника. Последовательность реакций глюконеогенеза представляет собой обращение соответствующих реакций гликолиза. Лишь три реакции гликолиза необратимы вследствие происходящих в ходе их значительных энергетических сдвигов: а) фосфорилирование глюкозы; б) фосфорилирование фруктозо-6-фосфата; в) превращение фосфоенолпирувата в пируват. Обход этих энергетических барьеров обеспечивают ключевые ферменты глюконеогенеза. Обратный переход пирувата в фосфоенолпируват требует участия двух ферментов. Первый из них – пируваткарбоксилаза - катализирует реакцию образования оксалоацетата (рисунок 16.4, реакция 1). Коферментом пируваткарбоксилазы является биотин (витамин Н). Реакция протекает в митохондриях. Роль её заключается также в пополнении фонда оксалоацетата для цикла Кребса. Все последующие реакции глюконеогенеза протекают в цитоплазме. Мембрана митохондрий непроницаема для оксалоацетата, и он переносится в цитоплазму в виде других метаболитов: малата или аспартата. В цитоплазме указанные соединения вновь переходят в оксалоацетат. При участии фосфоенолпируваткарбоксикиназы из оксалоацетата образуется фосфоенолпируват( реакция 2). Фосфоенолпируват в результате обращения ряда реакций гликолиза переходит во фруктозо-1,6-дифосфат. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализируетсяфруктозодифосфатазой (реакция 3). Фруктозо-6-фосфат изомеризуется в глюкозо-6-фосфат. Заключительной реакцией глюконеогенеза является гидролиз глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатазы (реакция 4).
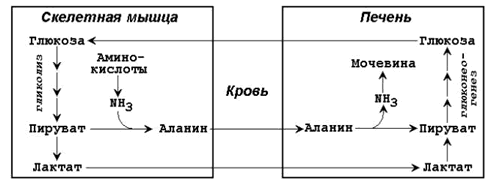
Рисунок 4. Обходные реакции глюконеогенеза. Основными источниками глюкозы в глюконеогенезе являются лактат, аминокислоты, глицерол и метаболиты цикла Кребса. Лактат – конечный продукт анаэробного окисления глюкозы. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции. При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори (рисунок 5).
Рисунок 5. Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
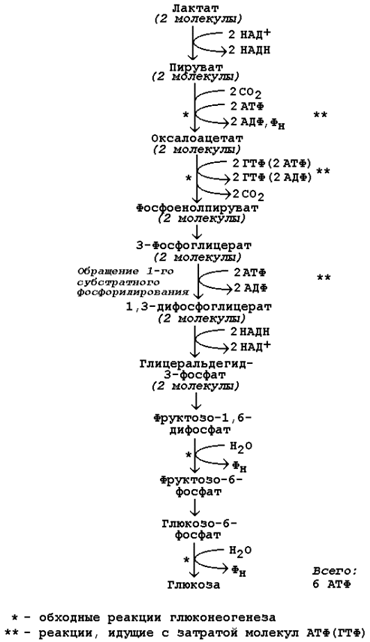
Глюкогенные аминокислоты, к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину, который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл, подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин – глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает. Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез. Глицерол – продукт гидролиза липидов в жировой ткани. Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат – промежуточный продукт гликолиза и может быть использован в глюконеогенезе. Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы. Энергетический баланс. Путь синтеза глюкозы из пирувата содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ: а) образование оксалоацетата из пирувата (затрачивается молекула АТФ); б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ); в) обращение первого субстратного фосфорилирования – образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ). Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6) используются 2 молекулы пирувата (С3). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет – 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.
Рисунок 6. Энергетический баланс биосинтеза глюкозы из лактата. Регуляция глюконеогенеза. Скорость глюконеогенеза определяется доступностью субстратов – предшественников глюкозы. Увеличение концентрации в крови любого из предшественников глюкозы приводит к стимуляции глюконеогенеза. Некоторые метаболиты являются аллостерическими эффекторами ферментов глюконеогенеза. Например, ацетил-КоА в повышенных концентрациях аллостерически активирует пируваткарбоксилазу, катализирующую первую реакцию глюконеогенеза. Аденозинмонофосфат, наоборот, оказывает ингибирующее действие на фруктозодифосфатазу, а избыток глюкозы ингибирует глюкозо-6-фосфатазу. Гормон поджелудочной железы глюкагон, гормоны надпочечников адреналин и кортизол повышают скорость биосинтеза глюкозы в организме, увеличивая активность ключевых ферментов глюконеогенеза либо увеличивая концентрацию этих ферментов в клетках. Гормон поджелудочной железы инсулин способствует снижению скорости глюконеогенеза в организме. | |
Биосинтез гликогена.
Гликоген – биополимер, состоящий из остатков глюкозы, он является компонентом всех тканей животных и человека (см. рисунок 15.1). Этот полисахарид служит основным источником энергии и резервом углеводов в организме.
Содержание гликогена в различных органах зависит от физиологического состояния организма. Наиболее высокое содержание гликогена обнаруживается в печени (от 2 до 6% от массы органа). Хотя концентрация гликогена в мышцах значительно ниже (от 0,5 до 1,5%), однако в норме его количество в мышцах составляет 2/3 от общего его содержания в организме.
Гликоген отличается значительным разнообразием по структуре и по относительной молекулярной массе. Молекулы его ветвисты. Глюкозные остатки образуют цепи, в которых они связаны между собой α-1,4-гликозидными связями. Разветвления образуются при помощи α-1,6-гликозидных связей.
Большая часть глюкозы, поступающей в организм с пищей, превращается в клетках печени в гликоген. Это связано с тем, что накопление легко растворимой глюкозы в клетках привело бы к резкому увеличению осмотического давления и разрушению клеточной мембраны.
Молекула глюкозы фосфорилируется при участии фермента глюкокиназы (в гепатоцитах) или гексокиназы (в других клетках) с образованием глюкозо-6-фосфата. Этот метаболит под влиянием фосфоглюкомутазы превращается в глюкозо-1-фосфат (рисунок 16.7, реакция 1).
Глюкозо-1-фосфат взаимодействует с уридинтрифосфатом (УТФ) в присутствии фермента УДФ-глюкозо-пирофосфорилазы с образованием УДФ-глюкозы – ключевого метаболита углеводного обмена (рисунок 7, реакция 2).
Перенос глюкозного остатка с УДФ-глюкозы на затравочную полисахаридную цепь осуществляет гликогенсинтаза – регуляторный фермент данного метаболического пути (рисунок 7, реакция 3).
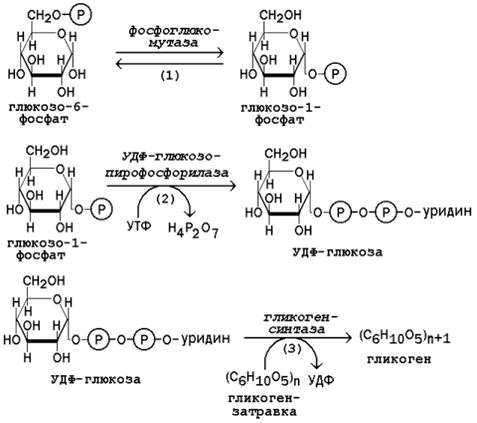
Рисунок 7. Реакции биосинтеза гликогена.
Гликогенсинтаза существует в двух формах: гликогенсинтаза b (неактивная) и гликогенсинтаза а (активная). Превращение формы а в форму b катализируется цАМФ-зависимой протеинкиназой, обратный процесс – протеинфосфатазой.
Образование α-1,6-гликозидных связей в молекуле гликогена катализирует ветвящий фермент или трансглюкозидаза (рисунок 8) .
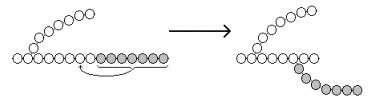
Рисунок 8. Образование α-1,6-гликозидных связей в молекуле гликогена.
| Мобилизация гликогена и гликогенолиз. |
Мобилизация, или распад гликогена – процесс превращения. Первую реакцию внутриклеточного расщепления гликогена катализирует фермент фосфорилаза гликогена (рисунок 9, реакция 1). Простетической группой его является пиридоксальфосфат (производное витамина В6). Фосфорилаза гликогена – регуляторный фермент, он существует в двух формах: фосфорилаза а (активная) и фосфорилаза b (неактивная).
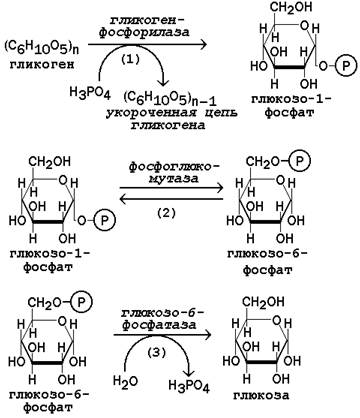 Рисунок 9. Реакции мобилизации гликогена.
Переход фосфорилазы b в фосфорилазу акатализирует киназа фосфорилазы, которая фосфорилирует неактивный фермент.
Превращение фосфорилазы а в фосфорилазу b катализирует протеинфосфатаза, которая осуществляет дефосфорилирование активного фермента. Следует отметить, что ускорение процессов мобилизации гликогена происходит одновременно с торможением его биосинтеза, и наоборот. Активацию фосфорилазы гликогена вызывают гормоны адреналин и глюкагон.
Фосфорилаза расщепляет в молекуле гликогена лишь α-1,4-гликозидные связи. Расщепление α-1,6-гликозидных связей осуществляется амило-1,6-гликозидазой гидролитически с образованием свободной глюкозы. Глюкозо-1-фосфат, образующийся в фосфорилазной реакции, при участии уже известного Вам фермента фосфоглюкомутазы переходит в глюкозо-6-фосфат (рисунок 9, реакция 2).
Дальнейшая судьба глюкозо-6-фосфата, образовавшегося при распаде гликогена, в разных тканях различна.
Как уже упоминалось, в печени и почках имеется фермент глюкозо-6-фосфатаза, отщепляющая фосфат от глюкозо-6-фосфата (рисунок 16.9, реакция 3). Образовавшаяся глюкоза диффундирует в кровь, откуда поглощается клетками организма и служит для них источником энергии.
В мышечной ткани фермент глюкозо-6-фосфатаза отсутствует. Поэтому глюкозо-6-фосфат, образовавшийся при распаде гликогена, подвергается дальнейшему превращению по гликолитическому пути с образованием лактата (этот процесс называется гликогенолизом). Образующийся в реакциях субстратного фосфорилирования АТФ используется в процессах мышечного сокращения. Таким образом, гликоген мышц является резервом энергии только для мышечной ткани.
Рисунок 9. Реакции мобилизации гликогена.
Переход фосфорилазы b в фосфорилазу акатализирует киназа фосфорилазы, которая фосфорилирует неактивный фермент.
Превращение фосфорилазы а в фосфорилазу b катализирует протеинфосфатаза, которая осуществляет дефосфорилирование активного фермента. Следует отметить, что ускорение процессов мобилизации гликогена происходит одновременно с торможением его биосинтеза, и наоборот. Активацию фосфорилазы гликогена вызывают гормоны адреналин и глюкагон.
Фосфорилаза расщепляет в молекуле гликогена лишь α-1,4-гликозидные связи. Расщепление α-1,6-гликозидных связей осуществляется амило-1,6-гликозидазой гидролитически с образованием свободной глюкозы. Глюкозо-1-фосфат, образующийся в фосфорилазной реакции, при участии уже известного Вам фермента фосфоглюкомутазы переходит в глюкозо-6-фосфат (рисунок 9, реакция 2).
Дальнейшая судьба глюкозо-6-фосфата, образовавшегося при распаде гликогена, в разных тканях различна.
Как уже упоминалось, в печени и почках имеется фермент глюкозо-6-фосфатаза, отщепляющая фосфат от глюкозо-6-фосфата (рисунок 16.9, реакция 3). Образовавшаяся глюкоза диффундирует в кровь, откуда поглощается клетками организма и служит для них источником энергии.
В мышечной ткани фермент глюкозо-6-фосфатаза отсутствует. Поэтому глюкозо-6-фосфат, образовавшийся при распаде гликогена, подвергается дальнейшему превращению по гликолитическому пути с образованием лактата (этот процесс называется гликогенолизом). Образующийся в реакциях субстратного фосфорилирования АТФ используется в процессах мышечного сокращения. Таким образом, гликоген мышц является резервом энергии только для мышечной ткани.
|
3. Механизмы образования глицерина, насыщенных и ненасыщенных жирных кислот.
Биосинтез жирных кислот осуществляется в цитоплазме эукариотических клеток, у животных — в основном в клетках печени, жировой ткани, почек, легких. Непосредственным предшественником их синтеза является малонил-СоА, который образуется из ацетил-СоА. В свою очередь, основное количество ацетил-СоА образуется в матриксе митохондрий при окислительном декарбоксилировании пирувата, в процессе b-окисления жирных кислот, при расщеплении углеродных скелетов аминокислот. Будучи заряженным соединением, ацетил-СоА не может преодолеть мембранный барьер митохондрий, и для транспорта ацетильных групп в цитоплазму существует специальный «челночный механизм». С помощью этого механизма ацетильные компоненты попадают в цитоплазму в составе цитрата, который расщепляется, образуя ацетил-СоА (при участии АТР и СоА) и оксалоацетат. Последний восстанавливается в малат и возвращается в матрикс митохондрий, где регенерируется цитрат.
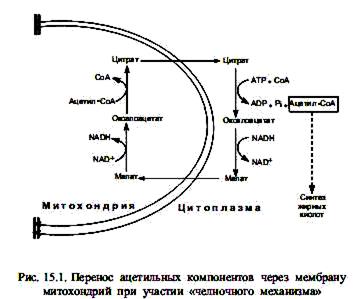
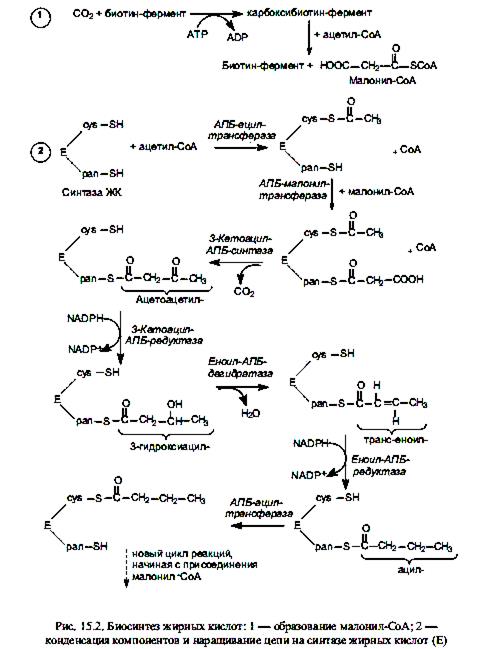
Оказавшись в цитоплазме, ацетил-СоА подвергается карбоксилированию с участием ключевого фермента биосинтеза жирных кислот—ацетил-СоА-карбоксилазы. В результате этой АТР-зависимой реакции формируется малонил-СоА. Простетической группой ацетил-СоА-карбоксилазы служит биотин. Он выполняет роль «подвижной руки», переносящей СО2 на молекулу ацетил-СоА. Реакция осуществляется в две стадии. Стадия образования малонил-СоА лимитирует скорость всего процесса синтеза жирных кислот, поскольку на уровне ацетил-СоА-карбоксилазы осуществляется регуляция данного пути: основным аллостерическим активатором фермента является цитрат. Этот метаболит образуется в митохондриях в большом количестве, когда там много ацетил-СоА, т. е. ЦТК перегружен «топливом», и его избыток должен запасаться в виде триацилглицеролов. В таком случае цитрат выходит в цитоплазму, выступая там одновременно в роли донора ацетил-СоА и активатора ацетил-СоА-карбоксилазы. Связывание цитрата с неактивными мономерами ацетил-СоА-карбоксилазы приводит к их соединению в нитевидный олигомер, который приобретает функциональную активность. Кроме этого, активность ацетил-СоА-карбоксилазы регулируется в ходе ковалентной модификации: понижается при фосфорилировании и повышается при дефосфорилировании.
Ненасыщенные жирные кислоты синтезируются из насыщенных с соответствующей длиной цепи. Образование двойной связи у аэробных организмов катализируется ферментом ацил-СоА-оксигеназой, и окисление происходит согласно реакции
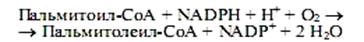
В этом процессе одновременно окисляются два разных субстрата: жирная кислота (возникает двойная связь) и NADPH, его катализируют монооксигеназы, называемые десатуразами. Известен и другой механизм образования двойных связей в молекулах жирных кислот, не требующий участия молекулярного кислорода. Например, в клетках E.coli синтез пальмитолеиновой кислоты начинается еще на синтазе жирных кислот со стадии образования двойной связи в составе С10-фрагмента. В этой реакции принимает участие особый фермент, присутствующий в клетках кишечной палочки,—b-оксидеканоилтиоэфирдегидратаза, который катализирует формирование цис-b,g-двойной связи, а не транс-a,b-, как это имеет место на стадии образования еноил-производного при синтезе насыщенных жирных кислот. Затем происходит удлинение ненасыщенного фрагмента до С16- и С18-производных.
У животных и растений введение в молекулу насыщенной жирной кислоты первой двойной связи осуществляется в цитозоле довольно легко. Образование дополнительных двойных связей у растений происходит в эндоплазматическом ретикулуме, а у животных не происходит вообще.
Поэтому полиненасыщенные жирные кислоты (линолевая, линоленовая) являются для животных, в частности млекопитающих, незаменимыми компонентами и должны поступать в организм с пищей (растительного происхождения). Эти жирные кислоты служат субстратами для построения других полиненасыщенных жирных кислот. Недостаток линолевой и леноленовой кислот в рационе животных приводит к торможению роста, поражению кожных покровов и почек, нарушению функции размножения.
Биосинтез липидов в клетках эукариот осуществляется на мембранах гладкого эндоплазматического ретикулума. Большинство ферментов, принимающих участие в этих процессах, ассоциированы с его мембранами и представляют собой липопротеины.
Основными предшественниками для синтеза нейтральных липидов (триацилглицеролов), а также полярных фосфо- и гликолипидов служат активированные жирные кислоты и глицерол-3-фосфат. Активация жирных кислот происходит в следующей реакции:
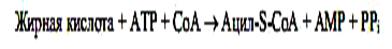
Глицерол-3-фосфат образуется либо при прямом фосфорилировании за счет АТР при участии глицеролкиназы, либо при восстановлении промежуточного продукта гликолиза — дигидроксиацетон-3-фосфата ферментом 3-глицерофосфатдегидрогеназой, использующей в качестве кофермента NADH.
Биосинтез неполярных липидов. Если биосинтез триацилглицеролов осуществляется de novo (из глицеролфосфата и жирных кислот), то на первой стадии происходит последовательное ацилирование двух свободных гидроксильных групп молекулы глицерол-3-фосфата (рис. 15.3). При этом в реакции этерификации СоА-эфиром жирной кислоты по первому атому углерода глицерол-3-фосфата вначале формируется моноацилглицерол-3-фосфат (лизофосфатид), а затем — диацилглицерол-3-фосфат (фосфатидат).
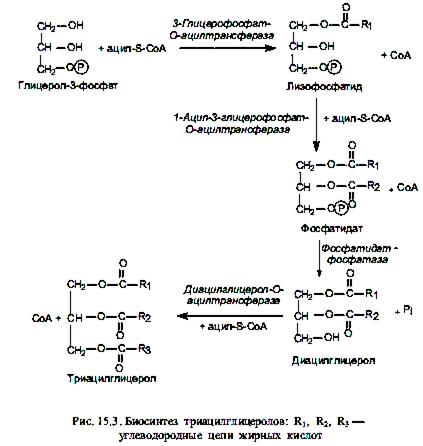
На следующей стадии происходит гидролитическое отщепление фосфатной группы от молекулы фосфатидата и образуется 1, 2-диацилглицерол, который взаимодействует с третьим СоА-производным жирной кислоты, в результате чего формируется триацилглицерол (триглицерид).
Кроме описанной схемы, синтез нейтральных липидов может осуществляться с участием в качестве предшественников продуктов расщепления липидов, попадающих в организм с пищей. Эти процессы особенно интенсивны в слизистой кишечника животных. Нейтральные жиры расщепляются в пищеварительном тракте панкреатическими липазами до жирных кислот и 2-моноацилглицеролов, которые всасываются слизистой кишечника. В клетках слизистой оболочки происходит последовательное ацилирование 2-моноацилглицерола СоА-эфирами жирных кислот с образованием триацилглицеролов. Эти реакции катализируют особые ацилтрансферазы.
Триглицериды, как уже отмечалось, являются основными запасными веществами в клетках животных и некоторых других организмов. Особое значение они имеют для впадающих в спячку и мигрирующих на далекие расстояния животных. Например, верблюды запасают триацилглицеролы в горбу и используют их как источник воды, которая образуется при окислении. У полярных животных (тюленей, моржей и др.) триглицериды часто выполняют функцию теплоизолятора. Некоторые животные используют неполярные липиды для регулирования плавучести. Например, в спермацетовом мешке кашалотов находится несколько тонн триацилглицеролов, содержащих в составе молекул ненасыщенные жирные кислоты. Плотность (консистенция) этих триглицеридов зависит от температуры среды: повышается при понижении температуры. Питаясь кальмарами, кашалоты заплывают на большие глубины, где температура воды ниже обычной. Это индуцирует кристаллизацию триглицеридов, увеличивается их плотность соответственно увеличению плотности морской воды на глубине, и животное, не прибегая к дополнительным усилиям, может долго оставаться на большой глубине.
Образование углеводов из продуктов глиоксилатного цикла.
Глиоксила́тный цикл , или глиоксила́тный шунт — анаболический путь, имеющийся у растений, бактерий, протистов и грибов, представляет собой видоизменённый цикл трикарбоновых кислот. Глиоксилатный цикл служит для превращения ацетил-СоА в сукцинат, который далее используется для синтеза углеводов. У микроорганизмов он обеспечивает утилизацию простых углеродных соединений в качестве источника углерода, когда более сложные источники, например, глюкоза, недоступны, а также может считаться одной из анаплеротических реакций цикла трикарбоновых кислот, восполняющей количества сукцината и малата. Считается, что у животных глиоксилатный цикл отсутствует (подтверждённое исключение составляют нематоды на ранних стадиях своего эмбриогенеза), однако в последние годы в некоторых тканях животных были обнаружены ключевые ферменты цикла — малатсинтаза и изоцитратлиаза.
Ферменты и реакции глиоксилатного цикла были открыты Хансом Корнбергом и Хансом Адольфом Кребсом.
У растений, некоторых беспозвоночных и некоторых микроорганизмов (в том числе бактерии Escherichia coli и дрожжей) ацетат может служить как источником энергии, так и предшественником фосфоенолпирувата, который далее используется для синтеза углеводов. У этих организмов ферменты глиоксилатного цикла катализируют превращение ацетата в сукцинат:
2 Ацетил-СоА + NAD+ + 2H2O → сукцинат + 2СоА + NADH + H+.
В ходе глиоксилатного цикла ацетил-СоА соединяется с оксалоацетатом с образованием цитрата, а цитрат превращается в изоцитрат, как и в цикле трикарбоновых кислот. Однако следующим шагом является не отщепление от изоцитрата водорода ферментом изоцитратдегидрогеназой, а расщепление изоцитрата на сукцинат и глиоксилат под дейстствием изоцитратлиазы. Глиоксилат после этого конденсируется со второй молекулой ацетил-СоА, образуя малат под действием малатсинтазы, а сукцинат покидает цикл. Малат далее окисляется в оксалоацетат, который может соединиться с новой молекулой ацетил-СоА и начать новый оборот цикла. В ходе каждого оборота глиоксилатного цикла используются две молекулы ацетил-СоА и образуется одна молекула сукцината, который в дальнейшем может использоваться в биосинтетических процессах. Сукцинат может быть преобразован через фумарат и малат в оксалоацетат, который далее может превратиться в фосфоенолпируват под действием фосфоенолпируваткарбоксикиназы, а фосфоенолпируват в ходе глюконеогенеза даёт глюкозу. У животных глиоксилатный цикл не происходит, и в связи с этим они неспособны получать глюкозу из липидов (ацетил-СоА образуется при β-окислении жирных кислот).
У растений ферменты глиоксилатного цикла находятся в мембраносвязанных органеллах — глиоксисомах, представляющих собой специализированные пероксисомы (названы по протекающему в них циклу). Ферменты, одновременно участвующие и в цикле трикарбоновых кислот, и в глиоксилатном цикле, имеют по два изофермента, один из которых локализуется в митохондриях, а другой — в глиоксисомах. Глиоксисомы не присутствуют постоянно во всех растительных тканях. Они образуются в богатых липидами семенах при их прорастании, ещё до того, как развивающееся растение сможет само образовывать глюкозу в ходе фотосинтеза. Кроме ферментов глиоксилатного цикла, в глиоксисомах находятся все ферменты, необходимые для деградации жирных кислот, запасённых к семенах. Ацетил-СоА, образующийся при β-окислении жирных кислот, превращается в сукцинат в ходе глиоксилатного цикла, и сукцинат транспортируется в митохондрии, где он вовлекается в цикл трикарбоновых кислот и превращается в малат. Цитозольный изофермент малатдегидрогеназы окисляет малат до оксалоацетата, который в свою очередь может превратиться в фосфоенолпируват. Последний вовлекается в глюконеогенез и даёт в конечном итоге глюкозу. Таким образом, прорастающее семя может переводить углерод, запасённый в липидах, в глюкозу.
У грибов ферменты глиоксилатного цикла локализуются в пероксисомах. У некоторых патогенных грибов глиоксилатный цикл может служить для совершенно других целей. Концентрация двух ключевых ферментов цикла — изоцитратлиазы и малатсинтазы — значительно возрастает при контакте гриба с человеком, которого этот гриб поражает. У некоторых видов таких грибов мутанты, лишённые изоцитратлиазы, имеют сниженную вирулентность по сравнению с диким типом, как показали исследования на мышах. Причины такой связи в настоящий момент исследуются, однако можно заключить, что глиоксилатный цикл необходим для поддержания вирулентности этих патогенов.
Согласно новейшим данным, у растений и грибов ферменты глиоксилатного цикла локализованы не только внутри глиоксисомы: некоторые из них находятся снаружи, поэтому протекание глиоксилатного цикла включает транспорт некоторых его промежуточных соединений через мембрану пероксисомы. Благодаря наличию глиоксилатного цикла некоторые микроорганизмы могут расти в среде, содержащей ацетат или жирные кислоты в качестве единственного источника углерода.
Принято считать, что животные неспособны к осуществлению глиоксилатного цикла, поскольку до недавнего времени не было никаких доказательств наличия у них двух ключевых ферментов цикла — изоцитратлиазы и малатсинтазы. Однако некоторые исследования показывают, что этот цикл имеется у некоторых, если не всех, позвоночных. В частности, некоторые исследования показали, что компоненты глиоксилатного цикла присутствуют в больших количествах в печени курицы. Эти и подобные им данные дают основания предполагать, что теоретически глиоксилатный цикл может осуществляться и более сложно организованными позвоночными. Другие исследования приводят доказательства того, что глиоксилатный цикл имеется у некоторых насекомых и морских беспозвоночных, а также нематод (в последнем случае наличие глиоксилатного цикла чётко подтверждено). Впрочем, другие исследования такие выводы опровергают. По поводу наличия цикла у млекопитающих также нет единого мнения: например, в одной работе указывается, что глиоксилатный цикл активен у медведей в зимней спячке, однако более поздние исследования оспаривают этот вывод]. С другой стороны, в геномах плацентарных млекопитающих не было идентифицировано ни одного гена, который кодировал бы изоцитратлиазу и малатсинтазу, хотя, по-видимому, малатсинтаза может быть активна у неплацентарных млекопитающих и других позвоночных. Более того, предполагается, что гены, кодирующие эти ферменты, у млекопитающих находятся в виде псевдогенов, то есть такие гены не совершенно отсутствуют у млекопитающих, а лишь находятся в «выключенном» состоянии. Возможно, в регуляцию глиоксилатного цикла у позвоночных вовлечён витамин D.
Впрочем, в отсутствии глиоксилатного цикла в клетках млекопитающих есть и свои выгоды. Наличие глиоксилатного цикла у некоторых патогенных микроорганизмов и отсутствие его у людей даёт возможности для создания антибиотиков, блокирующих это цикл: они были бы губительны для зависимых от глиоксилатного цикла микроорганизмов и при этом безвредны для людей.
В прорастающих семенах ферментативные превращения дикарбоновых и трикарбоновых кислот происходят в трёх внутриклеточных компартментах: митохондриях, глиоксисомах и цитозоле. Между этими компартментами существует постоянный обмен метаболитами.
Углеродный скелет оксалоацетата из цикла трикарбоновых кислот (протекает в митохондриях) переносится в глиоксисомы в форме аспартата. Там аспартат превращается в оксалоацетат, который конденсируется с ацетил-СоА, образовавшимся при окислении жирных кислот. Образующийся при этом цитрат под действием аконитазы переводится в изоцитрат, который далее распадается на глиоксилат и сукцинат под действием изоцитратлиазы. Сукцинат возвращается в митохондрию, где он вовлекается в цикл трикарбоновых кислот и превращается в малат, который переносится в цитоплазму и под действием цитозольной малатдегидрогеназы окисляется в оксалоацетат. В ходе глюконеогенеза оксалоацетат превращается в гексозы и сахарозу, которые могут доставляться в растущие корни и побег. Таким образом, во всех этих превращениях задействованы 4 различных биохимических процесса: окисление жирных кислот до ацетил-СоА (в глиоксисомах), глиоксилатный цикл (в глиоксисомах), цикл трикарбоновых кислот (в митохондрии) и глюконеогенез (в цитозоле).
Наличие общих метаболитов у этих процессов требует их координированной регуляции. Важнейшим из этих соединений является изоцитрат, служащий «точкой расхождения» глиоксилатного цикла и цикла трикарбоновых кислот. Изоцитратдегидрогеназа регулируется при помощи ковалентных модификаций: специфическая протеинкиназа фосфорилирует её и тем самым инактивирует. Эта инактивация приводит к тому, что изоцитрат не может далее участвовать в цикле трикарбоновых кислот и направляется в глиоксилатный цикл, где он становится предшественником для синтеза глюкозы. Фосфопротеинфосфатаза удаляет фосфорильную группу с изоцитратдегидрогеназы, вновь активируя фермент, и большая часть изоцитрата направляется в цикл трикарбоновых кислот, где из него извлекается энергия. Регуляторные ферментативные активности протеинкиназы и фосфопротеинфосфатазы осуществляются одним полипептидом.
Некоторые бактерии, в том числе E. coli, имеют в цитозоле полный набор ферментов гликосилатного цикла и цикла трикарбоновых кислот и поэтому могут расти на ацетате как единственном источнике углерода и энергии. Фосфопротеинфосфатаза, активирующаяся изоцитратдегидрогеназу, стимулируется промежуточными соединениями цикла трикарбоновых кислот и гликолиза, которые служат индикаторами того, что клетка в достаточной мере обеспечена энергией. Те же метаболиты подавляют протеинкиназную активность этого регуляторного полипептида. Поэтому накопление промежуточных продуктов центральных путей, обеспечивающих клетку энергией, свидетельствующее о нехватке энергии, активирует изоцитратдегидрогеназу. Когда концентрация этих веществ падает, свидетельствуя о достаточном снабжении исходными продуктами цикла трикарбоновых кислот, изоцитратдегидрогеназа инактивируется протеинкиназой.
Те же соединения гликолиза и цикла трикарбоновых кислот, которые активируют изоцитратдегидрогеназу, являются аллостерическими[en] ингибиторами изоцитратлиазы. Когда скорость энергетического обмена достаточно высока, чтобы поддерживать концентрацию промежуточных соединений глиоксилатного цикла и цикла трикарбоновых кислот низкой, изоцитратдегидрогеназа инактивирована, а ингибирование изоцитратлиазы прекращается, и изоцитрат вовлекается в глиоксилатный цикл, где он будет использован для биосинтеза углеводов, аминокислот и других клеточных компонен
Дата: 2018-12-21, просмотров: 962.