Ферменты обладают высокой специфичностью действия. Специфичность действия фермента предопределяется строгим соответствием пространственной конфигурации субстрата и активного центра фермента.
Формирование активного центра фермента начинается уже на ранних этапах синтеза белка – на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации.
Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот в водной среде при определенных значениях ионной силы, рН раствора и температуры и т.д. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды. В какой–то момент возникает термодинамически наиболее выгодная стабильная биологически активная конформация молекулы белка.
При уникальном сочетании нескольких аминокислотных остатков, расположенных в разных точках полипептидной цепи формируется каталитический центр фермента. Чаще всего в каталитических центрах однокомпонентных ферментов встречаются остатки сер, гис, три, арг, цис, асп, глу и тир, содержащие в радикале группы –ОН, –СООН,–NН2, –НS.
Так как каталитический центр однокомпонентного фермента возникает в тот момент, когда молекула приобретает присущую ей третичную структуру, то третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности. У двухкомпонентных ферментов в состав каталитического центра еще входят группа небелковой природы. Добавочную группу, прочно связанную с белком называют простетической группой; легко отделяемую от белка и способную к самостоятельному существованию – коферментом.
В активном центре условно различают каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом и связывающий центр, обеспечивающий специфическое сродство к субстрату и формировании его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом.
Пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выражено формулой «перчатка–рука». При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. В настоящее время гипотеза Кошланда постепенно дополняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
Различают групповую и абсолютную специфичность. При групповой специфичности фермент катализирует реакции одного типа более чем с одним структуроподобным субстратом. Например, триацилглицероллипаза расщепляет жиры (сложноэфирную связь), включающие разные жирно-кислотные остатки. Другой пример, – действие ферментов, гидролизующих пептиды и белки: они расщепляют пептидные связи, образованные разными аминокислотами. При абсолютной специфичности фермент каталитически ускоряет одну единственную реакцию. Примером таких ферментов могут служить аргиназа, гидролитически расщепляющая аргинин на орнитин и мочевину, уреаза, катализирующая распад мочевины на СО2и NH3.
Существует еще и стереоспецифичность, когда фермент катализирует превращение определенного оптического изомера – L- или D- или геометрического – цис- или транс-.
Например, фумараза катализирует превращение только фумаровой кислоты (транс-изомер), но не действует на малеиновую кислоту (цис-изомер).

фумаровая кислота малеиновая кислота
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от него характеризуется необычайно высокой степенью специфичности (фер-
мент катализирует только одну реакцию или действует только на один тип связи). Этим обеспечивается тонкая регуляция всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и др.), протекающих в клетке и организме. Например, фермент уреаза катализирует расщепление лишь одного вещества - мочевины (H2N-CO-NH2 + Н2О —> 2NH 3 + СО2), не оказывая каталитического действия на структурно-родственные соединения.
Для понимания механизма действия ферментов, обладающих высокой специфичностью, очень важна теория активного центра. Согласно ей, в мо-
лекуле каждого фермента имеется одни участок или более, в которых происходит катализ за счет тесного (во многих точках) контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа серина), или отдельная аминокислота. Обычно же для каталитического действия необходимо сочетание нескольких (в среднем от 3 до 12) расположенных в определенном порядке аминокислотных остатков. Активный центр также формируется связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы – коферментами, или кофакторами. Причем форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (взаимодополняемости или комплементарности) друг другу. Роль остальных аминокислотных остатков в крупной молекуле фермента состоит в том, чтобы обеспечить его молекуле соответствующую глобулярную форму, которая нужна для эффективной работы активного центра. Кроме того, вокруг крупной молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими асимметричной формы. Это приводит к ослаблению химических связей, и катализируемая реакция происходит с меньшей начальной затратой энергии, а следовательно, с намного большей скоростью. Например, одна молекула фермента каталазы может расщепить за 1 мин более 5 млн. молекул пероксида водорода (Н2О2), который возникает при окислении в организме различных соединений.
У некоторых ферментов в присутствии субстрата конфигурация активного центра претерпевает изменения, т. е. фермент ориентирует свои функциональные группы таким образом, чтобы обеспечить наибольшую каталитическую активность.
На заключительном этапе химической реакции фермент-субстратный комплекс разъединяется с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
Скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т. д. Например, при температурах, близких к нулю, скорость биохимических реакций замедляется до минимума. Это свойство широко используется в различных отраслях народного хозяйства, особенно в сельском хозяйстве и медицине. В частности, консервация различных органов (почек, сердца, селезенки, печени) перед их пересадкой больному происходит при охлаждении с целью снижения интенсивности биохимических реакций и продления времени жизни органов. Быстрое замораживание пищевых продуктов предотвращает рост и размножение микроорганизмов (бактерий, грибов и др.), а также инактивирует их пищеварительные ферменты, так что они оказываются уже не в состоянии вызвать разложение пищевых продуктов.
Все ферменты, выполняющие роль катализаторов, - вещества белковой природы, они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз. Каталитическую активность фермента обусловливает не вся его молекула, а только небольшой ее участок - активный центр, действие которого очень специфично. В одной молекуле фермента может быть несколько активных центров.
Одни молекулы ферментов могут состоять только из белка (например, пепсин) - однокомпонентные, или простые; другие содержат два компонента: белок (апофермент) и небольшую органическую молекулу - кофермент. Установлено, что в качестве коферментов в клетке функционируют витамины. Если учесть, что ни одна реакция в клетке не может осуществляться без участия ферментов, становится очевидным то важнейшее значение, которое имеют витамины для нормальной жизнедеятельности клетки и всего организма. Отсутствие витаминов снижает активность тех ферментов, в состав которых они входят.
Активность ферментов находится в прямой зависимости от действия целого ряда факторов: температуры, кислотности (pH среды), а также от концентрации молекул субстрата (вещества, на которое они действуют), самих ферментов и коферментов (витаминов и других веществ, входящих в состав коферментов).
Стимулировать или угнетать тот или иной ферментативный процесс может действие различных биологически активных веществ, как-то: гормоны, лекарственные препараты, стимуляторы роста растений, отравляющие вещества и др.
Определение количественного содержания ферментов в биологических объектах представляет определенные трудности, поскольку, за редким исключением, ферменты в тканях присутствуют в тканях в ничтожно малых концентрациях. Поэтому о количестве ферментов судят по скорости катализируемой реакции в определенных согласованных условиях измерения. При оптимальных условиях: температура, рН среды и полном насыщении фермента субстратом, скорость катализируемой реакции прямо пропорциональна концентрации фермента. О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции. Для выражения концентрации фермента и количественной оценки его активности в условных единицах комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица Е.
Единицы ферментативной активности
За единицу ферментативной активности (Е) принимают количество фермента, катализирующего превращение 1 микромоля субстрата за 1 мин:
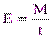 , (1)
, (1)
где М – количество превращенного субстрата, мкмоль;
t– время инкубации, мин.
В связи с введением Международной системы единиц (СИ) предложено выражать активность фермента в каталах (кат, kаt): Екатесть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с. (1 моль/с). Отношение международной единицы (Е) к каталу можно выразить с×следующим образом: 1 кат = 1 моль–1= 60 моль мин–110×= 606 мин–1 =×мкмоль 10×6–7Е, или 1Е мин×= 1 мкмоль–1= (1/60) мкмоль е–1= (1/60) мккат =16,67 нкат. Таким образом, 1Е фермента соответствует 16,67 нкат.
Для выражения активности в практической работе с ферментами пользуются понятиями удельной и молярной активности.
Удельную активность фермента определяют путем деления числа единиц ферментативной активности на массу белка (или ткани), г или мг.
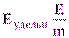 , (2)
, (2)
где Е – число единиц ферментативной активности;
m– масса белка (ткани), г или мг
Молярную активность фермента определяют путем деления числа единиц ферментативной активности в образце на массу фермента, выраженную в микромолях (для очищенных ферментов):
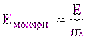 , (3)
, (3)
где Е – число единиц ферментативной активности;
m– масса фермента, мкмоль.
Дата: 2018-12-21, просмотров: 890.