Основными запасными веществами семян масличных растений являются жиры, содержание которых в семенах подсолнечника, льна, конопли, горчицы составляет 30-50%. Синтезируются жиры из углеводов, которые поступают в семена из листьев, стеблей и элементов соцветия. Качество масла изменяется в процессе созревания семян: как правило, в нем усиливается синтез ненасыщенных кислот. Основными белками семян масличных культур являются альбумины и глобулины. Это хорошо сбалансированные по аминокислотному составу белки, имеющие высокую питательную ценность. Общее количество белков в семенах составляет 15-30%. Во время созревания в семенах масличных растений происходят два конкурирующих процесса - образование белков из аминокислот, а также синтез жиров из углеводов. В условиях дефицита влаги синтез последних веществ ослабляется, в результате в семенах повышается концентрация белков. Как более энергоемкий процесс, синтез белков замедляется сильнее при меньшем поступлении световой энергии к растениям. При возделывании масличных растений в условиях повышенной влажности и умеренных температур в их семенах образуется больше полиненасыщенных жирных кислот. Многие масленичные культуры во время формирования и налива семян интенсивно поглощают корнями фосфор и калий. При недостатке этих минеральных элементов в почве снижается накопление жиров в семенах. Установлено, что исходный материал, из которого построены органические соединения, входящие в состав семян большинства масличных культур, поступает в семена из вегетативных органов растения. Движение ассимилятов из вегетативных органов в семена и последующий синтез и накопление запасных веществ представляют собой сложный физиолого-биохимический процесс.
Материалом для образования жирных кислот, ацилглицеринов и других липидов, отлагаемых в запас в растениях, служат соединения, поступающие туда из вегетативных органов в виде растворов. Это подтверждается тем, что в вегетативных органах до цветения растения и в первые периоды созревания накапливается значительное количество подвижных водорастворимых соединений - белковых веществ, углеводов и органических кислот. По мере созревания эти соединения переходят в семена. К концу созревания семян в стеблях и листьях масличных растений подвижные углеводы (глюкоза и сахароза), как правило, почти полностью исчезают, содержание крахмала не превышает долей процента, а также резко уменьшается содержание органических кислот.
Это служит показателем того, что для синтеза в семенах начинают использоваться углеводные продукты «раздревеснения»- гидролиза полисахаридов стебля и соцветия, которые в виде подвижных углеводов или более простых соединений поступают в семена. При сокращении фотосинтеза из-за уменьшения поверхности листьев наблюдается также реутилизация белков - деградация их молекул с образованием низкомолекулярных продуктов, которые перемещаются в семена и там включаются в соединения, откладываемые в запас.
В процессе формирования семян на растении различают несколько периодов. Образование семян начинается после оплодотворения. Этот период называется также эмбриональным, так как после его окончания зародыш, отделенный от материнского растения, уже способен дать слабый жизнеспособный росток.
В первом периоде заканчивается дифференциация зародыша с одновременным ростом содержания масла в ядре. Во втором периоде растет крупность семян при медленно повышающейся масличности ядра. Уборочная спелость семян характеризуется снижением влажности семян. После достижения уборочной спелости семена и плоды становятся пригодными для технологического использования в промышленности в качестве масличного сырья. Хотя морфологически созревание семян к этому времени практически заканчивается, физиолого-биохимические процессы в семенах протекают еще достаточно интенсивно и могут в зависимости от создающихся внешних условий приводить к глубоким качественным изменениям в живом организме семян.
3. Общая характеристика вторичных метаболитов.
Растения синтезируют огромное количество разнообразных веществ, которые не участвуют в основном обмене клеток. Традиционно такие соединения называют вторичными, а их обмен — вторичным метаболизмом. По способности образовывать вторичные метаболиты растения являются «рекордсменами», оставляя далеко позади представителей других царств живых существ. Наряду с фотосинтезом, вторичный метаболизм — характеристическое свойство растительного организма, его «визитная карточка». Парадоксально, но биологи достаточно долго оставляли этот важнейший аспект жизнедеятельности растений без должного внимания. Гораздо больше знали о вторичных метаболитах провизоры, фармацевты и криминалисты, поскольку лекарственные и ядовитые свойства растений чаще всего обусловлены именно этими соединениями. В последние годы наметился значительный прогресс в изучении вторичного метаболизма, при этом основными являются три направления. Фотохимия изучает строение вторичных метаболитов и их распространение по царству растений, биохимия вторичного метаболизма — пути синтеза и энзимологию процесса, физиология вторичного метаболизма исследует локализацию вторичного метаболизма в растении, его изменение в процессе онтогенеза и, главное, — роль вторичных метаболитов в жизнедеятельности растения.
В 1891 г. немецкий биолог Альбрехт Коссель в лекции «О химическом составе клеток», которую он прочел для Берлинского общества физиологов, впервые ввел понятие «первичных» и «вторичных» компонентов клетки: «Я предлагаю называть соединения, имеющие важность для каждой клетки, первичными, а соединения, не присутствующие в любой растительной клетке, — вторичными. В то время как первичные метаболиты присутствуют в любой растительной клетке, способной к делению, вторичные метаболиты присутствуют в клетках только «нечаянно» и не необходимы для жизни растения». Отсюда становится понятен термин «вторичные метаболиты» — второстепенные, «случайные», некоторые «чудачества» растительного метаболизма, допустимые «излишества». Такие соединения в литературе иногда даже называли «веществами роскоши клеток».
Ситуация радикально изменилась в последние десятилетия с возникновением новых методов анализа и идентификации веществ: прежде всего высокоэффективной хроматографии высокого давления (ВЭЖХ) и хромато-масс-спектрометрии (ГЖХ-МС). Выяснилось, что растения содержат десятки, если не сотни тысяч различных вторичных метаболитов, и их структура чрезвычайно разнообразна. К настоящему времени на предмет присутствия вторичных метаболитов исследовано около 20 — 30 тыс. видов растений, т.е. 10—15% от всей флоры Земли. Несмотря на это уже идентифицировано около 100 000 индивидуальных соединений вторичного метаболизма, и ежедневно в мире идентифицируют около десятка новых. Очевидно, что при таком широком представительстве в мире растений считать вторичные метаболиты синтезированными «случайно» не корректно. Также маловероятно, что такое количество разнообразных соединений не имеет функциональной роли в жизни растения.
Наиболее аргументирована к настоящему времени гипотеза, согласно которой соединения вторичного метаболизма в отличие от первичных метаболитов имеют функциональное значение не на уровне клетки, а на уровне целого организма. Скорее всего эти вещества выполняют «экологические» функции, т. е. имеют значение для защиты растения от различных вредителей и патогенов; они участвуют в размножении растения (окраска и запах цветков, плодов), во взаимодействии растений между собой и другими организмами в экосистеме. Условия окружающей среды для разных видов растений весьма разнообразны, более того, каждый вид растения может «решать» сходные задачи по-своему. Отсюда становится понятным огромное разнообразие соединений вторичного метаболизма растений и уникальность их набора для вида растения, зависимость от фазы развития растения, условий его выращивания. Из «экологических» задач также следует, что многие вторичные метаболиты должны обладать биологической активностью. Действительно, большинство лекарственных и ядовитых растений обязаны своими свойствами присутствию вторичных метаболитов. Выделение и химический анализ действующих веществ из таких растений показали еще одну особенность вторичных метаболитов: эти соединения, как правило, имеют относительно низкую молекулярную массу (у большинства она не превышает 2,0 — 3,0 кДа).
И, наконец, еще одна черта вторичных метаболитов — они синтезируются из очень небольшого числа предшественников: 7 — 8 аминокислот для алкалоидов, фенилаланин или тирозин для фенольных соединений, мевалоновая кислота или 5-оксиксилулоза для изопреноидов.
По химической структуре молекулы отличить вторичные метаболиты от первичных можно далеко не всегда. На рисунке приведены некоторые примеры первичных и вторичных метаболитов.
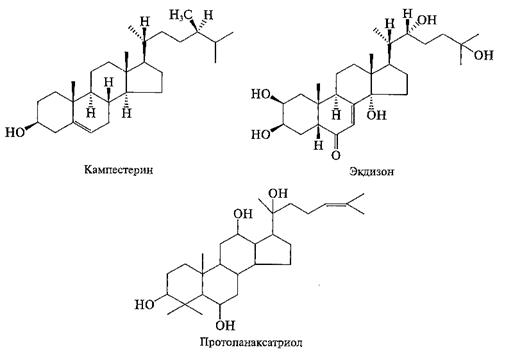
Рис. 1. Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Фитостерины (ситостерин, кампестерин, стигмастерин) — обязательные компоненты мембран растительной клетки, и, следовательно, — типичные первичные соединения. Экдистероиды (гормоны линьки насекомых) — вторичные метаболиты, они присутствуют лишь у некоторых видов растений. Эти вещества, как полагают, участвуют в защите растений от насекомых. Протопанаксатриол является агликоном гинзенозидов — вторичных метаболитов женьшеня, присутствующих только в роде Рапах и в большой степени отвечающих за его биологическую активность. В то же время структуры молекул этих соединений похожи и отличаются только числом и расположением метальных и гидроксильных групп. Структуры белковых аминокислот (первичные метаболиты) и небелковых аминокислот (типичные вторичные метаболиты) часто отличаются лишь наличием или отсутствием метильной, гидроксильной либо другой функциональной группы.
На основе анализа литературы можно сформулировать четыре признака вторичных метаболитов:
1) присутствие не во всех растениях;
2) наличие биологической активности;
3) относительно низкий молекулярный вес;
4) небольшой набор исходных соединений для их синтеза.
Это именно признаки вторичных метаболитов, поскольку каждый из них, в общем-то, не обязателен. Ряд вторичных метаболитов найден практически во всех растениях (например, многие фенилпропаноиды); достаточно много вторичных метаболитов без выраженной биологической активности (хотя не исключен вариант, что ее просто не обнаружили); известны высокомолекулярные вторичные метаболиты (например, каучук и гуттаперча).
Однако совокупность указанных признаков достаточно четко очерчивает крут вторичных метаболитов растений.
Наиболее обоснованно отнести соединение к первичным или вторичным метаболитам можно только после выяснения его роли в жизнедеятельности растения, т.е. на основе его функциональной значимости. Функциональное определение вторичного метаболизма в первом приближении можно дать как метаболизм соединений, имеющих значение на уровне целого организма, но не на уровне клетки.
Принципы классификации вторичных метаболитов, как и названия индивидуальных соединений, изменялись по мере их изучения. Сейчас можно встретить элементы по крайней мере четырех вариантов классификации.
Эмпирическая (тривиальная) классификация. Самый «древний» принцип классификации, основанный на определенных свойствах вторичных метаболитов. Например, алкалоиды — соединения, имеющие щелочные свойства; сапонины — вещества, образующие при встряхивании пену (от Saponaria — мыльнянка); горечи — соединения с горьким вкусом; эфирные масла — ароматные летучие вторичные метаболиты. Подобный принцип классификации имеет много недостатков, однако его элементы встречаются до сих пор в силу традиции и длительного употребления.
Вторичные метаболиты получали (и получают) свои названия, как правило, также эмпирически. Чаще всего названия происходят от растения, из которого впервые было выделено соединение. Например, алкалоиды папаверин (Papaver — мак), берберин (Berberis — барбарис), кокаин (Erythroxylum coca — кокаиновый куст). Довольно часто названия связаны с мифологией, историей, личностями и т.д. Например, алкалоид морфин получил свое название в честь бога сна Морфея, алкалоид тебаин — от египетского города Тебаис, рядом с которым в древности был центр по производству наркотиков, каучук в переводе с индейского — «слезы дерева».
Подобный способ классификации и формирования названий соединений часто приводит к недоразумениям. Например, биологически активные тритерпеновые гликозиды женьшеня практически одновременно начали изучать в Японии и в России. Японские исследователи предложили их называть гинзенозидами — по видовому названию женьшеня (Рапах ginseng), тогда как русские исследователи — панаксозидами, т.е. по родовому названию. Позже, когда стало ясно, что одни и те же соединения называются по-разному, пришлось публиковать «таблицы соответствия» гинзенозидов и панаксозидов.
Химическая классификация. Этот вариант классификации основан на признаках химической структуры вторичных метаболитов и на данный момент времени наиболее разработан и распространен. Однако и эта классификация не лишена недостатков. Например, алкалоиды по такой классификации — соединения, имеющие атом азота в гетероцикле. По этому признаку гликоалка-лоиды картофеля или томатов — типичные алкалоиды, однако по способу синтеза, структуре и ряду свойств эти соединения являются изопреноидами.
Биохимическая классификация. Эта классификация базируется на способах биосинтеза вторичных метаболитов. Например, согласно этой классификации упомянутые выше гликоалкалоиды относятся к тритерпеновым псевдоалкалоидам, так как синтезируются, как и стероидные гликозиды, по изопреноидному пути. Это, по-видимому, наиболее объективный вариант классификации. Однако поскольку биохимия вторичного метаболизма еще недостаточно разработана, такая классификация находится в периоде становления.
Функциональная классификация. Основана на функциях вторичных метаболитов в интактном растении. Этот вариант принципиально отличается от предыдущих и должен существовать параллельно с ними. Согласно функциональной классификации в одну группу соединений могут попадать химически разные структуры. Например, фитоалексины (вторичные метаболиты, имеющие защитные функции и синтезирующиеся в ответ на атаку патогена) представлены в разных видах фенольными соединениями, изопреноидами, полиацетиленами и др. Разработка функциональной классификации вторичных метаболитов только начинается, но она имеет принципиальное значение для физиологии растений.
Наличие разных вариантов классификации вторичных метаболитов приводит к определенным сложностям. В частности, при использовании разных признаков, используемых при химической классификации, возможно «перекрытие» групп вторичных метаболитов. Например, в «фармакогнозии» в качестве действующих веществ многих лекарственных растений выделяют гликозиды (соединения, молекула которых состоит из агликона и углеводного фрагмента) в отдельную группу. В то же время по структуре агликона эти гликозиды могут быть отнесены к фенольным соединениям, изопреноидам или другим группам вторичных метаболитов. Еще больше проблем возникает, когда соединение содержит ряд признаков, характерных для разных групп вторичных метаболитов (например, пренилированные фенольные соединения). В ряде случаев появляющиеся проблемы можно снять, корректируя химическую классификацию биохимической
В настоящее время известно более десятка групп (классов) вторичных метаболитов. При этом некоторые группы насчитывают по несколько тысяч индивидуальных соединений, тогда как другие — лишь единицы. Так же неравномерно распределены группы в растительном мире. Например, изопреноиды и фенольные соединения присутствуют во всех видах растений, тогда как некоторые группы (например, тиофены или ацетогенины) характерны лишь для единичных видов.
Хорошо известны три самые большие группы вторичных метаболитов — алкалоиды, изопреноиды (терпеноиды) и фенольные соединения. Каждая из этих групп состоит из несколько тысяч соединений и подразделяется на многочисленные подгруппы. Известно также около десятка менее многочисленных групп вторичных метаболитов: растительные амины, небелковые аминокислоты, цианогенные гликозиды, глюкозинолаты, полиацетилены, беталаины, алкиламиды, тиофены и др. Количество соединений, входящих в эти группы, колеблется от единиц до нескольких сотен.
Вторичные метаболиты в растении практически никогда не присутствуют в «чистом виде», они, как правило, входят в состав сложных смесей. Такие смеси в зависимости от их состава и нахождения в растении часто носят собственные, исторически сложившиеся названия.
Эфирные масла, как правило, представляют из себя смесь легко испаряющихся изопреноидов (моно- и сесквитерпенов).
Смолы представлены главным образом дитерпенами.
Камеди состоят преимущественно из полисахаридов, но в их состав часто входят алкалоиды, фенольные соединения.
Слизи — это смесь водорастворимых олиго- и полисахаридов, Сахаров, а также небольших количеств фенольных соединений, алкалоидов или изопреноидов.
При анализе структур вторичных метаболитов создается впечатление, что их огромное разнообразие происходит по определенной схеме. Как правило, имеется определенная «базовая» структура, на основе которой образуются многочисленные варианты. При этом можно отметить несколько способов возникновения таких вариантов.
• Модификации базовой структуры: обычно это либо присоединение, либо замена функциональных групп, изменение степени окисленности молекулы; в качестве функциональных групп часто используются гидроксильные, метильные либо метоксильные группы.
• Образование конъюгатов: присоединение к базовой структуре «унифицированных блоков»; чаще всего различных сахаров (моно- или олигосахариды), органических кислот или некоторых групп вторичных метаболитов.
• Конденсация: объединение нескольких одинаковых или различных базовых структур, например образование пренилированных фенольных соединений или димерных индольных алкалоидов.
Для разных групп вторичных метаболитов характерны специфические изменения структуры. Например, для алкалоидов характерно метоксилирование, но не гликозилирование; для изопреоидов, наоборот, типично гликозилирование, но не метоксилирование; у фенольных соединений наблюдаются оба типа этих модификаций.
Определенные модификации молекул, по-видимому, имеют существенное функциональное значение. Многие из них (в частности, гликозилирование) значительно изменяют биологическую активность молекулы. Очень часто гликозилирование является универсальным способом перевода активной (функциональной) формы вторичного метаболита в неактивную (запасную). По этой причине, видимо, нецелесообразно выделять все гликозиды в отдельную группу вторичных метаболитов.
Пути синтеза большинства вторичных метаболитов установлены достаточно хорошо. В настоящее время интенсивно изучается энзимология вторичного метаболизма. На основании имеющейся информации можно сформулировать некоторые закономерности биосинтеза этих соединений. Предшественниками синтеза служит относительно небольшое количество первичных метаболитов. Многие группы вторичных метаболитов могут синтезироваться несколькими путями. Часто этапы синтеза дублированы в разных компартментах клетки (например, пластиды — цитозоль). Синтез четко спланирован и обслуживается набором специальных ферментов, в большинстве случаев весьма специфичных.
Биосинтез алкалоидов. Образование этих веществ тесно связано с общим обменом азота клетки. Для большинства алкалоидов показано, что схемы их синтеза унифицированы, т. е. имеют сходную последовательность реакций. В процессе биосинтеза молекула аминокислоты практически полностью включается в структуру алкалоида. Синтез алкалоидов разных групп включает одинаковые типы реакций: декарбоксилирование, окислительное дезаминирование, альдольная конденсация, но для каждой группы алкалоидов эти реакции осуществляют «собственные» ферменты. На первом этапе синтеза происходит декарбоксилирование аминокислоты при участии соответствующей декарбоксилазы. Образовавшиеся биогенные амины подвергаются окислительному дезаминированию с участием аминооксидаз. Полученные в результате аминоальдегиды или аминокетоны в результате серии последовательных реакций образуют ключевые гетероциклические соединения. Затем происходит модификация базовой структуры с участием разнообразных реакций — гидроксилирования, метилирования и др. В формировании окончательной структуры алкалоида могут принимать участие дополнительные углеродные единицы, например ацетат (в виде ацетил-СоА) или монотерпеновая единица (для сложных индольных алкалоидов). В зависимости от сложности алкалоида его биосинтез включает от трех-четырех до десяти—пятнадцати реакций.
Для целого ряда алкалоидов не только установлена схема синтеза, но охарактеризованы и выделены ферменты. Оказалось, что некоторые ферменты синтеза не очень специфичны (в качестве субстратов могут использовать различные соединения), однако в цепочке синтеза обязательно присутствуют высокоспецифичные ферменты, которые используют только один субстрат (или ряд очень близких субстратов) и выполняют очень специфичную реакцию. Например, при синтезе изохинолинов гидроксилирование базовой структуры по каждому положению выполняют разные ферменты. По мере продвижения к заключительным этапам синтеза сродство ферментов к субстрату обычно повышается: например, для ряда ферментов синтеза бербериновых алкалоидов Кт составляет менее 1 мкМ. В качестве примера на рис. представлена схема синтеза изохинолиновых алкалоидов.
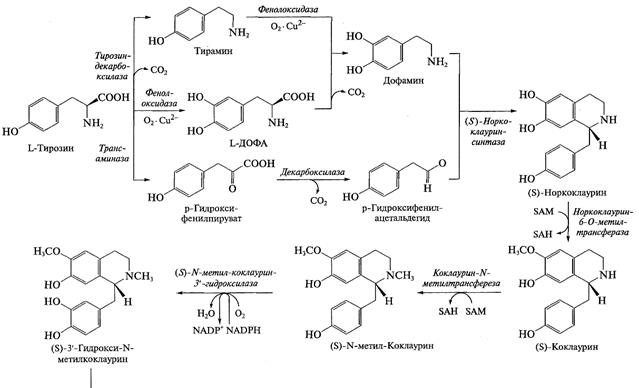
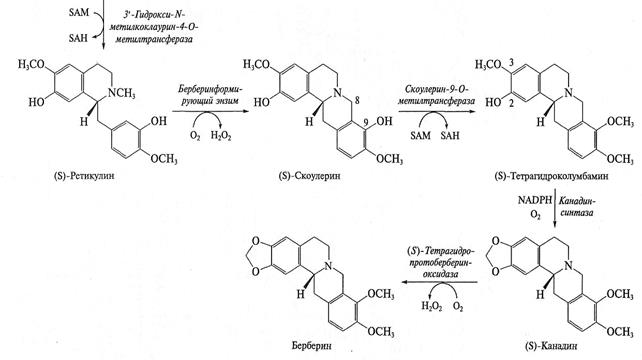 Рис. 2. Схема биосинтеза изохинолиновых алкалоидов
Рис. 2. Схема биосинтеза изохинолиновых алкалоидов
Биосинтез изопреноидов. Если при синтезе алкалоидов сходная цепочка превращений используется для различных исходных соединений (аминокислот), то синтез колоссального числа изопреноидов происходит из единственного предшественника — изопентенилдифосфата (ИПДФ). Под действием фермента изопентенилдифосфатизомеразы, которая сдвигает двойную связь, ИПДФ превращается в диметилаллилдифосфат (ДМАДФ). Далее ИПДФ присоединяется к ДМАДФ по двойной связи и образуется С10-соединение — геранилдифосфат. Он служит источником всех монотерпеноидов. Затем к геранилдифосфату присоединяется еще один ИПДФ и образуется С15-соединение фарнезилдифосфат — исходное вещество для синтеза сесквитерпеноидов. Далее фарнезилдифосфат может либо присоединить еще одну молекулу ИПДФ с образованием геранилгеранилдифосфата (С20-соединение — источник дитерпеноидов), либо димеризоваться с образованием сквалена (С30-соединение — исходное соединение для всех тритерпеноидов). Наконец, геранилгеранилдифосфат может димеризоваться с образованием фитоина — С40-соединения, источник тетратерпеноидов. Кроме того, к геранилгеранилдифосфату может последовательно присоединиться большое количество ИПДФ, формируя в конечном итоге полиизопреноиды — каучук и гуттаперчу. В результате описанных реакций образуется полный гомологический ряд С5-соединений разной длины. Далее эти алифатические молекулы могут «свернуться» в циклические структуры, причем количество циклов, их размер и типы сочленения могут быть самыми разными. На рис. представлена общая схема синтеза изопреноидов.
Синтез базовых изопреноидных структур осуществляют всего два типа ферментов — пренилтрансферазы, которые «наращивают» длину изопреноидов, и циклазы, которые формируют соответствующий циклический скелет молекулы. При этом каждый тип структуры формирует специфическая циклаза. Так как типов циклических структур изопреноидов довольно много, то и количество циклаз должно быть внушительным. К настоящему времени их известно более ста. После формирования базовой структуры (или одновременно с этим), происходит ее модификация и «оснащение» функциональными группами.
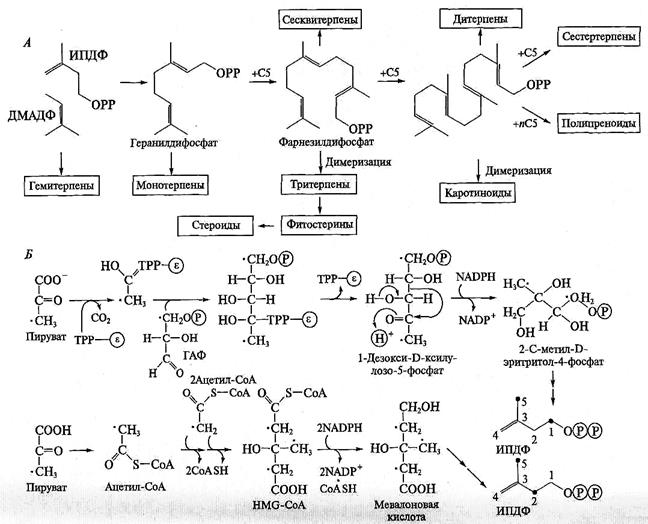
Рис. 3. Общая схема биосинтеза изопреноидов (Л) и два пути синтеза изопентенилдифосфата (Б) в растениях.
Точками показаны меченые атомы в исходных соединениях и в образовавшихся ИПДФ.
Таким образом, биосинтез изопреноидов можно представить себе как своеобразный биохимический «моделист-конструктор». Вначале из унфицированых С5-модулей изготовляются гибкие линейные конструкции разной длины. Они представляют собой практически идеальный материал для «биохимического конструирования» и формирования множества вариантов циклических структур.
Долгое время считалось, что во всех организмах исходное соединение для образования изопреноидов — ИПДФ — формируется единственным способом, а именно из мевалоновой кислоты, которая в свою очередь синтезируется из трех молекул ацетил-СоА. Недавно было установлено, что разные организмы используют различные способы синтеза ИПДФ. В клетках животных и грибов все изопреноиды синтезируются по «классическому» мевалонатному пути. Целый ряд микроорганизмов, в том числе многие цианобактерии и зеленые водоросли, используют другой вариант образования ИПДФ. В этом случае его предшественником является 1-дезоксиксилулозо-5-фосфат, который синтезируется из пирувата и глицеральдегид-3-фосфата. Такой путь синтеза был назван «альтернативным», или «немевалонатным». Оказалось, что растения используют оба варианта образования изопреноидов: в цитозоле синтез идет по классическому пути, а в пластидах — по альтернативному (рис. 3). При этом возможно не только дублирование синтеза изопреноидов в разных ком-партментах клетки, но и разделение по типу синтезируемых структур. Тритерпеноиды (включая стероиды) синтезируются в цитозоле из мевалоната, тогда как дитерпеноиды (включая фитол хлорофилла) и тетратерпеноиды (прежде всего каротиноиды) — в пластидах по альтернативному пути. Моно- и сесквитерпены, вероятно, могут образовываться разными вариантами в зависимости от структуры молекулы и вида растения.
Биосинтез фенольных соединений. К настоящему времени известно два пути образования фенольных соединений — шикиматный (через шикимовую кислоту) и ацетатно-малонатный. Основной путь шикиматный, это практически единственный способ формирования ароматического кольца. В качестве исходных соединений для синтеза выступают фосфоенолпируват (ФЕП) и эритрозо-4-фосфат. При их конденсации возникает семиуглеродная кислота (2-кето-3-дезокси-7-фосфоарабогептановая), которая затем циклизуется в 5-дегидрохин-ную кислоту. Из дегидрохинной кислоты образуется шикимовая кислота, которая имеет шестичленное кольцо, одну двойную связь, и ее легко перевести в соединения ароматического ряда. Из шикимовой кислоты возможно образование оксибензойных кислот — n-оксибензойной, протокатеховой, галловой. Однако основной путь использования шикимовой кислоты — образование через префеновую кислоту ароматических аминокислот фенилаланина и тирозина. Фенилаланин (возможно, в ряде случаев и тирозин) — основной предшественник синтеза фенольных соединений. Дезаминирование фенилаланина осуществляет фермент фенилаланинаммиаклиаза (ФАЛ). В результате образуется коричная кислота, гидроксилирование которой приводит к образованию пара-кумаровой (оксикоричной) кислоты. После дополнительного гидроксилирования и последующего метилирования из нее образуются остальные оксикоричные кислоты.
Оксикоричные кислоты представляют центральное звено синтеза всех фенольных соединений клетки. Opтo-кумаровая кислота является предшественником кумаринов. После ряда реакций укорочения алифатической части молекулы образуются С6-С2- и С6-С1 – соединения — это второй путь образования оксибензойных кислот (первый — непосредственно из шикимовой кислоты). Оксикоричные кислоты могут образовывать различные конъюгаты, прежде всего с сахарами, однако основная масса оксикоричных кислот активируется путем взаимодействия с СоА. Два магистральных пути использования СоА-эфиров оксикоричных кислот — синтез лигнинов и синтез флавоноидов. Для синтеза лигнинов СоА-эфиры оксикоричных кислот восстанавливаются до спиртов, которые выступают в качестве мономеров синтеза. При синтезе флавоноидов СоА-производное оксикоричной кислоты взаимодействует с тремя молекулами малонил-СоА с образованием халкона. Реакцию катализирует фермент халконсинтаза. Образовавшийся халкон легко преобразуется в флаванон. Из флаванонов за счет реакций гидроксилирования, окисления — восстановления образуются другие группы флавоноидов. Затем может происходить модификация молекулы — гликозилирование, метоксилирование и др.
Ацетатно-малонатный путь синтеза фенольных соединений широко распространен у грибов, лишайников и микроорганизмов. У растений он является минорным. При синтезе соединений по этому пути ацетил-СоА карбоксилируется с образованием малонилацетил-СоА. Затем происходит каскад аналогичных реакций, в результате наращивается углеродная цепь и возникает поли-β-кетометиленовая цепочка. Циклизация поликетидной цепи приводит к образованию различных фенольных соединений. Таким способом синтезируются флороглюцин и его производные, некоторые антрахиноны. В структуре флавоноидов кольцо В формируется по шикиматному пути (из оксикоричной кислоты), тогда как кольцо А — по ацетатно-малонатному.
В клетке работают два шикиматных пути синтеза флавоноидов — один в пластидах, другой в цитозоле. В этих компартментах находится полный набор изоферментов шикиматного пути, а также ферментов фенольного метаболизма, в том числе ФАЛ и халконсинтазы. Таким образом, в растительной клетке существует две параллельные цепочки синтеза фенольных соединений (аналогично изопреноидам).
Синтез минорных классов вторичных соединений. Образование этих веществ также изучено достаточно полно. Для многих азотсодержащих соединений исходными веществами являются аминокислоты. Например, синтез цианогенных гликозидов начинается с декарбоксилирования соответствующей аминокислоты, затем последовательно формируются альдоксим, нитрил и α-гидроксинитрил. На последнем этапе синтеза образуется цианогенный гликозид за счет гликозилирования α-гидроксинитрила при помощи УДФ-глюкозы. Синтез обычно осуществляет комплекс ферментов: например, для дуррина этот комплекс состоит из четырех ферментов. Гены ферментов клонированы. Трансгенное по двум генам растение арабидопсиса приобрело способность к синтезу цианогенных гликозидов. Синтез беталаинов начинается от тирозина, который гидроксилируется и образуется диоксифенилаланин (ДОФА). ДОФА служит источником для двух фрагментов молекулы бетацианинов — беталамовой кислоты и цикло-ДОФА. Объединение этих двух соединений приводит к формированию бетацианинов. При синтезе бетаксантинов беталамовая кислота конденсируется с пролином. Серосодержащие вторичные метаболиты обычно синтезируются из серосодержащих аминокислот.
Изучение этимологии вторичного метаболизма привело к открытию удивительно большого количества различных ферментов, участвующих в этом процессе.
Модификация вторичных метаболитов — источник их поразительного разнообразия. Модификация происходит прежде всего в реакциях замещения (их осуществляют ацилтрансферазы), метилирования, гликозилирования. В геноме арабидопсиса обнаружены гены 43 различных ацилтрансфераз. Несколько структурно близких ацилтрансфераз используют в качестве субстратов ацил-СоА, в их активном центре содержится консервативный гистидин. Гены ацилтрансфераз в геноме собраны в кластеры. Метилтрансферазы представляют собой суперсемейство ферментов, в которое входят О-, С-, N-, S-метилтрансферазы. Они используют в качестве метилирующего субстрата S-аденозинметионин (SAM) и осуществляют метилирование фенилпропаноидов, флавоноидов, алкалоидов, поликетидов, сахаров. С-, N-, S-метилтрансферазы структурно (и, видимо, эволюционно) не связаны, тогда как О-метилтрансферазы имеют сходную первичную структуру и консервативный SAM-связывающий мотив. Гликозилирование осуществляют гликозилтрансферазы, причем существуют три типа ферментов: О-, С-, S-гликозилтрансферазы. Гликозилирование существенно изменяет свойства молекулы, прежде всего увеличивает ее растворимость и снижает токсичность.
Окислительно-восстановительные превращения кардинально изменяют свойства молекулы. Эти реакции катализируют окислительно-восстановительные (редокс) ферменты вторичного метаболизма — «метаболические волшебные палочки». У растений обнаружили более 300 цитохром-Р450-оксигеназ и более 100 диоксигеназ; при этом следует учесть, что диоксигеназы обычно мультисубстратны и образуют несколько продуктов.
Дата: 2018-12-21, просмотров: 927.