У всех живых организмов в процессе биохимических реакций дыхания происходит превращение химической энергии углеводов, жиров, азотистых веществ в тепловую энергию, а также энергию мембранных потенциалов внутриклеточных структур и химическую энергию АТФ, восстановленных динуклеотидов, которые затем становятся источниками энергии для синтеза новых органических веществ, необходимых для поддержания жизненных функций организма. Совокупность всех биоэнергетических превращений в организме, обеспечивающих его нормальную жизнедеятельность в изменяющихся условиях окружающей среды, изучает раздел биохимии, называемый биохимической энергетикой.
В связи с тем, что основу жизненных явлений, происходящих в организме, составляют химические и физические процессы, для изучения биоэнергетических превращений применяются законы химической термодинамики. И поэтому для оценки энергетических параметров биохимических реакций используются термодинамические функции – внутренняя энергия системы (U), энтальпия (Н), энтропия (S), свободная энергия Гиббса (G) и др. При этом в ходе биохимических превращений определяются не абсолютные их значения, а изменения термодинамических функций - DU, DH, DS, DG. Очень часто такие изменения термодинамических функций оценивают при стандартных условиях и тогда их обозначают специальным символом - DU˚, DH˚, DS˚, DG˚.
За стандартные условия в биохимической энергетике принимаются: давление 101,3 кПа, температура 25˚С (298,16 К), концентрация веществ 1 моль/л, рН физиологической среды 7,0. Кроме того, следует учитывать, что биохимические реакции, катализируемые ферментами, протекают очень быстро и они осуществляются при атмосферном давлении и температуре, которые изменяются очень медленно. Поэтому можно считать, что биоэнергетические превращения в ходе биохимических реакций происходят при постоянной температуре и постоянном давлении.
В результате определения изменений термодинамических функций можно выяснить, происходит ли в ходе биохимического процесса выделение или поглощение энергии, установить возможность трансформации различных видов энергии и решить вопрос о количестве выделяемой или поглощаемой энергии. На основе полученных таким образом данных можно оценить вероятность самопроизвольного осуществления биохимических реакций, а также выявить возможные источники энергии для осуществления биосинтетических процессов.
Живые организмы, их клетки и многие компоненты внутриклеточных структур представляют собой открытые термодинамические системы, которые обмениваются и веществом, и энергией с окружающей средой. При этом такой обмен является необходимым условием поддержания их жизнедеятельности. Если обмен организма веществом и энергией с окружающей средой прекращается, то организм погибает. Так, например, растения не могут произрастать без света, кислорода, углекислого газа, поступления воды и питательных веществ. Человек и животные не могут жить без пищи, воды и кислорода.
Простейшая биохимическая система включает реагирующие вещества, продукты реакции, а также фермент, катализирующий данную биохимическую реакцию. Реагирующие вещества поступают в биохимическую систему из окружающей физиологической среды, а продукты реакции выходят из системы в окружающую среду. В зависимости от характера биохимического превращения в ходе реакции может происходить выделение в том или ином виде энергии в окружающую среду или, наоборот, поглощение энергии из окружающей среды, в результате чего будет происходить изменение внутренней энергии биохимической системы. В том случае, когда система выделяет определённое количество энергии в окружающую среду, общий запас её внутренней энергии уменьшается, а при поглощении энергии из окружающей среды – увеличивается.
Изменение внутренней энергии системы происходит в соответствии с первым законом термодинамики – законом сохранения энергии, который для открытых систем имеет следующую формулировку: при любом процессе сумма внутренней энергии системы и энергии окружающей среды остаётся величиной постоянной. Исходя из этого, изменение внутренней энергии системы равно алгебраической сумме всех энергий, уходящих из системы в окружающую среду и входящих в неё из окружающей среды.
Общий запас внутренней энергии биохимической системы зависит от её состава, массы, потенциальной и кинетической энергии молекул, атомов и частиц, входящих в состав системы, внутримолекулярной, внутриядерной и гравитационной энергии, термодинамических параметров (температуры, давления, объёма), а также обмена веществами и энергией с окружающей средой. Вместе с тем внутренняя энергия системы является функцией её состояния. В процессе биохимических превращений система переходит из одного термодинамического состояния в другое, при этом изменение внутренней энергии системы не зависит от пути перехода, а определяется разностью между конечным (U2) и начальным состоянием (U1) и поэтому можно записать DU = U2 – U1. И каким бы путём не осуществлялся переход системы от состояния U1 к состоянию U2, через ряд промежуточных стадий или в результате прямого превращения, согласно первому закону термодинамики величина DU не изменяется.
Это важное положение используется в биохимической энергетике для оценки энергетических изменений в ходе биологического окисления веществ, которое осуществляется в клетках организмов постепенно, проходя множество промежуточных стадий. Однако суммарный энергетический эффект окисления в этих процессах равен количеству энергии, которое выделяется при сгорании органических веществ. Поэтому, сопоставляя теплоту сгорания исходных веществ и образующихся при биологическом окислении кислородом продуктов, можно с достаточно высокой точностью определять энергетические изменения в ходе указанных биохимических реакций.
Теплота сгорания некоторых биохимических продуктов (кДж×моль-1)
| Биохимические Продукты | Теплота сгорания | Биохимические Продукты | Теплота сгорания |
| щавелевая кислота молочная кислота глюкоза фруктоза сахароза мальтоза глицерин этанол уксусная кислота пировиноградная кислота | глутаровая кислота янтарная кислота пальмитиновая кислота олеиновая кислота стеариновая кислота индол салициловая кислота аланин глицин валериановая кислота ванилин |
С помощью термодинамических расчётов и в специальных экспериментах доказано, если в процессе горения вещества система не совершает никакой работы, то по количеству выделившегося тепла можно судить об изменении внутренней энергии системы, так как в таком процессе DU = Q. В связи с этим для многих органических соединений, являющихся продуктами биохимических реакций, определена теплота сгорания ( табл. 6), которая представляет собой термохимический показатель, выражающий, количество тепла при полном сгорании 1 моля вещества с образованием высших оксидов.
Тепловые эффекты биохимических реакций.
В большинстве биохимических систем реакции проходят при постоянном давлении, поэтому их тепловые эффекты определяются изменением термодинамической функции, называемой энтальпией: Q = DН. Поскольку энтальпия является функцией, характеризующей термодинамическое состояние системы, величина изменения этой функции не зависит от путей перехода системы от начального к конечному состоянию или последовательности биохимических реакций, а определяется как разность между её конечным и начальным состоянием: DН = Н2 – Н1.
В ходе эндотермической реакции происходит поглощение тепла (из окружающей среды) в результате чего энтальпия системы увеличивается и тогда изменение энтальпии будет величиной положительной (DН > О). В экзотермической реакции выделяется тепловая энергия в окружающую среду, поэтому энтальпия в ходе такой реакции уменьшается, а изменение энтальпии становится отрицательной величиной (DН < О). Для многих биохимических продуктов определены стандартные энтальпии образования, которые численно равны изменению энтальпии в реакции образования 1 моля конкретного химического соединения из элементов или простых веществ при стандартных термодинамических условиях. Некоторые из этих показателей приведены в таблице.
Зная стандартные энтальпии образования реагирующих веществ и продуктов реакции, можно не прибегая к измерениям, определить расчётным путём тепловой эффект любой биохимической реакции, который численно равен изменению энтальпии в ходе данного превращения. В соответствии с законом Гесса изменение энтальпии в ходе реакции при стандартных условиях равно разности между суммой стандартных энтальпий образования продуктов реакции и суммой стандартных энтальпий образования реагирующих веществ с учётом коэффициентов в уравнении реакции:
DН˚ реакции = ∑ DН˚ продуктов - ∑ DН˚ реагентов
Для реакции хА + уB ® nС + кD изменение энтальпии можно рассчитать по формуле: DН˚реакции = (nDН˚C + кDН˚D) – (хDН˚A + уDН˚B).
В качестве примера рассмотрим реакцию синтеза аспарагина из аспарагиновой кислоты и аммиака:
DН˚реакции = (DН˚аспарагина + DН˚н2о) – (DН˚асп.кислоты +
DН˚NH3) = (-793-286) – (-978-46) = -1079 + 1024 = -55 кДж.
Поскольку изменение энтальпии при синтезе аспарагина из аспарагиновой кислоты имеет отрицательное значение, то это – экзотермическая реакция, в ходе которой выделяется тепловая энергия (55 кДж в расчёте на каждый моль синтезируемого аспарагина при стандартных условиях).
В соответствии с законом Гесса тепловой эффект реакции можно также определить по теплоте сгорания реагирующих веществ и продуктов реакции. Особенно это важно для тех процессов, в которых участвуют биохимические компоненты с неизвестной величиной стандартной энтальпии образования.
Стандартные энтальпии образования (DН˚) и стандартные энтропии (S˚) некоторых биохимических продуктов
| Биохимические продукты | DН˚ (кДж×моль-1) | S0 (Дж×моль-1× К-1) |
| Н2О (жидкость) СО2 (газ) NH3 (газ) муравьиная кислота уксусная кислота a-D-глюкоза b-D-глюкоза сахароза глицерин D,L-глицин D,L-аланин L-аспарагиновая кислота L-аспарагин L-глутаминовая кислота бензойная кислота щавелевая кислота этиловый спирт пропанол изопропанол | -286 -394 -46 -377 -487 -1247 -1268 -2224 -670 -531 -566 -978 -793 -1010 -385 -827 -278 -660 -261 |
Тепловой эффект такой реакции будет равен разности между суммарным значением теплоты сгорания реагирующих веществ и суммой теплот сгорания продуктов реакции (с учётом коэффициентов в уравнении реакции).
Жизнедеятельность каждой клетки организма, поддержание ее структурной организации обеспечивается благодаря непрерывному использованию энергии. Источником энергии для животных являются белки, жиры и углеводы корма: 1 г углеводов корма при окислении в организме выделяет 4,1 ккал, 1 г жиров – 9,3 ккал, 1 г белков – 4,1 ккал.
1 ккал определяется как количество теплоты, необходимое для того, чтобы повысить температуру 1 г воды на 1°С. 1 ккал равна примерно 4,2 килоджоуля.
Обмен энергии включает в себя поступление энергии в организм, освобождение и превращение ее, распределение и использование в организме, рассеивание теплоты. Поступает энергия в организм в потенциальном виде в белках, жирах и углеводах. В процессе превращения белков, жиров и углеводов происходит освобождение энергии: часть в виде теплоты, другая часть используется для процессов синтеза, мышечной работы, продукции и др., но в конечном итоге эта энергия также превращается в теплоту.
Освобождение энергии в организме происходит поэтапно. Вначале в пищеварительном аппарате при расщеплении белков, жиров и углеводов освобождается у моногастричных животных около 1% этой энергии, а у жвачных – 7…10%. Затем происходит превращение всосавшихся аминокислот, глюкозы, глицерина и жирных кислот путем окисления. При этом вначале в протоплазме клеток образуются три промежуточных продукта окисления: ацетилкоэнзим А, альфа-кетоглутаровая кислота, щавелево-уксусная кислота, при этом освобождается примерно 50% этой энергии. В дальнейшем при продолжающемся окислении образовавшихся трех продуктов в цикле трикарбоновых кислот освобождаются остальные 70% энергии, часть ее превращается в теплоту, а более 50% переходит в АТФ. Энергия АТФ используется для обеспечения всех процессов в организме.
Превращение и распределение энергии веществ принятого животным корма происходит следующим образом. В результате превращения веществ основная часть энергии как энергия перевариваемых веществ всасывается и как энергия всосавшихся веществ включается в обменные процессы в виде обменной энергии. Непереваренная часть питательных веществ и не всосавшиеся в кровь и лимфу вещества выводятся как энергия кала. У жвачных животных 7…16% энергии перевариваемых веществ теряется с газами, которые образуются в рубце, как энергия газа. Часть энергии всосавшихся веществ в обменных процессах не участвует и удаляется с мочой – энергия мочи.
Обменная энергия используется для обеспечения процессов в тканях: связанных с поддержанием жизнедеятельности организма в состоянии покоя и натощак; связанных с поиском, приемом и перевариванием корма, поддержанием температуры тела; связанных с физической и умственной деятельностью у человека или с использованием на образование продукции и физической деятельностью у животных.
Количество усваиваемой энергии и обменной энергии в корме зависит как от его состава, так и от вида корма.
Для определения количественных параметров обмена энергии в организме используют методы прямой и непрямой калориметрии.
Метод прямой калориметрии – это непосредственное определение количества энергии в корме и рассеянного тепла с помощью физиологических калориметрических камер.
Метод непрямой калориметрии – это определение количества образованного и рассеянного тепла по количеству потребленного кислорода и соотношению его с выделенным диоксидом углерода. При этом определяют количество потребленного кислорода и количество выделенного диоксида углерода в единицу времени. Величина отношения объема выделенного диоксида углерода к объему потребленного кислорода называется дыхательный коэффициент. По дыхательному коэффициенту и количеству потребленного кислорода определяют количество освободившейся энергии.
Регуляция обмена энергии обеспечивается с рецепторов, которые воспринимают сдвиги генетически обусловленного энергетического баланса. Информация с рецепторов поступает в нервный центр обмена энергии, где формируется программа действия, которая передается по нервным волокнам и с помощью гормонов ко всем тканям и органам организма. Она обеспечивает приспособление энерго-субстратно-кофакторного соотношения, размеров освобождения и использования энергии в тканях к потребностям органов Основную нагрузку несет симпатическая иннервация, которая повышает образование и использование энергии; парасимпатическая иннервация активирует образование АТФ; гормоны тироксин, трийодтиронин, катехоламины повышают энергетический обмен, глюкокартикоиды угнетают его. Повышение использования энергии вызывают половые гормоны.
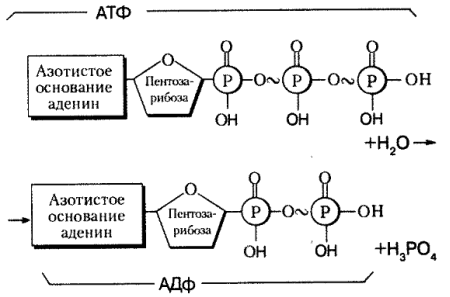
АТФ – аденозинтрифосфорная кислота – нуклеотид, состоящий из азотистого основания аденина, углевода рибозы и трёх молекул фосфорной кислоты.
Структура неустойчива, под влиянием ферментов переходит в АДФ – аденозиндифосфорную кислоту (отщепляется одна молекула фосфорной кислоты) с выделением 40 кДж энергии. АТФ - единый источник энергии для всех клеточных реакций. Ее превращение происходит по такой схеме:
Дата: 2018-12-21, просмотров: 725.