 Клинико-генеалогический метод - метод родословных, основан на прослеживании какого-либо нормального или патологического признака в ряду поколений с указанием родственных связей между членами родословной. Метод основан в конце ХIХ века Ф. Гальтоном и относится к наиболее универсальным методам в генетике человека. Он широко применяется при решении теоретических и прикладных проблем, таких как: 1) установление наследственного характера признака; 2) определение типа наследования; 3) выяснение зиготности пробанда, пенетрантности и экспрессивности признака; 4) вычисление вероятности рождения детей с той или иной наследственной патологией у пробанда.
Клинико-генеалогический метод - метод родословных, основан на прослеживании какого-либо нормального или патологического признака в ряду поколений с указанием родственных связей между членами родословной. Метод основан в конце ХIХ века Ф. Гальтоном и относится к наиболее универсальным методам в генетике человека. Он широко применяется при решении теоретических и прикладных проблем, таких как: 1) установление наследственного характера признака; 2) определение типа наследования; 3) выяснение зиготности пробанда, пенетрантности и экспрессивности признака; 4) вычисление вероятности рождения детей с той или иной наследственной патологией у пробанда.
Метод включает два этапа: сбор сведений о семье и составление родословной с последующим генеалогическим анализом. Сбор сведений начинается от пробанда, которым называют лицо, первым попавшее в поле зрения исследователя (обратившееся за консультацией). Затем делают графическое изображение родословной, используя стандартные символы.
Генеалогический метод тем информативнее, чем больше имеется достоверных сведений о здоровье родственников больного. После составления родословной начинается генеалогический анализ, целью которого является установление генетических закономерностей.
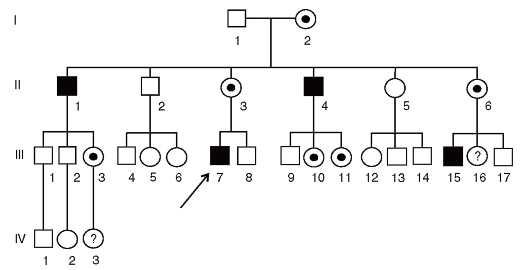 В дополнение к описанию родословной следует подчеркнуть следующее: 1) поколения обозначаются римскими цифрами слева от родословной; 2) арабскими цифрами нумеруется потомство одного поколения слева направо последовательно (весь ряд); 3) братья и сестры (сибсы) располагаются в родословной в порядке рождений в один ряд; 4) каждый член родословной имеет шифр, например, III-7 - пробанд.
В дополнение к описанию родословной следует подчеркнуть следующее: 1) поколения обозначаются римскими цифрами слева от родословной; 2) арабскими цифрами нумеруется потомство одного поколения слева направо последовательно (весь ряд); 3) братья и сестры (сибсы) располагаются в родословной в порядке рождений в один ряд; 4) каждый член родословной имеет шифр, например, III-7 - пробанд.
Выделяют несколько типов наследования: аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный доминантный, Х-сцепленный рецессивный, Y-сцепленный или голандрический и митохондриальный.
Для аутосомно-доминантного типа наследования характерно:
1. Проявление болезни в каждом поколении
2. Лица мужского и женского пола поражаются одинаково часто и в одинаковой мере
3. Если один из родителей болен, то вероятность рождения больного ребенка составляет 50%
4. 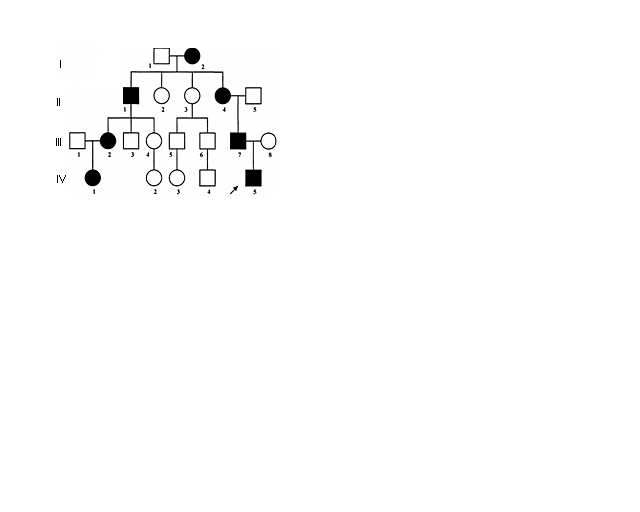 Наблюдается вертикальный характер передачи заболевания в родословной, т.е. больной ребенок имеет больного родителя.
Наблюдается вертикальный характер передачи заболевания в родословной, т.е. больной ребенок имеет больного родителя.
Примерами аутосомно-доминантного типа наследования являются шерстистые волосы, близорукость, полидактилия, белый локон в волосах, брахидактилия, синдром Марфана и др.
Одна из характерных особенностей доминантных признаков – это изменчивость их выражения – экспрессивность (степень проявления признака). В родословных семей с доминантным признаком иногда встречаются так называемые «проскакивающие поколения». У индивидуума из такого поколения выражение гена настолько незначительно, что по фенотипу не удается его обнаружить, т.е. признак в данном случае не пенетрантен. Пенетрантность подчиняется принципу «все или ничего». Генетический признак иногда настолько изменяется в силу модифицирующего влияния других генов или факторов среды, что он вовсе не проявляется, несмотря на присутствие обычно вызывающего его гена.
Выделяют несколько причин отклонения от правил аутосомно–доминантного наследования. Одна из основных – вновь возникающие мутации в отдельных половых клетках одного из родителей (в большинстве случаев новые мутации появляются в гаметогенезе у мужчин), тогда заболевание будет единственным случаем в семье. Вторая причина отклонения – мозаицизм зародышевых клеток. Следствием этого может быть появление в семье здоровых родителей нескольких больных детей с аутосомно-доминантными заболеваниями. Именно этим явлением объясняются повторные случаи ахондроплазии, несовершенного остеогенеза и др. Еще одной из причин отклонения от правил аутосомно-доминантного наследования является возрастная зависимость. Многие болезни проявляются в юношеском или даже взрослом возрасте. Примером может служить моторно-сенсорная нейропатия типа 1а, которая проявляется с 5 и до 50 лет.
Для аутосомно-рецессивного типа наследования характерно:
1. Родители больного ребенка, как правило, здоровы
2. Лица мужского и женского пола поражаются одинаково часто и в одинаковой мере
3. 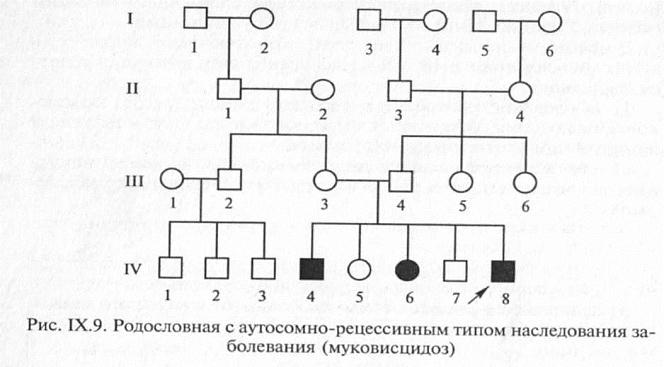 Повторный риск рождения больного ребенка составляет 25 %
Повторный риск рождения больного ребенка составляет 25 %
4. Отмечается «горизонтальное» распределение больных в родословной, т.е. пациенты чаще встречаются в рамках одного сибства
5. Если оба родителя больны, то все дети имеют этот признак
6. Наблюдается увеличение частоты больных детей в группах родителей, связанных родством.
Примерами аутосомно-рецессивного типа наследования являются альбинизм, сахарный диабет, фенилкетонурия, шизофрения, муковисцидоз, алкаптонурия, серповидно-клеточная анемия.
Для Х-сцепленного доминантного типа наследования характерно:
1. 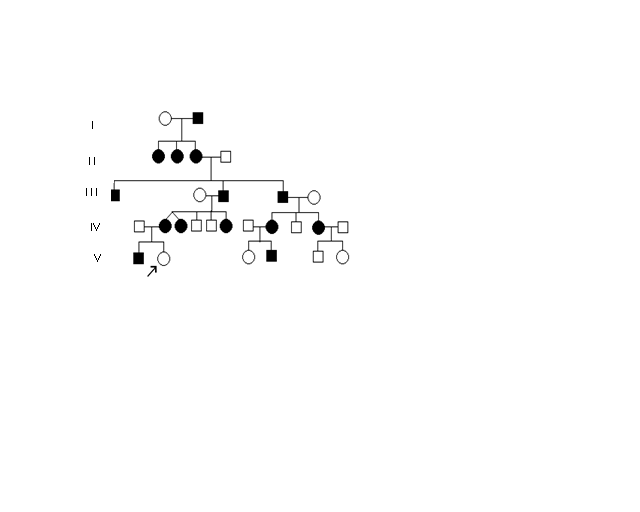 Болезнь встречается у женщин в два раза чаще, чем у мужчин
Болезнь встречается у женщин в два раза чаще, чем у мужчин
2. Больной мужчина передает мутантный аллель всем своим дочерям
3. Больные женщины передают мутантный аллель половине своих детей независимо от пола.
Примерами Х-сцепленного доминантного типа наследования являются витамин D–резистентный гипофосфатемический рахит, темная эмаль зубов, синдром Гольтца-Горлина, синдром Коффина–Лоури, наследственный нефрит, псевдогипопаратиреоз, нефрогенный несахарный диабет.
Для Х-сцепленного рецессивного типа наследования характерно:
1. Заболевание в основном встречается у лиц мужского пола
2. Признак передается от больного отца через его фенотипически здоровых дочерей половине внуков
3. Заболевание никогда не передается от отца к сыну.
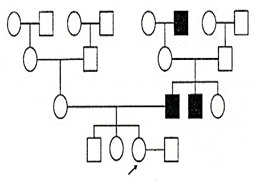 Примерами Х-сцепленного рецессивного типа наследования являются дальтонизм, гемофилия, мышечная дистрофия Дюшена, ихтиоз, синдром тестикулярной феминизации, синдром Ленца, синдром Хантера, синдром Леша-Нихана.
Примерами Х-сцепленного рецессивного типа наследования являются дальтонизм, гемофилия, мышечная дистрофия Дюшена, ихтиоз, синдром тестикулярной феминизации, синдром Ленца, синдром Хантера, синдром Леша-Нихана.
Для заболеваний этого типа, как и для аутосомно-доминантных, свойственно возникновение некоторых случаев в результате вновь возникших мутаций. Для медико-генетического консультирования чрезвычайно важно решить, является ли мать больного ребенка с рецессивным, Х-сцепленным летальным заболеванием гетерозиготной носительницей мутантного гена или это случай вновь возникшей мутации. В первом случае вероятность рождения больного сына будет равна 50%, а во втором – 0%.
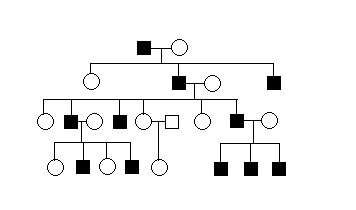 Для Y -сцепленного (голандрического) типа наследования характерно:
Для Y -сцепленного (голандрического) типа наследования характерно:
1. Передается от отца ко всем сыновьям.
Примерами голандрического типа наследования являются гипертрихоз, синдактилия, пигментный ретинит, некоторые формы аллергии, несколько форм азооспермии, дисхондростеоз и др.
Митохондриальный тип наследования (цитоплазматическая наследственность). Каждая митохондрия обладает набором генов, отличающимся от ядерных. Митохондриальная ДНК человека представляет собой двухцепочечную кольцевую молекулу, содержащую 16569 пар оснований. Она кодирует 22 молекулы тРНК, 2 рРНК и 13 полипептидов ферментов дыхательной цепи.
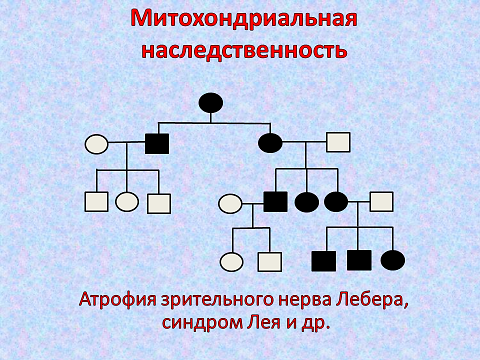 Поскольку митохондрии наследуются ребенком от матери с цитоплазмой ооцитов, все дети больной женщины унаследуют заболевание независимо от пола. У больных мужчин все дети будут здоровы. Часто при митохондриальных заболеваниях в клетках наблюдается гетероплазмия, то есть разное соотношение митохондрий с нормальной и мутированной ДНК. Вероятность наследования по митохондриальной ДНК (мтДНК) зависит от процента мутантных митохондрий. При гомоплазмии все митохондрии содержат мутантный участок, и вероятность наследования составляет 100%. По митохондриальному типу наследуется атрофия зрительного нерва Лебера, митохондриальная энцефаломиопатия, синдром Лея, болезнь Кернса-Сейра (около 10 заболеваний). Одна из гипотез старения констатирует прогрессирующее нарушение реакций окислительного фосфорилирования митохондрий, в результате накопления мутаций мтДНК соматических клеток. Поскольку изменения митохондриального генома приводят к нарушению пируватдегидрогеназного комплекса, дефектам ферментов дыхательной цепи, β-окисления и цикла Кребса, в клинической картине данных заболеваний ведущими являются тяжелые поражения центральной нервной системы, органов зрения, сердца и мышц.
Поскольку митохондрии наследуются ребенком от матери с цитоплазмой ооцитов, все дети больной женщины унаследуют заболевание независимо от пола. У больных мужчин все дети будут здоровы. Часто при митохондриальных заболеваниях в клетках наблюдается гетероплазмия, то есть разное соотношение митохондрий с нормальной и мутированной ДНК. Вероятность наследования по митохондриальной ДНК (мтДНК) зависит от процента мутантных митохондрий. При гомоплазмии все митохондрии содержат мутантный участок, и вероятность наследования составляет 100%. По митохондриальному типу наследуется атрофия зрительного нерва Лебера, митохондриальная энцефаломиопатия, синдром Лея, болезнь Кернса-Сейра (около 10 заболеваний). Одна из гипотез старения констатирует прогрессирующее нарушение реакций окислительного фосфорилирования митохондрий, в результате накопления мутаций мтДНК соматических клеток. Поскольку изменения митохондриального генома приводят к нарушению пируватдегидрогеназного комплекса, дефектам ферментов дыхательной цепи, β-окисления и цикла Кребса, в клинической картине данных заболеваний ведущими являются тяжелые поражения центральной нервной системы, органов зрения, сердца и мышц.
Клинико-генеалогический метод остается основным приемом клинической диагностики наследственных болезней. Он относительно прост и доступен каждому практическому врачу. Им должен владеть современный врач любой специальности, так как он помогает постановке правильного диагноза.
Близнецовый метод
Близнецовый метод изучения генетики человека введен в медицинскую практику Ф. Гальтоном в 1876 году, который предложил использовать метод анализа близнецов для разграничения роли наследственности и среды в развитии различных признаков у человека. Близнецовый метод используется в генетике человека для изучения закономерностей наследования признаков в парах одно- и двуяйцевых близнецов. Позволяет выявить наследственный характер признака, определить пенетрантность аллеля, оценить эффективность действия на организм некоторых внешних факторов (лекарственных препаратов, обучения, воспитания). Исследователь работает с парами близнецов, изучая у них наличие и степень выраженности интересующего его признака, сопоставляя: монозиготных или однояйцовых близнецов с дизиготными или двуяйцовыми, партнеров в монозиготных парах между собой, данные анализа близнецовой выборки с общей популяцией. Однояйцевые близнецы развиваются из одной оплодотворенной яйцеклетки и имеют одинаковую конституцию, поэтому выявляемые между ними различия не связаны с наследственными факторами. Двуяйцевые близнецы развиваются из разных яйцеклеток, оплодотворенных разными сперматозоидами. Степень их генетического сходства такая же, как у обычных братьев и сестер. Но благодаря одновременному рождению они имеют больше общих средовых факторов. Частота рождения близнецов в популяции составляет около 1%, на долю монозиготных приходится 30%. Рождение однояйцовых близнецов часто передается по женской линии.
Результатом сравнения двух групп близнецов является расчет идентичности или конкордантности различных признаков или болезней, проявляющихся у каждого из пары близнецов К=(n/N) х100, где n-число пар близнецов, у которых признак присутствует у обоих партнеров, N-общее число обследуемых пар.
Определение степени конкордантности у близнецов имеет не только теоретическое значение, но и прямой практический выход, так как позволяет прогнозировать риск возникновения того или иного заболевания у второго партнера по близнецовой паре. С помощью близнецового метода можно оценивать проявляемость действия гена у носителей (пенетрантность), что позволяет успешно и рано включать лечебные средства для коррекции патологических нарушений.
Установление показателя дисконкордантности по уровню пенетрантности также имеет важное практическое значение, так как позволяет оценить вклад факторов среды в реализацию признака и в случае патологии принять необходимые меры профилактики в отношении второго близнеца из близнецовой пары (особенно при прогнозировании мультифакториальной патологии).
Количественной оценкой доли наследственной обусловленности признака является коэффициент наследуемости (формула Хольцингера): Н=(Км.б.-Кд.б.)/(100-Кд.б.), где Км.б., Кд.б. – конкордантность признака для моно- и дизиготных близнецов в %. Если Н>70%, решающая роль в проявлении признака принадлежит наследственным факторам. При Н<30% средовые факторы являются основными в формировании признака. При промежуточных значениях предполагается участие в контроле признака как генетических, так и средовых факторов.
Близнецовый метод в последние годы применяется редко, в основном используется специалистами по медицинской психологии.
Цитогенетический метод
Цитогенетический метод основан на микроскопическом изучении хромосом. Хромосомы, как индивидуальные структуры становятся доступными в период деления клетки в результате значительного укорочения и утолщения. Наиболее удобной для изучения является стадия метафазы митоза, когда хромосомы наиболее спирализованы и находятся на экваторе клетки. Цитогенетический метод – основа кариотипирования, изучения идиограмм, исследования полового хроматина.
Кариотип – диплоидный набор хромосом клетки, характеризующийся количеством, величиной и формой. Систематизированное изображение кариотипа, где хромосомы пронумерованы в соответствии с их величиной, формой и расположению центромеры называют идиограммой. В 1960г. в г. Денвере, университете штата Колорадо (США) была разработана первая Международная классификация хромосом человека (Денверская классификация), согласно которой все хромосомы человека подразделили на 7 групп в зависимости от формы, размеров хромосом и расположения центромеры. Важным параметром этой классификации является центромерный индекс (ЦИ) хромосом, т.е. отношение длины короткого плеча к длине всей хромосомы (в %).
1. Группа А: 1, 2, 3 крупные метацентрические и субметацентрические хромосомы, ЦИ от 38 до 49
2. Группа В: 4, 5 крупные субметацентрические хромосомы, ЦИ 24-30
3. Группа С: 6 - 12 средние субметацентрические хромосомы, ЦИ 27-35
4. Группа Д: 13 - 15 средние акроцентрические хромосомы, ЦИ около 15
5. Группа Е: 16 - 18 мелкие субметацентрические хромосомы, ЦИ 26-40
6. Группа F: 19, 20 самые мелкие метацентрические хромосомы, ЦИ 36-46
7. Группа G: 21, 22 мелкие акроцентрические хромосомы, ЦИ 13-33
} Х – хромосома относится к группе С
} У – хромосома относится к группе G
Методы изучения хромосом:
1. Прямой метод – исследование клеток костного мозга (используется редко);
2. Непрямые методы: исследование клеток крови, фибробластов кожи, клетки абортированного плода, некропсия органов.
Наиболее удобным обьектом для медицинских генетиков являются лимфоциты периферической крови. Берут 1-2 мл крови и добавляют ее в смесь питательной среды с фитогемагглютинином (белок бобовых растений), стимулирующий деление клеток. Продолжительность культивирования составляет 48-72 часа. Затем добавляют колхицин, разрушающий нити веретена деления и прекращение митоза на стадии метафазы. Гипотонический шок вызывают гипотоническим раствором хлорида кальция или цитрата натрия, благодаря чему клетка набухает и лопается. Хромосомы фиксируют, окрашивают и микроскопируют.
Типы окраски: 1) метод Гимзе – рутинная окраска, при которой возможна только групповая идентификация хромосом и определение числовых аномалий кариотипа; 2) дифференциальное окрашивание: а) методы, выявляющие поперечную исчерченность (чередование светлых и темных поперечных полос), специфичную для каждой хромосомы – Q, G и R-окрашивание; б) методы, селективно окрашивающие определенные участки хромосом – C, T и др.
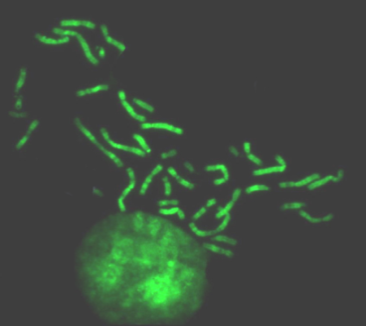 В 1968г. Т. Касперсон предложил метод окрашивания хромосом квинакрином с последующим облучением их ультрафиолетом и индукцией флюоресценции. Оказалось, что в разных районах хромосом выявляется разное число сайтов связывания красителя, которые к тому же сильно варьировали по размерам и интенсивности свечения. Наборы флюоресцирующих полос создавали индивидуальность не только целых хромосом, но и их плеч. В результате каждую хромосому оказалось возможным идентифицировать (Q окраска).
В 1968г. Т. Касперсон предложил метод окрашивания хромосом квинакрином с последующим облучением их ультрафиолетом и индукцией флюоресценции. Оказалось, что в разных районах хромосом выявляется разное число сайтов связывания красителя, которые к тому же сильно варьировали по размерам и интенсивности свечения. Наборы флюоресцирующих полос создавали индивидуальность не только целых хромосом, но и их плеч. В результате каждую хромосому оказалось возможным идентифицировать (Q окраска).
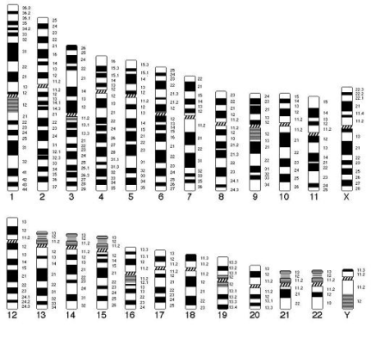 В 1971г. К. Шо, Э. Самнер и У. Шнедл предложили G-окраску. Препараты после предварительной щелочной обработки инкубируют в солевом растворе, а затем окрашивают красителем Романовского-Гимза. В результате появляются темные поперечные полосы. Полосам присваивают определенные номера и относительно них картируют гены. При дифференциальном окрашивании метафазных хромосом в кариотипе человека можно выявить от 200 до 400 специфических полос (бэндов). Если же вместо метафазных хромосом использовать прометафазные хромосомы, то общее число полос в кариотипе может быть увеличено до 800-1200.
В 1971г. К. Шо, Э. Самнер и У. Шнедл предложили G-окраску. Препараты после предварительной щелочной обработки инкубируют в солевом растворе, а затем окрашивают красителем Романовского-Гимза. В результате появляются темные поперечные полосы. Полосам присваивают определенные номера и относительно них картируют гены. При дифференциальном окрашивании метафазных хромосом в кариотипе человека можно выявить от 200 до 400 специфических полос (бэндов). Если же вместо метафазных хромосом использовать прометафазные хромосомы, то общее число полос в кариотипе может быть увеличено до 800-1200.
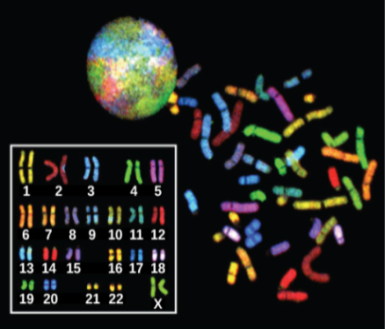 Структурные хромосомные аномалии выявляются только при дифференциальном окрашивании. Существуют также дифференцированная энзиматическая окраска, многоцветная флюоресцентная окраска (FISH – fluorescent in situ hybridization), позволяющие определить внутрихромосомные перестройки.
Структурные хромосомные аномалии выявляются только при дифференциальном окрашивании. Существуют также дифференцированная энзиматическая окраска, многоцветная флюоресцентная окраска (FISH – fluorescent in situ hybridization), позволяющие определить внутрихромосомные перестройки.
Показания к кариотипированию:
1. Множественные врожденные пороки развития
2. Привычные выкидыши
3. Недифференцированные олигофрении
4. Подозрение на семейную транслокацию
5. Пренатальная диагностика у беременной женщины после 35 лет (или мужа после 45 лет)
6. Уточнение диагноза при нарушении в системе половых хромосом
7. Нарушение репродуктивной функции неясного генеза
Природа полового хроматина
С самого раннего периода развития гистологии и цитологии в ядре были замечены интенсивно окрашивающиеся структуры. Их назвали прохромосомами, хромоцентрами, и считалось, что в этих местах хроматин проявляет положительный гетеропикноз. В настоящее время данные структуры определяются как гетерохроматин, в отличие от слабо окрашивающегося эухроматина. Впоследствии, в 1949 году, в журнале «Nature» была опубликована работа М. Бара и Ч. Бертрама, в которой ученые описали морфологические различия в нейронах самок и самцов. Открытие особых образований – глыбок гетерохроматина в интерфазных ядрах соматических клеток (телец Барра) позволило в дальнейшем использовать 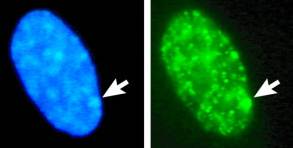 половой хроматин для решения некоторых диагностических вопросов медицинской генетики. Тельце Барра соответствует одной из двух Х-хромосом в клетках особей женского пола. В клетках у мужчин половой хроматин практически отсутствует, хотя некоторые авторы указывают на обнаружение 2-3% подобных глыбок. Первоначально для определения полового хроматина применяли биопсию кожи, но вскоре был описан метод исследования мазка слизистой оболочки ротовой полости. Суть метода в том, что штапелем делается соскоб с внутренней оболочки щеки, наносится на предметное стекло, фиксируется смесью спирта и эфира, окрашивается ацетоорсеином (крезил-виолетом или по Фельгену), с последующей микроскопией х1000.
половой хроматин для решения некоторых диагностических вопросов медицинской генетики. Тельце Барра соответствует одной из двух Х-хромосом в клетках особей женского пола. В клетках у мужчин половой хроматин практически отсутствует, хотя некоторые авторы указывают на обнаружение 2-3% подобных глыбок. Первоначально для определения полового хроматина применяли биопсию кожи, но вскоре был описан метод исследования мазка слизистой оболочки ротовой полости. Суть метода в том, что штапелем делается соскоб с внутренней оболочки щеки, наносится на предметное стекло, фиксируется смесью спирта и эфира, окрашивается ацетоорсеином (крезил-виолетом или по Фельгену), с последующей микроскопией х1000.
Существование полов, а особенно то обстоятельство, что пол животного задается различиями по половым хромосомам, ставит перед системами регуляции экспрессии генов проблему: если гены, сцепленные с Х-хромосомой, будут экспрессироваться с разными интенсивностями у особей обоих полов, то количество продуктов экспрессии в клетках самки будет в 2 раза больше, чем в клетках самца. Чтобы избежать такой ситуации существует явление компенсации доз генов. Суть явления состоит в выравнивании интенсивности экспрессии генов, расположенных на Х-хромосоме, между полами. У млекопитающих этот механизм представлен полной инактивацией одной из двух Х-хромосом в женском организме, в результате чего у самок активна только одна Х-хромосома, что эквивалентно ситуации с самцами. Мишенью для регуляции служит вся хромосома в целом, т.е. затрагиваются все промоторы на хромосоме. Хромосома переходит в состояние гетерохроматина. Возможный механизм инактивации Х-хромосомы связан с локусом Xic, где содержится ген, названный Xist. Ген Xist служит матрицей для синтеза Xist РНК (X inactive specific transcript), в которой нет открытых рамок считывания (она не является кодирующей). РНК Xist «обволакивает» данную Х-хромосому, тем самым ее инактивируя. По наличию лишнего или отсутствию тельца Барра можно диагностировать некоторые виды наследственных заболеваний, связанных с количеством половых хромосом (синдромы Клайнфельтера, Шерешевского-Тернера, полисомия по Х-хромосоме). Показаниями к исследованию полового хроматина являются: пренатальная диагностика пола, невыясненный пол новорожденного, недифференцированная олигофрения, первичная аменорея, нарушения менструального цикла и бесплодие у мужчин и женщин.
Наряду с методом определения полового хроматина, есть флюоресцирующий метод определения числа У-хромосом. Каждая У-хромосома имеет вид флюоресцирующей палочки; сколько У-хромосом в клетке, столько и флюоресцирующих палочек.
Дата: 2018-11-18, просмотров: 526.