Анизотропия кристаллов
Любое вещество может находиться в трёх агрегатных состояниях: твёрдом, жидком, газообразном.
Подавляющие большинство металлов получают путём кристаллизации из жидкого состояния. Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии. Состояние любого вещества определяется температурой и давлением.
Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии. Как известно, любая система обладает запасом внутренней энергии, которая формально состоит из двух частей – свободной энергии F и так называемой связанной энергииTS, тогда
F=U- TS,
где U – полная энергия;
T – абсолютная температура системы;S – энтропия.
Энтропия служит мерой внутреннего беспорядка (хаотичности) в расположении частиц системы. Равенство свободных энергий жидкого и твёрдого состояний при температуре, равной T S, обусловливает их сосуществование – состояние равновесия.
При температурах ниже T S будет происходить кристаллизация, а вышеT S – плавление металла. В этой (•), равнойТ S, жидкая и твёрдая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. ТемператураТ S –равновесная илитео-
ретическая температура кристаллизации.
| Рис. 7. Зависимость энергии | Рис. 8. Зависимости |
| вещества от температуры | свободной энергии |
| твёрдого и жидкого | |
| состояний вещества |
13
Равновесное состояние – когда в сплаве все фазы, присущие этой системе, оформлены. Это состояние обеспечивается при медленном охлаждении, можно различать размеры и формы фаз. Неравновесное состояние – процесс образования и обособления фаз не закончился, образуется при быстром охлаждении.
Изменение температуры приведёт к нарушению равновесия, окажется возможным переход вещества в фазу с меньшей свободной энергией.
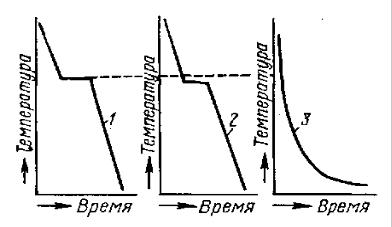
На кривой 1 показан идеальный процесс кристаллизации металла без переохлаждения. Сначала температура понижается равномерно – кривая идёт вниз. При достижении температуры затвердевания падение температуры прекращается – на кривой образуется горизонтальный участок.
Рис. 9. Кривые охлаждения при кристаллизации:
1 – теоретическая кривая кристаллизации металла;
2 – кривая кристаллизации металла с переохлаждением;
3 – кривая кристаллизации неметалла
Это объясняется тем, что группировка атомов идёт с выделением тепла. По окончании затвердевания температура снова понижается. По закону кристаллизации чистых металлов каждый металл кристаллизуется при строго индивидуальной температуре. Практически кристаллизация протекает несколько иначе, так как часто имеет место переохлаждение, т.е. металл при температуре затвердевания остаётся жидким, и кристаллизация начинается при более низкой температуре. Разница между идеальной и истинной температурой кристаллизации называется степенью переохлаждения.
Кривая 2 соответствует процессу кристаллизации с переохлаждением.
14
Кривая 3 характерна для кристаллизации неметаллов: нет чётко выраженной температуры кристаллизации, затвердевание происходит постепенно. Постоянная температура кристаллизации – это свойство, которое отличает кристаллическое тело от аморфного.
Дата: 2018-09-13, просмотров: 851.