Метилирование ДНК остается первым и одним из основных факторов регуляции экспрессии генов, чей диагностический и прогностический потенциал раскрыт еще не полностью. В 1948 году Rollin Hotchkiss выделил 5-метилцитозин в составе ДНК из тимуса теленка, хотя, пятый нуклеотид, 5-метил-дезоксицитидин, был впервые описан в ДНК из туберкулезной бациллы в 1925 г. Российский ученый Б.Ф.Ванюшин еще в 1959 г. определил природу метилируемых последовательностей ДНК у разных видов организмов и предположил, что «метилирование ДНК контролирует все генетические процессы в клетке». Robin Holliday в 1975 г. обосновал роль метилирования ДНК в регуляции работы гена и предложил термин «эпимутация», а в 1979 г. определил вклад метилирования ДНК в процесс канцерогенеза.
Метилирование - обратимая ковалентная модификация ДНК, при которой цитозиновый остаток в CрG-динуклеотиде метилируется в позиции С5 пиримидинового кольца. Метилирование цитозиновых остатков происходит с помощью ДНК-метилтрансфераз (DNMT), переносящих метильную группу S-аденозилметионина. Такая модификация стабильно поддерживается в ряду клеточных делений. Последнее обеспечивает целое семейство ДНК-метилтрансфераз. Метилирование de novo осуществляют DNMT3a и DNMT3b. Поддерживающее метилирование выполняет DNMT1, которая метилирует СрG-динуклеотиды комплементарной неметилированной цепи ДНК, превращая гемиметилированную ДНК в гомометилированную.
Мишенью метилирования в ДНК является цитозин, входящий в состав CpG-динуклеотидов. В геноме существует два типа распределения CpG-динуклеотидов: рассеянные CpG, присутствующие в виде одиночных динуклеотидов и составляющие около 80% их общего числа, и районы обогащения CpG, называемые CpG-островками (рис. 1).
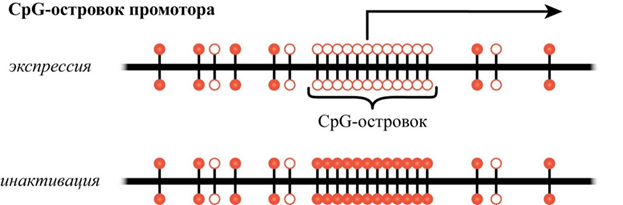
Рисунок 1. Метилирование CpG-островка приводит к инактивации экспрессии гена: заштрихованные кружки — метилированные CpG-динуклеотиды; стрелка — экспрессия гена.
Одиночные CpG чаще всего обнаруживают в межгенных и, реже, в транскрибируемых последовательностях. CpG-островки располагаются вблизи структурных генов, преимущественно в 5'-районах, и содержат регуляторные последовательности, характерные для промоторных областей. CpG-островки присутствуют в промоторных районах 60% генов и составляют от 0,5 до 1,5 тыс. пар нуклеотидов. Содержание С+G превышает 60%, а соотношение CpG/GpC не должно быть ниже 0,6. За редким исключением (импринтированные гены) CpG-островки промоторных районов в нормальных тканях не метилированы, что свидетельствует о функциональном состоянии гена. Как показали недавние исследования, CpG-островки, подвергающиеся дифференциальному метилированию при патологии, могут иметь не только каноническую локализацию, но и располагаться в межгенных областях, первых экзонах и интронах генов. Тканеспецифические гены, как правило, не имеют в своих промоторах CpG-островков. В них присутствуют одиночные CG-динуклеотиды, степень метилирования которых варьирует в широких пределах в разных клетках и тканях и препятствует локальному связыванию факторов транскрипции, хотя существуют транскрипционные факторы, которые не чувствительны к метилированию и могут связываться с промоторными районами генов, повышая их экспрессию.
В последнее время выяснилось, что метилирование цитозина в стволовых, нейрональных и некоторых других типах клеток возможно не только в CpG, но и в СрН, где Н может быть любым нуклеотидом, кроме G. Вполне вероятно, что такое метилирование тоже функционально, так как оно консервативно в различных тканях и негативно коррелирует с экспрессией гена. Кроме того, метил-связывающий белок MeCP2, которому достаточно одного метилированного CpG для связывания, реагирует также и на СрН. Относительная аффинность MeCP2 с mСрА схожа с mCpG, но значительно ниже с mСрТ и mСрС. Метилирование осуществляется теми же DNMT.
Вплоть до 2009 года было непонятно, как происходит деметилирование ДНК, как пассивное, так и активное, пока не было обнаружено семейство белков ТЕТ. Белки ТЕТ получили свое название за счет ten-eleven translocation - t(10;11)(q22;q23), обнаруженной в отдельных случаях миелоидной и лимфоцитарной лейкемии и приводящей к образованию химерного гена MLL1/TET1. Белки ТЕТ1, ТЕТ2, ТЕТ3 являются Fe2+ и 2-оксоглютарат-зависимыми диоксигеназами окисляющими 5-mC. Они могут последовательно окислять 5-метилцитозин до 5-гидроксиметилцитозина (5hmC), затем до 5-формилцитозина (5fC) и далее до карбоксилцитозина (5caC). 5fC и 5caC могут быть вырезаны тимидин ДНК- гликозилазой и заменены на цитозин с помощью механизма эксцизионной репарации (рисунок 2А). Другими возможными механизмами деметилирования являются: 1) декарбоксилирование 5саС, 2) опосредованное DNMT удаление гидроксиметильной группы с 5hmС и 3) деаминирование 5hmС цитидиновыми деаминазами AID и APOBEC до 5hmU, который может вырезаться SMUG1 - урацил ДНК-гликозилазой. Такой вариант относится к активному деметилированию. В то же время существует механизм пассивного деметилирования (рисунок 2Б). После репликации метилированной ДНК образуется две цепи, одна из которых остается метилированной, а дочерняя цепь не метилирована. Обычно дочерняя цепь метилируется с помощью поддерживающей метилирование DNMT1. Необходимый для этого процесса белок UHRF1 связывается с полуметилированной ДНК и привлекает DNMT1 для метилирования второй цепи ДНК.
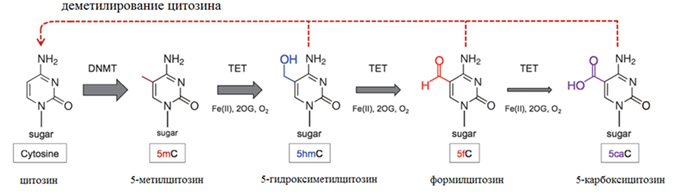
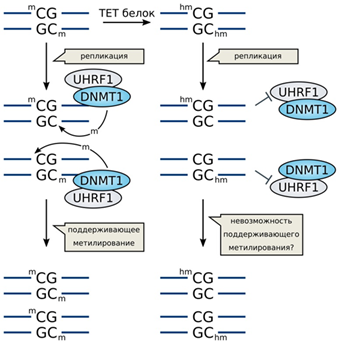
Рисунок 2. А. Механизм активного деметилирования цитозина; Б. Механизм пассивного деметилирования цитозина (пояснения в тексте).
Однако UHRF1 не узнает и не может связаться с 5hmС, а, следовательно, DNMT1 не может метилировать дочернюю цепь. В результате, в последующих актах репликации цитозин также не будет метилирован, что, в результате, приводит к постепенному снижению метилирования ДНК.
В то же время, окисленные формы 5mС, видимо, имеют какое-то функциональное значение. Их значительно меньше в геноме, чем mCpG (80-90%), так 5hmC составляет 1-30%, а 5fC и 5caC – 8-10%, в зависимости от типа клеток. 5hmC обычно обнаруживают в районах энхансеров и сайтах гиперчувствительности к ДНКазе I, 5fC – в межгенных районах, в экзонах и неработающих энхансерах, 5caC – в районах, обогащенных большими сателлитными повторами, но все они, в большей или меньшей степени, окружают районы связывания белков с ДНК. В частности, MeCP2 и THA11 могут связываться с 5hmC, а FOXK1, FOXK2, FOXP1, FOXP4 и FOXI3 активно взаимодействуют с 5fC. Все это свидетельствует в пользу их функциональной значимости.
Аналогично метилированию ДНК происходит метилирование аденозина мРНК, tРНК или длинных некодирующих РНК в позиции N6 (6mA). Установлено, что процесс метилирования/деметилирования РНК очень динамичный, осуществляемый комплексом РНК-метилтрансфераз и РНК-деметилазами, которые могут окислить 6mA до 6hmA и 6fA. Нокдаун этих ферментов приводит к уменьшению размеров клеток, к их ремоделированию или гибели. Так же удалось определить ряд белков, которые взаимодействуют с 6mA. Такая модификация мРНК, по-видимому, играет важную роль в регуляции экспрессии генов, процессах развития, клеточного роста, метаболизма, выживания и межклеточных контактов. Функциональную значимость 6mA, 6hmA и 6fA еще предстоит выяснить.
Обнаружение зависимости между снижением (выключением) экспрессии гена и метилированием его промоторной области является веским доводом в пользу того, что такая модификация ДНК может служить эпигенетическим механизмом регуляции экспрессии генов. Метилирование включает и другие механизмы, способствующие более полной инактивации экспрессии гена.
Дата: 2019-12-10, просмотров: 654.