Относительная селективность ионных возбудимых мембран.
Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость.
Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия m-ворот происходит закрытие п-ворот, расположенных у выхода натриевых каналов (инактивация) (рис. 2.4). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула.
Работа натриевых каналов определяется величиной мембранного потенциала в соответствии с определенными законами вероятности. Рассчитано, что активированный натриевый канал пропускает всего 6000 ионов за 1 мс. При этом весьма существенный натриевый ток, который проходит через мембраны во время возбуждения, представляет собой сумму тысяч одиночных токов.
При генерации одиночного потенциала действия в толстом нервном волокне изменение концентрации ионов Na+ во внутренней среде составляет всего 1/100000 от внутреннего содержания ионов Na гигантского аксона кальмара. Однако для тонких нервных волокон это изменение концентрации может быть весьма существенным.
Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов (см. табл. 2.1).
Ходжкин и Хаксли сформулировали принцип «независимости» каналов, согласно которому потоки натрия и калия через мембрану независимы друг от друга.
Свойство проводимости различных каналов неодинаково. В частности, для калиевых каналов процесс инактивации, как для натриевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя.
Особый интерес представляют кальциевые каналы.
Входящий кальциевый ток, как правило, недостаточно велик, чтобы нормально деполяризовать клеточную мембрану. Чаще всего поступающий в клетку кальций выступает в роли «мессенджера», или вторичного посредника. Активация кальциевых каналов обеспечивается деполяризацией клеточной мембраны, например входящим натриевым током.
Процесс инактивации кальциевых каналов достаточно сложен. С одной стороны, повышение внутриклеточной концентрации свободного кальция приводит к инактивации кальциевых каналов. С другой стороны, белки цитоплазмы клеток связывают кальций, что позволяет поддерживать длительное время стабильную величину кальциевого тока, хотя и на низком уровне; при этом натриевый ток полностью подавляется. Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.
Потенциал покоя
Схема опыта Ходжкина—Хаксли приведена на рис. 2.7. В аксон кальмара диаметром около 1 мм, помещенный в морскую воду, вводили активный электрод, второй электрод (электрод сравнения) находился в морской воде. В момент введения электрода внутрь аксона регистрировали скачок отрицательного потенциала, т. е. внутренняя среда аксона была заряжена отрицательно относительно внешней среды.
Как указывалось в разделе 2.1.2, электрический потенциал содержимого живых клеток принято измерять относительно потенциала внешней среды, который обычно принимают равным нулю. Поэтому считают синонимами такие понятия, как трансмембранная разность потенциалов в покое, потенциал покоя, мембранный потенциал. Обычно величина потенциала покоя колеблется от -70 до -95 мВ. Согласно концепции Ходжкина и Хаксли, величина потенциала покоя зависит от ряда факторов, в частности от селективной (избирательной) проницаемости клеточной мембраны для различных ионов; различной концентрации ионов цитоплазмы клетки и ионов окружающей среды (ионной асимметрии); работы механизмов активного транспорта ионов. Все эти факторы тесно связаны между собой и их разделение имеет определенную условность.
Известно, что в невозбужденном состоянии клеточная мембрана высокопроницаема для ионов калия и малопроницаема для ионов натрия. Это было показано в опытах с использованием изотопов натрия и калия: спустя некоторое время после введения внутрь аксона радиоактивного калия его обнаруживали во внешней среде. Таким образом, происходит пассивный (по градиенту концентраций) выход ионов калия из аксона. Добавление радиоактивного натрия во внешнюю среду приводило к незначительному повышению его концентрации внутри аксона. Пассивный вход натрия внутрь аксона несколько уменьшает величину потенциала покоя.
3.Равновесное состояние для ионов К+
Установлено, что имеется разность концентраций ионов калия вне и внутри клетки, причем внутри клетки ионов калия примерно в 20—50 раз больше, чем вне клетки
Разность концентраций ионов калия вне и внутри клетки и высокая проницаемость клеточной мембраны для ионов калия обеспечивают диффузионный ток этих ионов из клетки наружу и накопление избытка положительных ионов К+ на наружной стороне клеточной мембраны, что противодействует дальнейшему выходу ионов К+ из клетки. Диффузионный ток ионов калия существует до тех пор, пока стремление их двигаться по концентрационному градиенту не уравновесится разностью потенциалов на мембране. Эта разность потенциалов называется калиевым равновесным потенциалом.
Равновесный потенциал (для соответствующего иона, Ек) — разность потенциалов между внутренней средой клетки и внеклеточной жидкостью, при которой вход и выход иона уравновешен (химическая разность потенциалов равна электрической).
Важно подчеркнуть следующие два момента: 1) состояние равновесия наступает в результате диффузии лишь очень небольшого количества ионов (по сравнению с их общим содержанием); калиевый равновесный потенциал всегда больше (по абсолютному значению) реального потенциала покоя, поскольку мембрана в покое не является идеальным изолятором, в частности имеется небольшая утечка ионов Na+. Сопоставление теоретических расчетов с использованием уравнений постоянного поля Д. Голдмана, формулы Нернста показали хорошее совпадение с экспериментальными данными при изменении вне- и внутриклеточной концентрации К+ (рис. 2.8).
4.Трансмембранная диффузионная разность потенциалов рассчитывается по формуле Нернста:
Ek=(RT/ZF)ln(Ko/Ki)
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, Z — валентность нона, F — постоянная Фарадея, Ко и Ki — концентрации ионов К+ вне и внутри клетки соответственно.
Величина мембранного потенциала для значений концентрации ионов К+, приведенных в табл. 2.2, при температуре +20 °С составит примерно —60 мВ. Поскольку концентрация ионов К+ вне клетки меньше, чем внутри, Ек будет отрицательным.
В состоянии покоя клеточная мембрана высокопроницаема не только для ионов К+. У мышечных волокон мембрана высокопроницаема для ионов СГ. В клетках с высокой проницаемостью для ионов Сl-, как правило, оба иона (Сl- и К+) практически в одинаковой степени участвуют в создании потенциала покоя.
Известно, что в любой точке электролита количество анионов всегда соответствует количеству катионов (принцип электронейтральности), поэтому внутренняя среда клетки в любой точке электронейтральна. Действительно, в опытах Ходжкина, Хаксли и Катца перемещение электрода внутри аксона не выявило различие в трансмембранной разности потенциалов.
Поскольку мембраны живых клеток в той или иной степени проницаемы для всех ионов, совершенно очевидно, что без специальных механизмов невозможно поддерживать постоянную разность концентрации ионов (ионную асимметрию). В клеточных мембранах существуют специальные системы активного транспорта, работающие с затратой энергии и перемещающие ионы против градиента концентраций. Экспериментальным доказательством существования механизмов активного транспорта служат результаты опытов, в которых активность АТФазы подавляли различными способами, например сердечным гликозидом оуабаином. При этом происходило выравнивание концентраций ионов К+ вне и внутри клетки и мембранный потенциал уменьшался до нуля.
5. К- Na-насос
Важнейшим механизмом, поддерживающим низкую внутриклеточную концентрацию ионов Na+ и высокую концентрацию ионов К+, является натрий-калиевый насос (рис. 2.9). Известно, что в клеточной мембране имеется система переносчиков, каждый из которых связывается с 3 находящимися внутри клетки ионами Na+ и выводит их наружу. С наружной стороны переносчик связывается с 2 находящимися вне клетки ионами К+, которые переносятся в цитоплазму. Энергообеспечение работы систем переносчиков обеспечивается АТФ. Функционирование насоса по такой схеме приводит к следующим результатам.
1. Поддерживается высокая концентрация ионов К+ внутри клетки, что обеспечивает постоянство величины потенциала покоя. Вследствие того что за один цикл обмена ионов из клетки выводится на один положительный ион больше, чем вводится, активный транспорт играет роль в создании потенциала покоя. В этом случае говорят об электрогенном насосе. Однако величина вклада электрогенного насоса в общее значение потенциала покоя обычно невелика и составляет несколько милливольт.
2. Поддерживается низкая концентрация ионов натрия внутри клетки, что, с одной стороны, обеспечивает работу механизма генерации потенциала действия, с другой — обеспечивает сохранение нормальных осмолярности и объема клетки.
3. Поддерживая стабильный концентрационный градиент Na+, натрий-калиевый насос способствует сопряженному транспорту аминокислот и сахаров через клеточную мембрану.
Таким образом, возникновение трансмембранной разности потенциалов (потенциала покоя) обусловлено высокой проводимостью клеточной мембраны в состоянии покоя для ионов К+ (для мышечных клеток и ионов Сl-), ионной асимметрией концентраций для ионов К+ (для мышечных клеток и для ионов Cl-), работой систем активного транспорта, которые создают и поддерживают ионную асимметрию.
Типы нервных волокон.
Дж. Эрлангер и X. Гассер (1937) впервые классифицировали нервные волокна пс скорости проведения возбуждения.
Классификацию нервных волокон по Эрлангеру - Гассеру давала нам Обухова, в лекции «Функциональная анатомия нервной системы», смотрите там, в учебнике по физиологии есть небольшие расхождения.
В зависимости от скорости проведения возбуждения нервные волокна делят на три типа: А, В, С.
В свою очередь волокна типа А подразделяют на четыре группы: Аα, Aβ, Aγ, Aδ.
Волокна типа А – толстые миелиновые нервные волокна. Эти волокна проводят возбуждение от спинальных моторных нервных центров (двигательных центров спинного мозга) к скелетным мышцам (двигательные волокна) и от рецепторов мышц к соответствующим нервным центрам.
Другие группы волокон типа А (β, γ, δ) имеют меньший диаметр. Волокна этих групп преимущественно проводят возбуждение от различных рецепторов (тактильных, температурных, болевых; рецепторов внутренних органов или висцерорецепторов) в ЦНС, за исключением γ-волокон, значительная часть которых проводит возбуждение от спинного мозга к интрафузальным мышечным волокнам.
К волокнам типа В относятся миелинизированные преганглионарные волокна вегетативной нервной системы.
К волокнам типа С относятся безмиелиновые нервные волокна. Большинство волокон типа С — это постганглионарные волокна симпатического отдела вегетативной нервной системы, а также нервные волокна, которые проводят возбуждение от болевых рецепторов, некоторых терморецепторов и рецепторов давления.
Локальные ионные токи и ПД
Анализ ионной природы потенциала действия позволил установить, что фронт нарастания потенциала действия и перезарядка мембраны (овершут) обусловлены движением ионов натрия внутрь клетки.
Натриевые каналы оказались электроуправляемыми. Деполяризующий толчок тока приводит к активации натриевых каналов и увеличению натриевого тока. Это обеспечивает локальный ответ. Смещение мембранного потенциала до критического уровня приводит к стремительной деполяризации клеточной мембраны и обеспечивает фронт нарастания потенциала действия. Если удалить ион Na+ из внешней среды, то потенциал действия не возникает. Аналогичный эффект удавалось получить при добавлении в перфузионный раствор ТТХ (тетродотоксин) — специфического блокатора натриевых каналов. При использовании метода «voltage-clamp» было показано, что в ответ на действие деполяризующего тока через мембрану протекает кратковременный (1—2 мс) входящий ток, который сменяется через некоторое время выходящим током. При замене ионов натрия на другие ионы и вещества, например холин, удалось показать, что входящий ток обеспечивается натриевым током, т. е. в ответ на деполяризующий стимул происходит повышение натриевой проводимости (gNa+). Таким образом, развитие фазы деполяризации потенциала действия обусловлено повышением натриевой проводимости.
Критический потенциал определяет уровень максимальной активации натриевых каналов. Если смещение мембранного потенциала достигает значения критического уровня потенциала, то процесс поступления ионов Na+ в клетку лавинообразно нарастает. Система начинает работать по принципу положительной обратной связи, т. е. возникает регенеративная (самоусиливающаяся) деполяризация.
На пике потенциала действия проводимость мембраны для ионов натрия (gNa+) начинает быстро снижаться. Этот процесс называется инактивацией. Скорость и степень натриевой инактивации зависят от величины мембранного потенциала, т. е. они потенциалзависимы. При постепенном уменьшении мембранного потенциала до —50 мВ (например, при дефиците кислорода, действии некоторых лекарственных веществ) система натриевых каналов полностью инактивируется и клетка становится невозбудимой.
Потенциалзависнмость активации и инактивации в большой степени обусловлена концентрацией ионов кальция. При повышении концентрации кальция значение порогового потенциала увеличивается, при понижении — уменьшается и приближается к потенциалу покоя. При этом в первом случае возбудимость уменьшается, во втором — увеличивается.
После достижения пика потенциала действия происходит реполяризациая, т. е. мембранный потенциал возвращается к контрольному значению в покое.
Исследование возбудимости клетки во время локального ответа или во время отрицательного следового потенциала показало, что генерация потенциала действия возможна при действии стимула ниже порогового значения. Это состояние супернормальности, или экзальтации.
Продолжительность периода абсолютной рефрактерности ограничивает максимальную частоту генерации потенциалов действия данным типом клеток. Например, при продолжительности периода абсолютной рефрактерности 4 мс максимальная частота равна 250 Гц.
Рис. 1 Фазы ПД
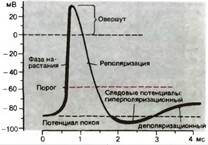
Потенциал действия - это электрический компонент нервного импульса, характеризующий изменения электрического заряда (потенциала) на локальном участке мембраны во время прохождения через него нервного импульса (от -70 до +30 мВ и обратно).
восходящая ветвь графика:
1. потенциал покоя – исходное обычное поляризованное электроотрицательное состояние мембраны (–70 мВ);
2. нарастающий локальный потенциал – пропорциональная раздражителю деполяризация;
3. критический уровень деполяризации (–50 мВ) – резкое ускорение деполяризации (за счет самораскрытия натриевых каналов), с этой точки начинается спайк – высокоамплитудная часть потенциала действия;
4. самоусиливающаяся круто нарастающая деполяризация;
5. переход нулевой отметки (0 мВ) – смена полярности мембраны;
6. «овершут» – положительная поляризация (инверсия, или реверсия, заряда мембраны);
7. пик (+30 мВ) – вершина процесса изменения полярности мембраны, вершина потенциала действия.
Нисходящая ветвь графика:
8. реполяризация – восстановление прежней электроотрицательности мембраны;
9. переход нулевой отметки (0 мВ) – обратная смена полярности мембраны на прежнюю, отрицательную;
10. переход критического уровня деполяризации (–50 мВ) – прекращение фазы относительной рефрактерности (невозбудимости) и возврат возбудимости;
11. следовые процессы (следовая деполяризация или следовая гиперполяризация);
12. восстановление потенциала покоя – норма (–70 мВ).
Итак, сначала – деполяризация, затем – реполяризация. Сначала – утрата электроотрицательности, затем – восстановление электроотрицательности.
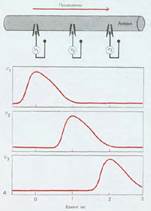 Рис.2 Бездекрементное проведение ПД
Рис.2 Бездекрементное проведение ПД
У высших животных благодаря прежде всего наличию миелиновой оболочки и совершенства метаболизма в нервном волокне возбуждение проходит, не затухая, бездекрементно. Этому способствуют наличие на всем протяжении мембраны волокна равного заряда и быстрое его восстановление после прохождения возбуждения.
В миелиновых волокнах возбуждение охватывает только участки узловых перехватов, т. е. минует зоны, покрытые миелином. Такое проведение возбуждения по волокну называется сальтаторным (скачкообразным). В узловых перехватах количество натриевых каналов достигает 12 000 на 1 мкм , что значительно больше, чем в любом другом участке волокна. В результате узловые перехваты являются наиболее возбудимыми и обеспечивают большую скорость проведения возбуждения. Время проведения возбуждения по миелиновому волокну обратно пропорционально длине между перехватами.
Проведение возбуждения по нервному волокну не нарушается в течение длительного (многочасового) времени. Это свидетельствует о малой утомляемости нервного волокна. Считают, что нервное волокно относительно неутомляемо вследствие того, что процессы ресинтеза энергии в нем идут с достаточно большой скоростью и успевают восстановить траты энергии, происходящие при прохождении возбуждения.
В момент возбуждения энергия нервного волокна тратится на работу натрий-калиевогонасоса. Особенно большие траты энергии происходят в перехватах Ранвье вследствие большой плотности здесь натрий-калиевых каналов.
Нервный ствол образован большим числом волокон, однако возбуждение, идущее по каждому из них, не передается на соседние. Эта особенность проведения возбуждения по нерву носит название закона изолированного проведения возбуждения по отдельному нервному волокну. Возможность такого проведения имеет большое физиологическое значение, так как обеспечивает, например, изолированность сокращения каждой нейромоторной единицы.
Способность нервного волокна к изолированному проведению возбуждения обусловлена наличием оболочек, а также тем, что сопротивление жидкости, заполняющей межволоконные пространства, значительно ниже, чем сопротивления мембраны волокна. Поэтому ток, выйдя из возбужденного волокна, шунтируется в жидкости и оказывается слабым для возбуждения соседних волокон. Необходимым условием проведения возбуждения в нерве является не просто его анатомическая непрерывность, но и физиологическая целостность. В любом металлическом проводнике электрический ток будет течь до тех пор, пока проводник сохраняет физическую непрерывность. Для нервного «проводника» этого условия недостаточно: нервное волокно должно сохранять также физиологическую целостность. Если нарушить свойства мембраны волокна (перевязка, блокада новокаином, аммиаком и др.), проведение возбуждения по волокну прекращается. Другим свойством, характерным для проведения возбуждения по нервному волокну, является способность к двустороннему проведению. Нанесение раздражения между двумя отводящими электродами на поверхности волокна вызовет электрические потенциалы под каждым из них.
Закон “ все или ничего”.
При допороговых раздражениях клетки в ткани ответной реакции не возникает. При пороговой силе раздражителя развивается максимальная ответная реакция, поэтому увеличение силы раздражения выше пороговой не сопровождается ее усилением. В соответствии с этим законом реагирует на раздражения одиночное нервное и мышечное волокно, сердечная мышца.
Со временем была установлена и относительность этого закона. Оказалось, что “все” зависит от функционального состояния ткани (охлаждение, исходное растяжение мышцы и т. д.).
С появлением микроэлектродной техники было установлено еще одно несоответствие: подпороговое раздражение вызывает местное, нераспространяющееся возбуждение, следовательно, нельзя говорить, что допороговое раздражение не дает ничего.
Процесс развития возбуждения подчиняется этому закону с уровня критической деполяризации, когда запускается лавинообразное поступление ионов K+ в клетку.
Вопрос 3
Появление ТПСП связывают с выделением в синаптическую щель специфического медиатора. В синапсах разных нервных структур роль тормозного медиатора могут выполнять различные вещества. Например, в ганглиях моллюсков роль тормозного медиатора выполняет ацетилхолин, в ЦНС высших животных — гамма-аминомасляная кислота, глицин.
Нервно-мышечные синапсы обеспечивают проведение возбуждения с нервного волокна на мышечное благодаря медиатору ацетилхолину , который при возбуждении нервного окончания переходит в синаптическую щель и действует на концевую пластинку мышечного волокна. (Следовательно, как и межнейронный синапс, нервно-мышечный синапс имеет пресинаптическую часть, принадлежащую нервному окончанию, синаптическую щель, постсинаптическую часть (концевая пластинка), принадлежащую мышечному волокну.)
В пресинаптической терминали образуется и скапливается в виде пузырьков ацетилхолин. При возбуждении электрическим импульсом, идущим по аксону, пресинаптической части синапса ее мембрана становится проницаемой для ацетилхолина.
Эта проницаемость возможна благодаря тому, что в результате деполяризации пресинаптической мембраны открываются ее кальциевые каналы. Ион Са2+ входит в пресинаптическую часть синапса из синаптической щели. Ацетилхолин высвобождается и проникает в синаптическую щель. Здесь он взаимодействует со своими рецепторами постсинаптической мембраны, принадлежащей мышечному волокну. Рецепторы, возбуждаясь, открывают белковый канал, встроенный в липидный слой мембраны. Через открытый канал внутрь мышечной клетки проникают ионы Na+, что приводит к деполяризации мембраны мышечной клетки, в результате развивается так называемый потенциал концевой пластинки (ПКП). Он вызывает генерацию ПД мышечного волокна.
Синаптические медиаторы являются веществами, которые имеют специфические инактиваторы. Например, ацетилхолин инактивируется ацетилхолинэстеразой, норадреналин — моноаминоксидазой, катехолометилтрансферазой.
Неиспользованный медиатор и его фрагменты всасываются обратно в пресинаптическую часть синапса.
Синаптические медиаторы
Один из медиаторов – ацетилхолин – уже упоминался. Известен и целый ряд других; наиболее важные функционально и лучше всего изученные приведены в верхней части рис. 3.7 (см ниже).
· ГАМК, т. е. γ–аминомасляная кислота – наиболее распространенный тормозной медиатор ЦНС.
· Более простая по структуре аминокислота–глицин–оказывает, в частности, тормозное действие на мотонейроны .
· Кислая аминокислота глутамат, возможно, самый распространенный возбуждающий медиатор ЦНС.
· Адреналин, норадреналин и дофамин составляют семейство медиаторных веществ, передающих возбуждение или торможение как в центральной, так и в периферической нервной системе; их называют «катехоламины» = Биогенные амины
· Еще одно вещество с близкими свойствами – серотонин (5–гидрокситриптамин, 5–НТ) – объединяют с катехоламинами в группу «моноаминов».
Все эти «классические» медиаторы –низкомолекулярные соединения, нередко образующиеся в качестве промежуточных продуктов метаболизма. Каждый из них связывается со специфическим рецептором постсинаптической мембраны, в результате чего повышается ее проводимость–либо для Na+ (и К+) в случае передачи возбуждения, либо для К+ или С1– с развитием торможения. Единственное определяемое ими звено в этом процессе – взаимодействие с тем или иным рецептором;
конечный итог–возбуждение или торможение зависит исключительно от свойств его ионного канала (см. рис. 3.18) и никак не связан с особенностями самого медиатора.
На рис. 3.7 ниже классических приведены несколько пептидных медиаторов. Механизмы их действия в центральной или вегетативной нервной системе еще как следует не выяснены. По–видимому, они часто служат синаптическими модуляторами, т.е. не изменяют непосредственно проводимость синаптических мембран, а влияют на интенсивность и продолжительность действия классических медиаторов и иногда, видимо, высвобождаются вместе с ними

Рис. 3.7. Важнейшие синаптические медиаторы: вверху–«классические» (ацетилхолин, аминокислоты, моноамины), внизу пептидные
На рис. 3.7 показаны лишь некоторые из большого числа пептидов, изучаемых сейчас с этой точки зрения. Энкефалины связываются с рецепторами морфина, и один из их эффектов – подавление болевых ощущений. К болевой чувствительности имеет отношение еще один медиатор–вещество Р, вызывающее, кроме того, сокращение гладких мышц. Ангиотензин II–гормон местного действия, сильно влияющий на кровеносные сосуды и работу ЦНС; у «вазоактивного кишечного пептида» аналогичные свойства. Соматостатин и ЛГРГ (рилизинг–гормон лютеотропного гормона, или люлиберин) участвуют в регуляции высвобождения гипофизарных гормонов, а также действуют в синапсах.
Вопрос 4
В течение длительного времени считалось, что из окончаний каждой нервной клетки всегда высвобождается только один медиатор (принцип Дейла). Однако в вегетативной нервной системе, по крайней мере у эмбрионов, одни и те же нейроны высвобождают как ацетилхолин, так и адреналин. В двигательной концевой пластинке вместе с ацетилхолином выделяется аденозинтрифосфат, который, вероятно, также служит медиатором. Часто из синаптического окончания высвобождаются одновременно классический медиатор, например норадреналин, и участвующий в нервной передаче пептид. Особенности такого совместного действия медиаторов (сомедиаторов) пока неясны, но его эффект, вероятно, чаще всего сводится к определенному типу модуляции.
Медленные синапсы вегетативной нервной системы. В синаптическом потенциале в пептидергическом синапсе симпатического ганглия есть быстрые возбуждающие синапсы с медиатором ацетилхолином. Кроме того, в опытах с ритмической стимуляцией волокон спинальных нервов (например, 100 стимулов в течение 5 с) зарегистрированы возбуждающие постсинаптические потенциалы, сохраняющиеся в течение нескольких минут и не обусловленные ни одним из классических медиаторов, приведенных в верхней части рис. 3.7. В то же время высокоспецифичное действие одного из пептидов (ЛГРГ) вызывает практически идентичный постсинаптический потенциал. Разнообразные эксперименты показали, что в данном случае медиатором и в самом деле служит этот пептид или близкородственное ему вещество. О функциях медленных синаптических потенциалов в спинномозговых ганглиях ничего не известно; связанная с ними длительная деполяризация могла бы усиливать передачу возбуждения в быстрых синапсах, повышая их эффективность в течение относительно долгого периода времени. Другим примером модуляции служит действие адреналина, продлевающего открытое состояние потенциалзависимых Са2+–каналов.
ВПСП, характеристика
ВПСП-возбуждающий достсинаптический потенциал и его характеристики.
Действие медиатора на постсинаптическую мембрану заключается в повышении ее проницаемости для ионов Na+. Возникновение потока ионов Na+ из синаптической щели через постсинаптическую мембрану ведет к ее деполяризации и вызывает генерацию возбуждающего постсинаптического потенциала (ВПСП)
ВПСП возникает в нейронах при действии в синапсах ацетил холина, норадреналина, дофамина, серотонина, глутаминовой кислоты, вещества Р.
В зависимости от природы медиатора потенциал покоя мембраны может снижаться (деполяризация), что характерно для возбуждения, или повышаться (гиперполяризация), что типично для торможения. Величина ВПСП зависит от количества выделившегося медиатора и может составлять 0,12—5,0 мВ. Под влиянием ВПСП деполяризуются соседние с синапсом участки мембраны, затем деполяризация достигает аксонного холмика нейрона, где возникает возбуждение, распространяющееся на аксон.
В отличие от возбуждения, которая распространяется (ПД), ВПСП является местным. Оно локальное, градуально (зависит от силы раздражения, то есть не подчиняется закону «все или ничего»), способное к суммации предварительной деполяризацией, не оставляет после себя рефрактерности. По своим характеристикам ВПСП идентичен потенциала концевой пластинки (ПКП) в нервно-мышечном соединении. Однако, если ПКП является следствием активации одного синапса, то ВПСП преимущественно возникает при одновременной активации нескольких синапсов.
ВПСП достигает максимума в течение 1,5-2 мс, после чего медленно затухает по экспоненте. Длительность ВПСП многих нейронов ЦНС составляет около 15 мс, а амплитуда может достигать-20-ЗО мВ при величине мембранного потенциала -70 мВ.
ВПСП приближает потенциал клетки к пороговому значению и облегчает возникновение потенциала действия, тогда как ТПСП, напротив, затрудняет возникновение потенциала действия.
Возбуждающий постсинаптический потенциал
В синапсах, в которых осуществляется возбуждение постсинаптической структуры, обычно происходит повышение проницаемости для ионов натрия. По градиенту концентрации Na+ входят в клетку, что вызывает деполяризацию постсинаптической мембраны. Эта деполяризация получила название: возбуждающий постсинаптический потенциал – ВПСП. ВПСП относится к локальным ответам и, следовательно, обладает способностью к суммации. Выделяют временную ипространственную суммацию.
Принцип временной суммации заключается в том, что импульсы поступают к пресинаптическому окончанию с периодом меньшим, чем период ВПСП. Как следствие, новые порции медиатора выделяются в тот момент, когда трансмембранный потенциал еще не вернулся к уровню мембранного потенциала покоя (МПП). Далее новая деполяризация развивается не с уровня МПП, а с текущего уровня трансмембранного потенциала, который ближе к критическому уровню деполяризации (КУД).
Сущность пространственной суммации заключается в одновременной стимуляции постсинаптической мембраны синапсами, расположенными близко друг от друга. В этом случае ВПСП каждого синапса суммируются.
Ионные механизмы ТПСП
Механизмы генерации ТПСП. В пресинаптическом окончании тормозного синапса, активированного пришедшими сюда ПД, происходит выделение тормозного медиатора. Этот медиатор, проникнув в синаптическую щель, взаимодействует с хеморецепторными участками постсинаптической мембраны и увеличивает ее проницаемость преимущественно для ионов Сl- и К+. Возникающий при этом электрический ток в области синапса направлен наружу, а в прилежащих к синапсу участках мембраны внутрь нейрона. Это приводит к гиперполяризации постсинаптической мембраны и возникновению ТПСП.
медиаторы тормозных синапсов
В синапсах разных нервных структур роль тормозного медиатора могут выполнять различные вещества. В ганглиях моллюсков роль тормозного медиатора выполняет ацетилхолин, в ЦНС высших животных — гамма-аминомасляная кислота, глицин.
ВПСП, характеристика
ВПСП-возбуждающий достсинаптический потенциал и его характеристики.
Действие медиатора на постсинаптическую мембрану заключается в повышении ее проницаемости для ионов Na+. Возникновение потока ионов Na+ из синаптической щели через постсинаптическую мембрану ведет к ее деполяризации и вызывает генерацию возбуждающего постсинаптического потенциала (ВПСП)
ВПСП возникает в нейронах при действии в синапсах ацетил холина, норадреналина, дофамина, серотонина, глутаминовой кислоты, вещества Р.
В зависимости от природы медиатора потенциал покоя мембраны может снижаться (деполяризация), что характерно для возбуждения, или повышаться (гиперполяризация), что типично для торможения. Величина ВПСП зависит от количества выделившегося медиатора и может составлять 0,12—5,0 мВ. Под влиянием ВПСП деполяризуются соседние с синапсом участки мембраны, затем деполяризация достигает аксонного холмика нейрона, где возникает возбуждение, распространяющееся на аксон.
В отличие от возбуждения, которая распространяется (ПД), ВПСП является местным. Оно локальное, градуально (зависит от силы раздражения, то есть не подчиняется закону «все или ничего»), способное к суммации предварительной деполяризацией, не оставляет после себя рефрактерности. По своим характеристикам ВПСП идентичен потенциала концевой пластинки (ПКП) в нервно-мышечном соединении. Однако, если ПКП является следствием активации одного синапса, то ВПСП преимущественно возникает при одновременной активации нескольких синапсов.
ВПСП достигает максимума в течение 1,5-2 мс, после чего медленно затухает по экспоненте. Длительность ВПСП многих нейронов ЦНС составляет около 15 мс, а амплитуда может достигать-20-ЗО мВ при величине мембранного потенциала -70 мВ.
ВПСП приближает потенциал клетки к пороговому значению и облегчает возникновение потенциала действия, тогда как ТПСП, напротив, затрудняет возникновение потенциала действия.
Возбуждающий постсинаптический потенциал
В синапсах, в которых осуществляется возбуждение постсинаптической структуры, обычно происходит повышение проницаемости для ионов натрия. По градиенту концентрации Na+ входят в клетку, что вызывает деполяризацию постсинаптической мембраны. Эта деполяризация получила название: возбуждающий постсинаптический потенциал – ВПСП. ВПСП относится к локальным ответам и, следовательно, обладает способностью к суммации. Выделяют временную ипространственную суммацию.
Принцип временной суммации заключается в том, что импульсы поступают к пресинаптическому окончанию с периодом меньшим, чем период ВПСП. Как следствие, новые порции медиатора выделяются в тот момент, когда трансмембранный потенциал еще не вернулся к уровню мембранного потенциала покоя (МПП). Далее новая деполяризация развивается не с уровня МПП, а с текущего уровня трансмембранного потенциала, который ближе к критическому уровню деполяризации (КУД).
Сущность пространственной суммации заключается в одновременной стимуляции постсинаптической мембраны синапсами, расположенными близко друг от друга. В этом случае ВПСП каждого синапса суммируются.
2. Идентификация медиаторов
Выделяют ряд критериев для идентификации медиаторов:
1. Высвобождение из пресинаптических нервных терминалей вещества в достаточных количествах и избирательность локализации медиатора в нервных окончаниях.
2. Присутствие в нервных терминалях ферментов, участвующих в синтезе и распаде медиаторов.
3. Са++-зависимое выделение медиатора при стимуляции нервных окончаний в объеме, соответствующем количеству стимулов.
4. Идентичность действия медиатора и естественного передатчика на рецепторы постсинаптической мембраны.
5. Возможность с помощью фармакологических агентов блокировать эффекты предполагаемого медиатора.
6. Наличие системы обратного захвата медиатора в пресинаптиче-ские терминали и некоторые другие
Вар 2.
1. ТПСП
Ионные механизмы ТПСП
Механизмы генерации ТПСП. В пресинаптическом окончании тормозного синапса, активированного пришедшими сюда ПД, происходит выделение тормозного медиатора. Этот медиатор, проникнув в синаптическую щель, взаимодействует с хеморецепторными участками постсинаптической мембраны и увеличивает ее проницаемость преимущественно для ионов Сl- и К+. Возникающий при этом электрический ток в области синапса направлен наружу, а в прилежащих к синапсу участках мембраны внутрь нейрона. Это приводит к гиперполяризации постсинаптической мембраны и возникновению ТПСП.
медиаторы тормозных синапсов
В синапсах разных нервных структур роль тормозного медиатора могут выполнять различные вещества. В ганглиях моллюсков роль тормозного медиатора выполняет ацетилхолин, в ЦНС высших животных — гамма-аминомасляная кислота, глицин.
3. Принцип Дейла
В течение длительного времени считалось, что из окончаний каждой нервной клетки всегда высвобождается только один медиатор (принцип Дейла). Однако в вегетативной нервной системе, по крайней мере у эмбрионов, одни и те же нейроны высвобождают как ацетилхолин, так и адреналин. В двигательной концевой пластинке вместе с ацетилхолином выделяется аденозинтрифосфат, который, вероятно, также служит медиатором. Часто из синаптического окончания высвобождаются одновременно классический медиатор, например норадреналин, и участвующий в нервной передаче пептид. Особенности такого совместного действия медиаторов (сомедиаторов) пока неясны, но его эффект, вероятно, чаще всего сводится к определенному типу модуляции.
Относительная селективность ионных возбудимых мембран.
Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость.
Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия m-ворот происходит закрытие п-ворот, расположенных у выхода натриевых каналов (инактивация) (рис. 2.4). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула.
Работа натриевых каналов определяется величиной мембранного потенциала в соответствии с определенными законами вероятности. Рассчитано, что активированный натриевый канал пропускает всего 6000 ионов за 1 мс. При этом весьма существенный натриевый ток, который проходит через мембраны во время возбуждения, представляет собой сумму тысяч одиночных токов.
При генерации одиночного потенциала действия в толстом нервном волокне изменение концентрации ионов Na+ во внутренней среде составляет всего 1/100000 от внутреннего содержания ионов Na гигантского аксона кальмара. Однако для тонких нервных волокон это изменение концентрации может быть весьма существенным.
Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов (см. табл. 2.1).
Ходжкин и Хаксли сформулировали принцип «независимости» каналов, согласно которому потоки натрия и калия через мембрану независимы друг от друга.
Свойство проводимости различных каналов неодинаково. В частности, для калиевых каналов процесс инактивации, как для натриевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя.
Особый интерес представляют кальциевые каналы.
Входящий кальциевый ток, как правило, недостаточно велик, чтобы нормально деполяризовать клеточную мембрану. Чаще всего поступающий в клетку кальций выступает в роли «мессенджера», или вторичного посредника. Активация кальциевых каналов обеспечивается деполяризацией клеточной мембраны, например входящим натриевым током.
Процесс инактивации кальциевых каналов достаточно сложен. С одной стороны, повышение внутриклеточной концентрации свободного кальция приводит к инактивации кальциевых каналов. С другой стороны, белки цитоплазмы клеток связывают кальций, что позволяет поддерживать длительное время стабильную величину кальциевого тока, хотя и на низком уровне; при этом натриевый ток полностью подавляется. Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.
Потенциал покоя
Схема опыта Ходжкина—Хаксли приведена на рис. 2.7. В аксон кальмара диаметром около 1 мм, помещенный в морскую воду, вводили активный электрод, второй электрод (электрод сравнения) находился в морской воде. В момент введения электрода внутрь аксона регистрировали скачок отрицательного потенциала, т. е. внутренняя среда аксона была заряжена отрицательно относительно внешней среды.
Как указывалось в разделе 2.1.2, электрический потенциал содержимого живых клеток принято измерять относительно потенциала внешней среды, который обычно принимают равным нулю. Поэтому считают синонимами такие понятия, как трансмембранная разность потенциалов в покое, потенциал покоя, мембранный потенциал. Обычно величина потенциала покоя колеблется от -70 до -95 мВ. Согласно концепции Ходжкина и Хаксли, величина потенциала покоя зависит от ряда факторов, в частности от селективной (избирательной) проницаемости клеточной мембраны для различных ионов; различной концентрации ионов цитоплазмы клетки и ионов окружающей среды (ионной асимметрии); работы механизмов активного транспорта ионов. Все эти факторы тесно связаны между собой и их разделение имеет определенную условность.
Известно, что в невозбужденном состоянии клеточная мембрана высокопроницаема для ионов калия и малопроницаема для ионов натрия. Это было показано в опытах с использованием изотопов натрия и калия: спустя некоторое время после введения внутрь аксона радиоактивного калия его обнаруживали во внешней среде. Таким образом, происходит пассивный (по градиенту концентраций) выход ионов калия из аксона. Добавление радиоактивного натрия во внешнюю среду приводило к незначительному повышению его концентрации внутри аксона. Пассивный вход натрия внутрь аксона несколько уменьшает величину потенциала покоя.
3.Равновесное состояние для ионов К+
Установлено, что имеется разность концентраций ионов калия вне и внутри клетки, причем внутри клетки ионов калия примерно в 20—50 раз больше, чем вне клетки
Разность концентраций ионов калия вне и внутри клетки и высокая проницаемость клеточной мембраны для ионов калия обеспечивают диффузионный ток этих ионов из клетки наружу и накопление избытка положительных ионов К+ на наружной стороне клеточной мембраны, что противодействует дальнейшему выходу ионов К+ из клетки. Диффузионный ток ионов калия существует до тех пор, пока стремление их двигаться по концентрационному градиенту не уравновесится разностью потенциалов на мембране. Эта разность потенциалов называется калиевым равновесным потенциалом.
Равновесный потенциал (для соответствующего иона, Ек) — разность потенциалов между внутренней средой клетки и внеклеточной жидкостью, при которой вход и выход иона уравновешен (химическая разность потенциалов равна электрической).
Важно подчеркнуть следующие два момента: 1) состояние равновесия наступает в результате диффузии лишь очень небольшого количества ионов (по сравнению с их общим содержанием); калиевый равновесный потенциал всегда больше (по абсолютному значению) реального потенциала покоя, поскольку мембрана в покое не является идеальным изолятором, в частности имеется небольшая утечка ионов Na+. Сопоставление теоретических расчетов с использованием уравнений постоянного поля Д. Голдмана, формулы Нернста показали хорошее совпадение с экспериментальными данными при изменении вне- и внутриклеточной концентрации К+ (рис. 2.8).
4.Трансмембранная диффузионная разность потенциалов рассчитывается по формуле Нернста:
Ek=(RT/ZF)ln(Ko/Ki)
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, Z — валентность нона, F — постоянная Фарадея, Ко и Ki — концентрации ионов К+ вне и внутри клетки соответственно.
Величина мембранного потенциала для значений концентрации ионов К+, приведенных в табл. 2.2, при температуре +20 °С составит примерно —60 мВ. Поскольку концентрация ионов К+ вне клетки меньше, чем внутри, Ек будет отрицательным.
В состоянии покоя клеточная мембрана высокопроницаема не только для ионов К+. У мышечных волокон мембрана высокопроницаема для ионов СГ. В клетках с высокой проницаемостью для ионов Сl-, как правило, оба иона (Сl- и К+) практически в одинаковой степени участвуют в создании потенциала покоя.
Известно, что в любой точке электролита количество анионов всегда соответствует количеству катионов (принцип электронейтральности), поэтому внутренняя среда клетки в любой точке электронейтральна. Действительно, в опытах Ходжкина, Хаксли и Катца перемещение электрода внутри аксона не выявило различие в трансмембранной разности потенциалов.
Поскольку мембраны живых клеток в той или иной степени проницаемы для всех ионов, совершенно очевидно, что без специальных механизмов невозможно поддерживать постоянную разность концентрации ионов (ионную асимметрию). В клеточных мембранах существуют специальные системы активного транспорта, работающие с затратой энергии и перемещающие ионы против градиента концентраций. Экспериментальным доказательством существования механизмов активного транспорта служат результаты опытов, в которых активность АТФазы подавляли различными способами, например сердечным гликозидом оуабаином. При этом происходило выравнивание концентраций ионов К+ вне и внутри клетки и мембранный потенциал уменьшался до нуля.
5. К- Na-насос
Важнейшим механизмом, поддерживающим низкую внутриклеточную концентрацию ионов Na+ и высокую концентрацию ионов К+, является натрий-калиевый насос (рис. 2.9). Известно, что в клеточной мембране имеется система переносчиков, каждый из которых связывается с 3 находящимися внутри клетки ионами Na+ и выводит их наружу. С наружной стороны переносчик связывается с 2 находящимися вне клетки ионами К+, которые переносятся в цитоплазму. Энергообеспечение работы систем переносчиков обеспечивается АТФ. Функционирование насоса по такой схеме приводит к следующим результатам.
1. Поддерживается высокая концентрация ионов К+ внутри клетки, что обеспечивает постоянство величины потенциала покоя. Вследствие того что за один цикл обмена ионов из клетки выводится на один положительный ион больше, чем вводится, активный транспорт играет роль в создании потенциала покоя. В этом случае говорят об электрогенном насосе. Однако величина вклада электрогенного насоса в общее значение потенциала покоя обычно невелика и составляет несколько милливольт.
2. Поддерживается низкая концентрация ионов натрия внутри клетки, что, с одной стороны, обеспечивает работу механизма генерации потенциала действия, с другой — обеспечивает сохранение нормальных осмолярности и объема клетки.
3. Поддерживая стабильный концентрационный градиент Na+, натрий-калиевый насос способствует сопряженному транспорту аминокислот и сахаров через клеточную мембрану.
Таким образом, возникновение трансмембранной разности потенциалов (потенциала покоя) обусловлено высокой проводимостью клеточной мембраны в состоянии покоя для ионов К+ (для мышечных клеток и ионов Сl-), ионной асимметрией концентраций для ионов К+ (для мышечных клеток и для ионов Cl-), работой систем активного транспорта, которые создают и поддерживают ионную асимметрию.
Дата: 2019-12-10, просмотров: 933.