ЛАБОРАТОРИИ
1. Работы в химической лаборатории проводят в халате.
2. Запрещается в химической лаборатории находиться в верхней одежде (пальто, куртки), а также раздеваться в лабораториях и вешать верхнюю одежду и головные уборы на лабораторную мебель и оборудование.
3. Прежде чем приступить к работе, внимательно ознакомьтесь с заданием, с правилами безопасности работ, оборудованием, материалами и инструментом.
4. Со всеми веществами в химической лаборатории необходимо обращаться как с более или менее ядовитыми, так как большая часть применяемых в лаборатории веществ ядовиты.
5. Растворы следует отмерять мерными цилиндрами, а сыпучие реактивы следует брать шпателем или ложечкой, следя за тем, чтобы реактивы и их растворы не попали на руки. Нельзя брать реактивы руками, категорически запрещается пробовать реактивы на язык.
6. При нагревании раствора необходимо находиться возле нагревательного прибора.
7. При попадании кислоты на кожу поражённое место промывают сначала большим количеством воды, а затем 10 %-ным раствором соды (карбонат натрия – Nа2СО3).
8. В случае попадания на кожу едкого вещества (КОН, NаОН) необходимо нейтрализовать его действие 3 %-ным раствором уксусной кислоты (СН3СООН), а при попадании в глаза – обильное промывание 2 %-ным раствором борной кислоты (Н3ВО3).
9. В случае пореза (при работе со стеклянной химический посудой) края раны следует обработать спиртовым раствором иода и наложить повязку.
10. Запрещается пить воду и принимать пищу в химической лаборатории.
11. По окончании работы приведите в порядок своё рабочее место. После уборки заявите руководителю об окончании работы и только после этого можете оставить лабораторию.
12. После работы следует тщательно вымыть руки с мылом.
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ
ОТЧЁТА ПО ЛАБОРАТОРНОЙ РАБОТЕ
По окончании опыта экспериментальные данные и все наблюдения следует записать в лабораторный журнал (специальную тетрадь).
Лабораторную работу следует оформлять с новой страницы по следующему плану.
1. Название лабораторной работы и опыта.
2. Цель работы.
3. Реактивы и оборудование.
4. Содержание работы [уравнения химических реакций, краткое их описание, условия опыта, наблюдаемые явления (выпадение или растворение осадка, изменение цвета, выделение или поглощение теплоты, выделение газа), полученные данные и результаты].
5. Выводы (после каждого опыта и лабораторной работы в целом).
Записи в лабораторном журнале должны быть аккуратными, с достаточно широкими интервалами между строками и полями, и содержать ответы на вопросы, сформулированные в методическом руководстве лабораторной работы, таблицы и рисунки.
Расчёты следует приводить полностью, не опуская промежуточных вычислений.
Указания по оформлению лабораторной работы, приводимые в руководстве, необходимо выполнить все без исключения.
ПРИМЕРЫ РЕШЕНИЙ ЗАДАЧ
ПО ТЕМЕ "ЖЁСТКОСТЬ ВОДЫ"
Задача 1.
Рассчитайте общую жёсткость воды, если в её 0,25 л содержится 16,20 мг Са(НСО3)2, 2,92 мг Мg(НСО3)2, 11,10 мг СаСl2 и 9,50 мг МgСl2.
Решение.
Дано:
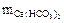 = 16,20 мг;
= 16,20 мг; 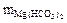 = 2,92 мг;
= 2,92 мг;
 = 11,10 мг;
= 11,10 мг;  = 9,50 мг; Vводы = 0,25 л.
= 9,50 мг; Vводы = 0,25 л.
Найти:
ЖО. – ?
Формула для расчёта общей жёсткости воды:
ЖО =  , (1)
, (1)
где Мэкв(В) – эквивалентная масса вещества В.
Эквивалентные массы растворённых солей вычислим по формуле:
 =
=  , (2)
, (2)
где Мэкв – молярная масса вещества, г/моль;
N – число катионов в формульной единице соли;
Z – модуль1 заряда катиона в соли.
 =
=  = 81,05
= 81,05  =
=  = 73,17
= 73,17
 =
= 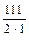 = 55,5
= 55,5 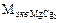 =
=  = 47,6
= 47,6
Определим общую жёсткость воды по формуле (1):
ЖО =  = 2,56 (ммоль/л).
= 2,56 (ммоль/л).
По значению жёсткости исследуемая вода является мягкой.
Задача 2.
Для устранения общей жёсткости к 50 л воды добавлено 7,4 г Са(ОН)2 и 5,3 г Nа2СО3. Рассчитайте временную, постоянную и общую жёсткость воды.
Решение.
Дано:
 = 50 л;
= 50 л;  = 7,4 г;
= 7,4 г;  = 5,3 г.
= 5,3 г.
Найти:
ЖК., ЖНК., ЖО – ?
При добавлении к воде гашёной извести Са(ОН)2 можно устранить временную жёсткость, а при добавлении кальцинированной соды Nа2СО3 – и временную, и постоянную.
М(НСО3)2 + Са(ОН)2 = МСО3↓ + СаСО3↓ + 2Н2О
М(НСО3)2 + Nа2СО3 = МСО3↓ + 2NаНСО3
МСl2 + Nа2СО3 = МСО3↓ + 2NаСl
(М – катион жёсткости)
Постоянную (некарбонатную) жёстокость воды находим по количеству добавленной к раствору соды по формуле:
ЖНК =  , (3)
, (3)
а временную (карбонатную) жёсткость воды – по количеству добавленной извести:
ЖК =  (4)
(4)
Эквивалентную массу соды вычислим по формуле (2):
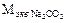 =
=  = 53 (г/моль).
= 53 (г/моль).
Эквивалентную массу извести (основания) определим по формуле:
 =
=  ; (5)
; (5)
где N – кислотность основания – число ионов ОН в формульной единице основания, которые замещаются на кислотные остатки.
 =
=  = 37,05 (г/моль).
= 37,05 (г/моль).
Определим жёсткость воды:
ЖК =  = 0,004 (моль/л) или 4 (ммоль/л);
= 0,004 (моль/л) или 4 (ммоль/л);
ЖНК =  = 0,002 (моль/л) или 2 (ммоль/л);
= 0,002 (моль/л) или 2 (ммоль/л);
ЖО = 4 + 2 = 6 (ммоль/л).
По значению жёсткости исследуемая вода является средней жёсткости.
Задача 3.
Определите жёсткость воды для устранения которой в 0,1 м3 воды требуется 21,2 г карбоната натрия.
Решение.
Дано:
 = 0,1 м3 = 100 л;
= 0,1 м3 = 100 л;  = 21,2 г.
= 21,2 г.
Найти:
Ж – ?
При добавлении карбоната натрия (кальцинированной соды) можно устранить как временную, так и постоянную жёсткость воды.
По формуле (2) вычислим эквивалентную массу карбоната натрия:
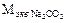 =
=  = 53 (г/моль).
= 53 (г/моль).
По формуле (3) определим жёсткость воды:
ЖО =  = 0,004 (моль/л) или 4 (ммоль/л).
= 0,004 (моль/л) или 4 (ммоль/л).
По значению жёсткости исследуемая вода является средней жёсткости.
Задача 4.
Общая жёсткость воды равна 6,52 ммоль/л, а временная – 3,32 ммоль/л. Какую массу Nа2СО3 и Са(ОН)2 надо взять для устранения жёсткости 5 л воды ?
Решение.
Дано:
ЖК = 3,32 ммоль/л; ЖО = 6,52 ммоль/л;  = 5 л.
= 5 л.
Найти:
 и
и  – ?
– ?
Определим некарбонатную (постоянную) жёсткость:
ЖНК = ЖО – ЖК (6)
ЖНК = 6,52 – 3,32 = 3,2 (ммоль/л)
Воспользуясь формулами (3) и (4), запишем выражения для определения масс гашёной извести и кальцинированной соды, которые необходимо последовательно добавить в воду для устранения её временной и постоянной жёсткости.
 = ЖК ·
= ЖК ·  · V;
· V;
 = ЖНК ·
= ЖНК · 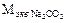 · V.
· V.
По формулам (2) и (5) вычислим эквивалентные массы извести и соды:
 =
=  = 37,05 (г/моль);
= 37,05 (г/моль);
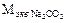 =
=  = 53 (г/моль),
= 53 (г/моль),
следовательно:
 = 3,32 · 37,05 · 5 = 615,03 (мг) или 0,615 (г).
= 3,32 · 37,05 · 5 = 615,03 (мг) или 0,615 (г).
 = 3,2 · 53 · 5 = 848 (мг) или 0,848 (г).
= 3,2 · 53 · 5 = 848 (мг) или 0,848 (г).
Задача 5.
Сколько по массе гидроксида кальция (гашёная известь) следует добавить в 2,5 л воды, чтобы устранить её временную жёсткость, равную 4,43 ммоль/л ?
Решение.
Дано:
 = 2,5 л; ЖК = 4,43 ммоль/л.
= 2,5 л; ЖК = 4,43 ммоль/л.
Найти:
 – ?
– ?
Воспользуясь формулой (4) запишем выражение для определения массы гашёной извести, необходимой для устранения временной жёсткости воды.
 = ЖК ·
= ЖК ·  · V.
· V.
Эквивалентную массу извести вычислим по формуле (5):
 =
=  = 37,05 (г/моль),
= 37,05 (г/моль),
следовательно,
m = 4,43 · 2,5 · 37,05 = 410,32 (мг) или 0,41 (г).
Задача 6.
В 10 л воды с общей жёсткостью 6,05 ммоль/л для устранения жёсткости добавлено 1,5 г гашёной извести. Чему равна постоянная жёсткость воды ?
Решение.
Дано:
 = 10 л; ЖО = 6,05 ммоль/л.
= 10 л; ЖО = 6,05 ммоль/л.
Найти:
ЖНК – ?
При добавлении к воде Са(ОН)2 произойдёт устранение карбонатной (временной) жёсткости.
По формулам (2) и (4) определим эквивалентную массу извести и карбонатную жёсткость воды.
 =
=  = 37,05 (г/моль);
= 37,05 (г/моль);
ЖК =  = 0,00405 (моль/л) или 4,05 (ммоль/л)
= 0,00405 (моль/л) или 4,05 (ммоль/л)
Постоянную (некарбонатную) жёсткость воды вычислим по формуле (6):
ЖНК = 6,05 – 4,05 = 2,0 (моль/л)
Задача 7.
Вода обладает некарбонатной жёсткостью: содержит сульфат кальция (массовая доля 0,02 %) и хлорид магния (массовая доля 0,01 %). Какой объём раствора карбоната натрия с массовой долей 15 % (ρ = 1,16 г/мл) надо добавить к 100 л воды для устранения постоянной жесткости ?
Решение.
Дано:
 = 0,02 %;
= 0,02 %;  = 0,01 %;
= 0,01 %;
 = 15 % = 0,15;
= 15 % = 0,15;  = 1,16 г/мл; VВ = 100 л.
= 1,16 г/мл; VВ = 100 л.
Найти:
ЖНК, 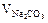 – ?
– ?
Жёсткость воды показывает, какое количество вещества эквивалента солей кальция и магния (в ммоль/л) содержится в 1 л воды. Поэтому сначала определим массу солей кальция и магния, содержащихся в 1 л (ρ = 1 г/мл) воды:
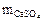 =
=  =
= 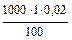 = 0,2 (г)
= 0,2 (г)
 =
=  =
=  = 0,1 (г)
= 0,1 (г)
По формуле (2) определим эквивалентные массы солей СаSО4 и МgСl2, а также Nа2СО3:
 =
=  = 68 (г/моль);
= 68 (г/моль);  =
= 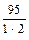 = 47,5 (г/моль);
= 47,5 (г/моль);
 =
=  = 53 (г/моль).
= 53 (г/моль).
Кальциевую и магниевую жёсткость воды находим следующим образом::
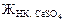 =
=  =
=  = 0,00294 (моль/л);
= 0,00294 (моль/л);
 =
=  =
=  = 0,00210 (моль/л)
= 0,00210 (моль/л)
Отсюда находим суммарную некарбонатную жёсткость воды:
0,00294 + 0,00210 = 0,00504 моль/л или 5,04 ммоль/л
Применяя формулу (3), и выражая массу соды через объём, плотность и концентрацию её раствора:
 =
=  ·
·  ·
· 
определим, какой объём раствора соды необходим, чтобы устранить некарбонатную жёсткость.
ЖНК = 
 =
= 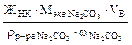 =
=  = 153,5 (мл).
= 153,5 (мл).
Задача 8.
Минеральная вода содержит 389,4 мг/л ионов кальция и 84,4 мг/л ионов магния. Какова общая жёсткость этой воды ?
Решение.
Дано:
 = 389,4 мг/л;
= 389,4 мг/л;  = 84,4 мг/л; V – 1 л.
= 84,4 мг/л; V – 1 л.
Найти:
ЖО – ?
Так как жёсткость воды выражают суммой ммоль эквивалентов ионов кальция и магния, то 1 ммоль эквивалентов ионов жёсткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Мg2+.
Общую жёсткость воды вычислим по формуле (1):
ЖО =  = 19,43 + 6,94 = 26,37 (ммоль/л)
= 19,43 + 6,94 = 26,37 (ммоль/л)
По значению жёсткости исследуемая вода является средней жёсткости.
Задача 9.
Сравните жёсткость природной воды озера Байкал и Каспийского моря, если содержание ионов кальция (в мг/л) в озере – 15,2, а в море – 36,0; а содержание ионов магния соответственно – 4,2 и 730,0.
Решение.
Дано:
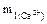 = 15,2 мг;
= 15,2 мг;  = 4,2 мг;
= 4,2 мг;
 = 36,0 мг;
= 36,0 мг;  = 730,0 мг.
= 730,0 мг.
Найти:
Ж1, Ж2 – ?
Вычислим общую жёсткость воды в озере Байкал и Каспийском море по формуле (1), учитывая, что в 1 ммоль эквивалентов ионов жёсткости содержится 20,04 мг/л Са2+ или 12,16 мг/л Мg2+. Если учесть, что концентрация дана в мг/л, то объём воды можно взять равным 1 л и получим:
Ж1 =  = 1,1 (ммоль/л)
= 1,1 (ммоль/л)
Ж2 = 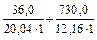 = 61,83 (ммоль/л)
= 61,83 (ммоль/л)
По значениям жёсткости вода Каспийского моря очень жёсткая, а вода озера Байкал очень мягкая.
Задача 10.
При определении временной (карбонатной) жёсткости воды на титрование 100 мл воды израсходовано 5,25 мл раствора хлороводородной (соляной) кислоты с молярной концентрацией эквивалента 0,101 моль/л, а для определения постоянной (некарбонатной) жёсткости воды на титрование такого же объёма воды – 8,5 мл раствора трилона Б с молярной концентрацией эквивалента 0,05 моль/л. Чему равна общая жёсткость воды ?
Решение.
Дано:
Vр-ра НСl = 5,25 мл;  = 0,101 моль/л; VВ = 100 мл.
= 0,101 моль/л; VВ = 100 мл.
Vтр.Б = 8,5 мл;  = 0,05 моль/л; VВ = 100 мл.
= 0,05 моль/л; VВ = 100 мл.
Найти:
ЖО – ?
При титровании воды соляной кислотой протекает реакция:
М(НСО3)2 + 2НС1 = МС12 + 2СО2↑ + 2Н2О
В соответствии с законом эквивалентов число моль эквивалентов соляной кислоты, пошедшей на титрование, равно количеству моль эквивалентов солей, обуславливающих временную жёсткость воды:
ЖК =  · 103 =
· 103 = 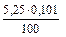 · 103 = 5,30 (ммоль/л)
· 103 = 5,30 (ммоль/л)
При взаимодействии трилона Б с солями кальция и магния выполняется закон эквивалентов, следовательно общая жёсткость воды будет равна:
ЖНК =  · 103 =
· 103 =  · 103 = 4,25 (ммоль/л)
· 103 = 4,25 (ммоль/л)
Общая жёсткость воды равна сумме карбонатной и некарбонатной жесткостей:
ЖО = ЖК + ЖНК = 5,30 + 4,25 = 9,55 (моль/л)
Исследуемая вода является жёсткой.
ЗАДАЧИ
- Чему равна жёсткость воды – раствора хлорида кальция с молярной концентрацией эквивалента 0,05 моль/л ?
- В 100 л воды содержится 2 г сульфата кальция, 1,5 г сульфата магния и 4,6 г гидрокарбоната магния. Какова общая, временная и постоянная жёсткость воды ?
- При определении общей жёсткости воды на титрование 100 мл воды израсходовано 9,5 мл раствора трилона Б с молярной концентрацией эквивалента 0,05 моль/л. Какова общая жёсткость воды ?
- Жёсткость воды равна 4,5 ммоль/л. Какую массу гашёной извести необходимо добавить к 2 м3 такой воды, чтобы устранить её временную жёсткость ?
- К 3 м3 воды для устранения её жёсткости добавили 468 г карбоната натрия. Какова жёсткость данной воды ?
- Жёсткость воды равна 5,4 ммоль/л. Какую массу ортофосфата натрия необходимо добавить к 1 м3 воды, чтобы устранить её жёсткость ?
- Временная жёсткость воды, обусловленная ионами кальция, равна 3,0 ммоль/л. Какая масса гидрокарбоната кальция содержится в 10 л этой воды ?
- Для определения временной жёсткости воды к 100 мл её было прилито 12 мл раствора соляной кислоты с молярной концентрацией 0,01 моль/л до нейтрализации. Чему равна временная жёсткость воды ?
- Какую массу гашёной извести надо прибавить к 2 м3 воды, чтобы устранить её временную жёсткость, равную 5,2 ммоль/л ?
10. Для устранения временной жёсткости в 200 л воды было добавлено 8 г гидроксида натрия. Чему равна временная жёсткость воды ?
11. Для устранения временной и постоянной жёсткости в 2 м3 воды добавлено 2 кг золы, содержащей 20 % поташа (К2СО3). Чему равна жёсткость воды ?
12. Общая жёсткость воды равна 4,72 ммоль/л, а временная – 1,15 ммоль/л. Какую массу Са(ОН)2 и Nа2СО3 надо добавить, чтобы устранить жёсткость 3,5 л воды ?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каково назначение технических жидкостей ?
2. Основные требования, предъявляемые к техническим жидкостям (вязкость, теплоёмкость, температуры кипения и кристаллизации (замерзания), накипе- и шламообразование, агрессивность (коррозионные свойства), коэффициент объёмного расширения, стоимость, доступность, вспениваемость, пожаробезопасность, безвредность (экологические свойства).
3. Каков химический состав воды ?
4. Какова структура жидкой и твёрдой воды ?
5. Температура плавления и температура кипения воды, её зависимость от давления.
6. Пресная вода, её количество и нахождение на планете (льды, вечные снега и мерзлота, озёра, реки, грунтовые воды).
7. Состав природных вод: катионы и анионы, газы, органические вещества, взвеси, эмульсии.
8. Применение воды в быту, сельском хозяйстве и промышленности.
9. Качественное и количественное (визуально-органолептическое) определение прозрачности (мутности) воды и обнаружение нефтепродуктов в воде.
10. Определение значений рН – водородного показателя (кислотности) среды.
11. Определение содержания взвешенных частиц в воде.
12. Понятия об индикаторах (метилоранж, лакмус, фенолфталеин, универсальный индикатор), свидетелях, комплексонах (трилон Б), внутрикомплексных (хелатных) соединениях, буферных смесях.
13. Что называют жёсткостью воды ?
Почему жёсткость воды следует устранять ?
14. За счёт чего в природе образуется жёсткая вода ?
15. Какие виды жёсткости воды различают ?
Чем обуславливается временная и постоянная жёсткость воды ?
16. Перечислите методы устранения жёсткости воды.
17. Какой метод умягчения воды называют термическим ?
Какие химические реакции протекают при умягчении воды этим методом ?
18. В чём сущность химических (реагентных) методов умягчения воды ?
Какие реагенты при этом используются и какие реакции при этом протекают ?
19. Охарактеризуйте ионно-обменный метод умягчения воды ?
20. Перечислите основные физические методы снижения жёсткости воды.
21. Какие преимущества имеют физические методы уменьшения жёсткости воды по сравнению с другими методами ?
Приложение
Дата: 2016-10-02, просмотров: 297.