Значение водородного показателя – рН или реакцию воды определяют с помощью универсальной индикаторной бумаги, а также инструментально–электролитическом методом.
Применение индикаторной бумаги позволяет приблизительно определить значение водородного показателя, в отличие от электролитического метода, погрешность которого составляет лишь сотые доли.
Метод А. Определение реакции воды при помощи
Универсальной индикаторной бумаги
Универсальные индикаторы (в виде растворов или бумажки, пропитанной соответствующими веществами) очень удобны для приближённого определения рН (с погрешностью ± 1), но неприменимы для точного определения, так как при слабом изменении рН окраски меняются очень мало.
Порядок выполнение работы
Полоску универсальной индикаторной бумаги смачивают исследуемой водой. Сравнивая цвет полоски с наиболее близкой окраской прилагаемой к набору индикаторной бумаги шкалы, определяют значение рН.
Цвет полоски может не соответствовать в точности цветам, показанным на шкале, а представлять собой промежуточную, переходную окраску. В таком случае значение рН определяют с погрешностью до 0,5.
Метод Б. Инструментально–электролитический метод определения водородного показателя
Определение рН раствора с использованием стеклянного электрода
Для измерения рН используют гальванический элемент, составленный из стеклянного индикаторного электрода и хлорсеребряного электрода сравнения.
Перед началом измерения значений рН новый стеклянный электрод должен быть выдержан не менее суток в 0,1 М растворе НСl или в дистиллированной воде.
Проверку электродов и настройку прибора (рН-метра) проводят по буферным растворам1. Если используется один буферный раствор, желательно выбрать тот, значения рН которого находятся в том же диапазоне, что и значение рН исследуемого раствора. Для большей надёжности проверяют показания прибора и по другим буферным растворам. Погрешность измерения не должна превышать значения 0,05 рН.
Реактивы и оборудование
Буферные растворы: рН 3,56 (насыщенный раствор КС4Н5О62) и рН 9,18 [0,05 М раствор кристаллогидрата тетрабората натрия Na2B4О7 · 10H2O (бура)]. рН-метр. Стеклянный индикаторный электрод, хлорсеребряный электрод сравнения.
Порядок выполнение работы
Подключают прибор к электросети и дают прогреться в течение 30 мин. Настраивают прибор по двум буферным растворам – в кислой и щелочной областях значения рН. Для этого наливают в стакан соответствующий буферный раствор, опускают в него электроды, фиксируют значение рН и, если необходимо, корректируют его с помощью специальной настройки.
Перед каждым погружением в буферный или исследуемый раствор электроды тщательно промывают дистиллированной водой и осторожно удаляют избыток воды с их поверхности фильтровальной бумагой.
Измеряют величину рН в анализируемом растворе.
По окончании работы выключают прибор.
Электроды промывают дистиллированной водой и погружают в воду для хранения.
Опыт 5. Определение общей щёлочности воды
Общая щёлочность воды обусловлена суммой содержащихся в воде ионов НСО3–, СО32–, ОН– и других анионов солей слабых кислот, вступающих в реакцию с сильными кислотами.
Щёлочность воды, обусловленная присутствием сильных оснований, называется гидратной.
Щёлочность воды, обусловленная присутствием ионов НСО3– и СО32–, называется карбонатной.
Характер щёлочности воды имеет большое значение, в особенности этот показатель важен для циркуляционной воды обратных систем, котловой и питательной воды парогенераторов и т. д.
Щёлочность воды выражают в мг/л. Если в воде отсутствуют карбанат-ионы СО32–, то щёлочность практически соответствует концентрации гидрокарбонат-ионов НСО3–.
Определение общей щёлочности воды основано на реакции нейтрализации, происходящей при титровании исследуемой воды хлороводородной (соляной) кислотой.
В присутствии индикатора фенолфталеина1 оттитровывают гидроксид- и карбонат-ионы:
ОН– + Н+ = Н2О СО32– + Н+ = НСО3–
Ионы НСО3– оттитровывают соляной кислотой в присутствии индикатора метилового оранжевого (см. сноску в лаб. работе № 2):
НСО3– + Н+ = Н2СО3 = Н2О + СО2↑
Если щёлочность воды по фенолфталеину не обнаруживается, то она обусловлена наличием только ионов НСО3–, для которых в природных водах противоионами, в основном, являются ионы Са2+ и Мg2+ и, следовательно, щёлочность воды можно считать равной карбонатной жёсткости.
Реактивы и оборудование
Хлороводородная (соляная) кислота, 0,1 н. титрованный раствор; индикаторы: 0,1 % водные растворы фенолфталеина и метилового оранжевого; образец воды для исследования.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба (колба Эрленмейера) на 250 мл.
Порядок выполнения работы
К 50 мл исследуемой воды, отмеренной цилиндром в коническую колбу, добавляют 2 капли раствора индикатора фенолфталеина.
Если пурпурная окраска не появляется, то добавляют 2 капли раствора индикатора метилового оранжевого и проводят титрование соляной кислотой до перехода окраски из соломенно-жёлтой в оранжевую.
Если пурпурная окраска при добавлении фенолфталеина появилась, то титрование проводят раствором НСl до её исчезновения, а затем прикапывают раствор метилового оранжевого.
Суммарное количество кислоты, пошедшее на титрование, определяет общую щёлочность воды.
Для уменьшения погрешности титрование следует вести на фоне белой бумаги.
Общую щёлочность воды вычисляют по формуле:
Щ =  · 103,
· 103,
где V1 – объём раствора НСl, расходуемый на титрование пробы воды, мл;
VВ – объём воды, взятой для титрования, мл;
с – молярная концентрация эквивалента (нормальная концентрация) или молярная концентрация НСl, моль/л;
103 – коэффициент перевода моль/л в ммоль/л.
Примечание. Щёлочность свыше 1000 мг/л не даёт чёткой окраски раствора в эквивалентной точке.
Количественное содержание щелочей определяется путём их нейтрализации 0,1 н. раствором НСl в присутствии индикатора фенолфталеина с предварительным кипячением пробы воды в течение 3–5 мин.
Опыт 6. Определение общей кислотности сточных вод
Кислотностью называется содержание в воде веществ, вступающих в реакцию со щелочами (NаОН, КОН). К этим веществам относятся:
а) сильные кислоты (соляная НСl, азотная НNО3, серная Н2SО4 и др.);
б) слабые кислоты (уксусная СН3СООН, сероводородная Н2S, сернистая Н2SО3 и др.);
в) катионы слабых оснований (ионы аммония NН4+, железа Fе2+, алюминия Аl3+);
г) органические основания.
Реактивы и оборудование
Гидроксид натрия, 0,1 н. титрованный раствор; индикатор – 0,1 % водный раствор метилового оранжевого; образец воды для исследования.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба (колба Эрленмейера) на 250 мл.
Порядок выполнения работы
К 50 мл анализируемой воды прибавляют 1–2 капли раствора индикатора метилового оранжевого (см. сноску в лаб. работе № 2) и проводят титрование 0,1 н. раствором NаОН до перехода окраски раствора в устойчивый жёлтый цвет. Общую кислотность вычисляют по формуле:
К = 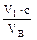 · 103,
· 103,
где V1 – объём раствора NаОН, расходуемый на титрование пробы воды, мл;
VВ – объём воды, взятой для титрования, мл;
с – молярная концентрация эквивалента (нормальная концентрация) или молярная концентрация НСl, моль/л;
103 – коэффициент перевода моль/л в ммоль/л.
Дата: 2016-10-02, просмотров: 366.