Временная жёсткость воды обуславливается карбонатами и гидрокарбонатами кальция и магния. При кипячении воды временная жёсткость понижается, так как гидрокарбонаты кальция и магния разлагаются с образованием карбоната кальция СаСО3 и гидроксокарбоната магния Мg(ОН)2СО3.
Значение, на которое снижается жёсткость воды при кипячении, определяет временную, или устранимую, жёсткость воды.
Карбонатную жёсткость воды(ЖК) определяют титрованием исследуемой воды раствором хлороводородной (соляной) кислоты. При этом растворённые в воде гидрокарбонаты количественно реагируют с соляной кислотой по уравнению:
М(НСО3)2 + 2НС1 = МС12 + 2СО2↑ + 2Н2О
Реактивы и оборудование
Хлороводородная (соляная) кислота, 0,1 н. титрованный раствор; индикатор – 0,1 % водный раствор метилового оранжевого1, образец воды для определения её жёсткости.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба (колба Эрленмейера) на 250 мл.
Порядок выполнение работы
Определение временной жёсткости воды осуществляют с применением установки для титрования (рис. 5):
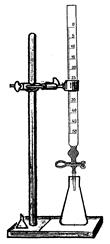 Рис. 5. Установка
для титрования
Рис. 5. Установка
для титрования
| С помощью воронки заполняют бюретку раствором НСl и приводят её в рабочее состояние ("носик" бюретки заполняют раствором и выводят нижний край мениска1 на нулевое деление).
В коническую колбу с помощью мерного цилиндра наливают 100 мл исследуемой (например, водопроводной) воды, прибавляют 1–2 капли раствора индикатора метилового оранжевого и проводят титрование 0,1 н. НСl при постоянном перемешивании до тех пор, пока раствор не приобретёт слабо-розовую окраску.
Метиловый оранжевый изменяет свою окраску от красной при рН < 3,1 до жёлтой при рН > 4,4. В точке перехода метиловый оранжевый имеет оранжевую окраску.
Анион НСО3– в воде гидролизуется:
НСО3– + Н2О  Н2СО3 + ОН– Н2СО3 + ОН–
|
Поэтому вода, содержащая гидрокарбонаты кальция и магния, имеет щелочную реакцию среды. Добавленный к воде метиловый оранжевый окрашивает её в жёлтый цвет. При титровании исследуемой воды раствором соляной кислоты протекает реакция нейтрализации:
ОН– + Н+ = Н2О
Количество ионов ОН– эквивалентно концентрации ионов НСО3–, следовательно, и концентрации гидрокарбонатов кальция и магния.
Титрование повторяют трижды.
Ошибка (погрешность) измерений объёма составляет ± 0,2 мл.
Рассчитывают средний объём раствора НСl по формуле:
Vср = 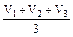 .
.
Карбонатную (временную) жёсткость воды ЖК (ммоль/л) рассчитывают на основании закона эквивалентов по формуле:
 · 103,
· 103,
где Vср – средний объём раствора НСl, расходуемый на титрование пробы воды, мл;
VВ – объём воды, взятой для титрования, мл;
с – молярная концентрация эквивалента (нормальная концентрация) или молярная концентрация НСl, моль/л;
103 – коэффициент перевода моль/л в ммоль/л.
Экспериментальные данные и результаты вычислений заносят в таблицу.
| Номер титрования | Объём исследуемой воды, мл | Объём раствора НСl, мл | Средний объём раствора НСl, мл | Молярная концентрация НСl, моль/л | Карбонатная жёсткость воды, ммоль/л |
| V1 | |||||
| V2 | |||||
| V3 |
ЛАБОРАТОРНАЯ РАБОТА № 3
Опыт 1.Определение общей жёсткости воды
Общую жёсткость воды (Жо) определяют комплексонометрическим методом.
Метод основан на способности динатриевой соли этилендиаминтетрауксусной кислоты [этилендиаминтетраацетат натрия (ЭДТА), комплексона III, или трилон Б] образовывать с ионами кальция и магния бесцветные внутрикомплексные (хелатные1) соединения, которые прочны и почти не диссоциируют в воде:

Определение общей жёсткости сводится к титрованию пробы воды раствором трилона Б в присутствии индикатора2 – эриохрома
чёрного Т1.
Водные растворы индикатора изменяют окраску в зависимости от их кислотности. При рН < 6,3 раствор окрашивается в красный цвет (форма Н2Ind–), при рН 6,3–11,6 – в синий (форма НInd2–), а при рН > 11,6 – в жёлтый (форма Ind3–). Наиболее контрастным и удобным для фиксации конечной точки титрования (КТТ) является переход синий  жёлтый, поэтому титрование ведут в аммиачном буфере при рН ≈ 9,5–10,0. В этих условиях индикатор образуют с ионами кальция и магния внутрикомплексные соединения красного цвета.
жёлтый, поэтому титрование ведут в аммиачном буфере при рН ≈ 9,5–10,0. В этих условиях индикатор образуют с ионами кальция и магния внутрикомплексные соединения красного цвета.
В точке эквивалентности при титровании индикатор изменяет розовую окраску (в присутствии ионов жёсткости: Са2+ и Mg2+) на синюю (в отсутствии этих ионов).
Са2+ + НInd2– = СаInd– + Н+;
Мg2+ + НInd2– = МgInd– + Н+;
синий красный
Дальнейшее определение осуществляют титрованием раствором трилона Б, который взаимодействуя с комплексными соединениями ионов кальция и магния с эриохромом чёрным Т, даёт более прочные хелаты:
СаInd– + Н2Т2– = СаТ2– + НInd2– + Н+;
МgInd– + Н2Т2– = MgT2– + НInd2– + Н+,
красный синий
где Н2Т2– – дианион ЭДТА (Т – обозначение остатка трилона Б).
По объёму раствора трилона Б, израсходованного на титрование, рассчитывают общую жёсткость воды, как суммарное содержание в ней ионов кальция и магния.
Реактивы и оборудование
Стандартный раствор ЭДТА (трилон Б), 0,05 н. титрованный раствор; аммиачный буферный раствор с рН 10; 0,01 н. раствор сульфата магния; хлорид аммония; индикатор – раствор эриохрома чёрного Т или его сухую смесь с хлоридом натрия (1 : 200); образец воды для исследования.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба (колба Эрленмейера) на 250 мл.
Раствор трилона Б с концентрацией 0,05 н. готовится растворением 9,307 г ЭДТА в 1 л дистиллированной воды. Установку и проверку титра раствора1 трилона Б проводят по 0,01 н. раствору МgSО4. Дистиллированной водой доводят 50 мл 0,01 н. раствора МgSО4 до 100 мл, добавляют 5 мл аммиачного буферного раствора и 5–7 капель индикатора эриохрома чёрного Т. Полученный раствор при перемешивании титруют раствором трилона Б до перехода красной окраски в синюю.
Аммиачный буферный раствор. В мерной колбе объёмом 1 л растворяют в 300 мл дистиллированной воды 20 г NН4Сl, добавляют 100 мл 25 %-ого раствора NН3 и доводят объём раствора дистиллированной водой до метки.
Индикатор. Эриохром чёрный Т в количестве 0,5 г растворяют в 20 мл аммиачного буферного раствора и доводят объём этиловым спиртом до 100 мл.
Продолжительность хранения раствора индикатора не более 10 суток.
Порядок выполнения работы
Результат титрования удовлетворителен, если во взятом объёме воды находится не более 0,5 ммоль/л ионов кальция и магния. Поэтому в зависимости от ожидаемой жёсткости необходимо брать для исследования указанные ниже объёмы воды.
| Жёсткость воды, ммоль/л | 0,5 – 5,0 | 5 – 10 | 10 – 50 |
| Объём воды, мл |
Для определения общей жёсткости воды собирают установку для титрования согласно рис. 5.
В коническую колбу наливают 50 мл исследуемой жёсткой (или водопроводной) воды и 5 мл аммиачного буферного раствора, поддерживающего рН ≈ 10. Затем добавляют 5–8 капель раствора индикатора или несколько кристалликов (на кончике шпателя) эриохрома чёрного и смесь перемешивают.
Полученный раствор винно-красного цвета при перемешивании медленно титруют 0,05 н. раствором трилона Б до появления красно-фиолетового окрашивания, после чего титрование проводят медленно, прибавляя раствор (титрант) по 1 капле до появления синего окрашивания (от прибавления избытка трилона Б окраска раствора не меняется).
Опыт повторяют трижды, измеряя объём раствора трилона Б, пошедший на титрование каждой порции воды.
Экспериментальные данные заносят в таблицу.
| Номер титрования | Объём исследуемой пробы воды, мл | Объём раствора трилона Б, мл | Средний объём раствора трилона Б, мл | Молярная концентрация эквивалента трилона Б, моль/л | Жёсткость воды, ммоль/л | |
| ЖО | ЖНК | |||||
| V1 | ||||||
| V2 | ||||||
| V3 |
Ошибка (погрешность) измерений объёма составляет ± 0,2 мл.
Рассчитывают среднее значение объёма раствора трилона Б по формуле:
Vср = 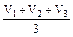 .
.
Во время титрования окраску исследуемого раствора можно сравнивать с синей окраской "свидетеля" – раствором, приготовленным смешением 50 мл дистиллированной воды, 5 мл аммиачного буферного раствора и 5–8 капель раствора индикатора.
Общую жёсткость воды ЖО (ммоль/л) рассчитывают на основании закона эквивалентов по формуле:
 · 103,
· 103,
где Vср – средний объём раствора трилона Б, расходуемый на титрование, мл;
VВ – объём воды, взятой для титрования, мл;
сэкв – молярная концентрация эквивалента (нормальная концентрация) трилона Б, моль/л.
103 – коэффициент перевода моль/л в ммоль/л.
После вычисления карбонатной и общей жёсткости воды определяют некарбонатную (постоянную) жёсткость воды (ЖНК), исходя из уравнения:
ЖО = ЖК + ЖНК.
Опыт 2.Определение содержания ионов кальция
Ионы кальция определяются комплексонометрическим1 методом в присутствии индикатора – мурексида2.
Цвет раствора индикатора зависит от кислотности среды:
| рН | Цвет |
| < 9 | красно-фиолетовый |
| 9,2–10,3 | фиолетовый |
| >10,3 | лиловый |
При наличии в воде ионов кальция мурексид изменяет окраску щелочного раствора с лилового на красную в результате образования комплексного соединения:
Са2+ + Ind– = СаInd+
лиловый красный
где Ind– – анион индикатора.
В дальнейшем при титровании этого комплекса трилоном Б (лаб. работа № 3, опыт 1) в эквивалентной точке раствор вновь окрашивается в лиловый цвет:
СаInd+ + Н2Т2– = СаТ2– + Ind– + 2Н+;
красный лиловый
Т2– – обозначение остатка трилона Б.
Изменение окраски происходит за счёт того, что трилон Б образует с ионами кальция более прочное внутрикомплексное соединение, чем мурексид, который выделяется в свободном виде. По количеству израсходованного на титрование раствора трилона Б рассчитывают содержание ионов кальция в анализируемой воде.
Реактивы и оборудование
Стандартный раствор ЭДТА (трилон Б), 0,05 н. титрованный раствор; 2 н. раствор гидроксида натрия; индикатор – раствор мурексида (0,03 г в 10 мл дистиллированной воды); образец воды для исследования.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба (колба Эрленмейера) на 250 мл.
Порядок выполнения работы
Погрешность при титровании не превышает 1 %, если для анализа берут следующие объёмы воды:
| Содержание ионов Са2+ в воде, мг/л | < 2,5 | 2,5–5,0 | 5–40 |
| Объём пробы воды, мл |
В зависимости от ожидаемого содержания ионов кальция в коническую колбу объёмом 250 мл с помощью мерного цилиндра наливают от 10 до 100 мл исследуемой воды. Объём доводят дистиллированной водой до 100 мл, прибавляют 5 мл 2 н. раствора NаОН и 4–5 капель раствора мурексида.
Раствор перемешивают и медленно титруют трилоном Б до перехода красной окраски в лиловую. Раствор слегка перетитровывают для применения в качестве "свидетеля".
Для определения содержания ионов кальция берут вторую пробу воды и повторяют все операции. Конец титрования определяют, сравнивая титруемую пробу по цвету со "свидетелем".
Содержание ионов кальция х (мг/л) рассчитывают по формуле:
х =  · 103,
· 103,
где V1 – объём раствора трилона Б, расходуемый на титрование пробы воды, мл;
VВ – объём воды, взятой для титрования, мл;
сэкв – молярная концентрация эквивалента (нормальная концентрация) трилона Б, моль/л.
103 – коэффициент перевода моль/л в ммоль/л.
Опыт 3.Определение содержания ионов магния
Содержание ионов магния определяют по разности найденных значений общей жёсткости воды (содержания ионов кальция и магния) и содержания ионов кальция.
Замечания к методикам определения жёсткости воды
В анализируемой воде могут содержаться ионы меди, цинка, марганца и других металлов. Они образуют с трилоном Б внутрикомплексные соединения, которые затрудняют определение жёсткости воды. Влияние этих ионов, а также содержание гидрокарбонат-ионов в воде свыше 1000 мг/л устраняется перед анализом посредством добавления соответствующих реагентов в новую пробу исследуемой воды.
1. Ионы Сu2+ в аммиачном буферном растворе образуют синие комплексы, цвет которых искажает точку перехода индикатора. Поэтому следует удалить ионы меди, добавляя к анализируемой воде 1–2 мл 5 %-ного раствора сульфида натрия Nа2S. В этом случае вместе с ионами меди связываются ионы Zn2+, переходя в сульфид цинка ZnS.
Содержание ионов меди менее 0,5 мг/л не влияет на результат анализа воды.
2. В присутствии ионов марганца образуется пероксид марганца. Это обнаруживается при добавлении аммиачного буферного раствора к исследуемой воде, которая приобретает серый цвет. Ионы марганца связываются добавлением нескольких капель 1 %-ного раствора гидрохлорида гидроксиламина НОNН2 · НСl.
3. Содержание ионов железа (II) до 10 мг/л не оказывает существенного влияния на определение жёсткости воды. Большее количество ионов Fе2+ можно устранить посредством разбавления исследуемой воды, или осаждением ионов железа из раствора в виде гидроксида Fе(ОН)2 действием раствора аммиака в присутствии хлорида аммония NН4Сl.
Опыт 4.Определение жёсткости воды после реагентного умягчения
Метод А.Умягчение воды карбонатом натрия
Количество вещества реагента для умягчения воды берётся в избытке против эквивалентного по жёсткости воды на 1 ммоль/л. Поэтому количество вещества реагента (Nа2СО3), необходимого для умягчения 50 мл воды, рассчитывают, исходя из формулы:
nсоли =  ,
,
таким образом:
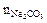 =
=  (моль)
(моль)
Поскольку для проведения анализа берётся раствор соли молярной концентрации эквивалента, равной 0,025 моль/л, то объём раствора Nа2СО3, необходимый для умягчения исследуемой пробы воды, рассчитывают по формуле:
V =  .
.
Реактивы и оборудование
Растворы 0,025 н. карбоната натрия и 0,025 н. ортофосфата натрия – Nа2СО3 и Nа3РО4; трилон Б, 0,05 н. раствор; аммиачный буферный раствор; индикатор – раствор эриохрома чёрного Т или его сухая смесь с хлоридом натрия (1 : 200), образец воды для исследования.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба на 250 мл.
Порядок выполнения работы
В термостойкий химический стакан наливают 50 мл исследуемой воды и прибавляют рассчитанный объём раствора Nа2СО3. Полученный раствор нагревают на электроплитке или газовой горелке с асбестовой сеткой до 40–50 0С. Затем раствор охлаждают и фильтруют в коническую колбу (фильтр предварительно трижды промывают дистиллированной водой над раковиной).
Фильтр промывают дистиллированной водой (один раз порцией 5 мл) и промывную воду присоединяют к фильтрату. После этого определяют общую жёсткость воды, как это описано в опыте 1.
Метод Б.Умягчение воды ортофосфатом натрия
Умягчение воды производят аналогично методике А, но без нагревания.
Экспериментальные данные и результаты расчёта заносят в таблицу.
| Номер титрования | Объём исследуемой воды, мл | Объём раствора трилона Б, мл | Средний объём раствора трилона Б, мл | Объём реагента, мл | Молярная концентрация эквивалента трилона Б, моль/л | Общая жёсткость воды после умягчения, ммоль/л |
| V1 | ||||||
| V2 | ||||||
| V3 |
Опыт 5.Определение жёсткости воды после ионно-обменного умягчения
Умягчение воды пермутитом
Прекрасным средством для уменьшения жёсткости воды являются цеолиты, которые принадлежат к группе каркасных силикатов. Чтобы описать строение цеолитов, необходимо учесть, что некоторые химические элементы обладают способностью имитировать кремний Si, частично замещая его в структуре кислородных соединений. Это в первую очередь относится к алюминию Аl. Например, в кристаллах нефелина, в состав которого входят кислород О, кремний Si, алюминий Аl и натрий Nа, атомы алюминия, так же как и атомы кремния окружены атомами кислорода по тетраэдру. Кремнекислородные тетраэдры [SiО4] сосуществуют с алюмокислородными [АlО4]. Обобщая свои вершины, тетраэдры обоих типов совместно образуют трёхмерный каркас, в пустотах которого находятся атомы натрия. Формула этого каркасного минерала запишется в виде Nа[АlSiО4]. Он относится к группе так называемых алюмо-силикатов.
При фильтровании воды через слой цеолита происходит ионный обмен: ионы Са2+ и Мg2+ поглощаются, а в воду переходит эквивалентное количество ионов Nа+. Когда обменная способность цеолита истощается, его регенерируют, обрабатывая 5-10 %-ным раствором хлорида натрия NаСl.
Для смягчения воды обычно используют искусственно полученные цеолиты (пермутиты), синтез которых осуществляется при добавлении горячего раствора сульфата алюминия Аl2(SО4)2 к раствору, содержащему жидкое стекло Nа2SiО3 и кальцинированную соду Nа2СО3.
Очень важную для промышленности группу каркасных алюмосиликатов составляют цеолиты, структуры которых содержат более или менее широкие "каналы". В каналах находятся молекулы воды, довольно слабо связанные с каркасом. При осторожном нагревании вода постепенно удаляется без разрушения кристаллической структуры. Замечательно, что вслед за тем вода снова может быть поглощена в том же количестве или заменена другими молекулами. Таким образом, кристаллическая структура цеолитов способна играть роль молекулярного "сита", избирательно пропускающего молекулы не слишком большого размера.
Порядок выполнения работы
Воду, подлежащую исследованию, в количестве 250 мл 2-3 раза пропускают через слой минерала. Во время фильтрации происходят обменные реакции между катионами минерала и катионами солей жёсткости, растворённых в воде. Берут 100 мл умягчённой воды, добавляют 3-4 капли метилового оранжевого и проверяют щёлочность воды. Оставшуюся воду ещё раз фильтруют через слой минерала и опять проверяют щёлочность.
Опыт 6.Умягчение воды методом катионирования
Из трубки с катионитом сливают избыток воды. При этом следят за тем, чтобы уровень воды в трубке был выше слоя катионита во избежание появления воздушных пузырьков внутри катионита. Заливают катионит исследуемой водой, жёсткость которой необходимо определить. Медленно пропускают воду через слой катионита так, чтобы был виден отрыв капель, и следят за уровнем воды в трубке. Первые 20-30 мл фильтрата отбрасывают. Затем отмеряют 100 мл воды, пропущенной через слой катионита, переносят пробу в коническую колбу для титрования и определяют общую жёсткость воды по методике, приведённой в опыте 1. Сравнивают жёсткость воды до и после её умягчения, а также результаты, полученные при умягчении воды реагентным и ионообменным методами, и делают соответствующие выводы. Результаты опыта сводят в таблицу.
| Номер титрования | Объём исследуемой пробы воды, мл | Объём раствора трилона Б, мл | Молярная концентрация эквивалента трилона Б, моль/л | Общая жёсткость воды | |
| после катионирования, моль/л | до катионирования, моль/л | ||||
Дата: 2016-10-02, просмотров: 475.