ОПРЕДЕЛЕНИЕ КАЧЕСТВА ВОДЫ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
по курсу "Химия воды"

Астрахань – 2008
УДК 54(07)
ББК 24
Определение качества воды: Лабораторный практикум по курсу "Химия воды" / А.А. Бурлинóв, Ю.И. Рябухин / Астрахан. гос. техн. ун-т. – Астрахань, 2008. – 62 с.
Предназначены для студентов, обучающихся по направлению подготовки бакалавров
190500.62 – Эксплуатация транспортных средств (ускоренный курс)
и по специальностям:
180103.65 – Судовые энергетические установки
180403.65 – Эксплуатация судовых энергетических установок
140104.65 – Промышленная теплоэнергетика
и изучающих дисциплину "Химия воды и топлив", для выполнения лабораторных работ по темам "Показатели качества воды" и "Жёсткость воды".
Кратко изложены основные понятия о показателях качества воды и даны некоторые сведения о физико-химических способах уменьшения жёсткости воды.
Содержит описание лабораторных работ, позволяющих определить временную, постоянную и общую жёсткость воды. Приведены техника безопасной работы в химической лаборатории, требования к оформлению отчёта по лабораторной работе, задачи и примеры их решения, контрольные вопросы и список рекомендуемой литературы.
Печатается по решению кафедры "Общая, неорганическая и аналитическая химия" (протокол № 3 от 26 марта 2008 г.)
Рис. 5, табл. 1, библиогр.: 9 назв., приложение – 1 табл.
Рецензент: доктор техн. наук, профессор Пивоварова Н.А.
© Бурлинóв А.А.,
Рябухин Ю.И., 2008
 © Астраханский государственный
© Астраханский государственный
технический университет, 2008
ВВЕДЕНИЕ
Вода1 (оксид водорода) Н2О, относительная молекулярная масса 18,016, – простейшее химическое соединение водорода с кислородом. Вода – жидкость без запаха, вкуса и цвета, при нормальном атмосферном давлении имеет температуру плавления 0 0С, температуру кипения 100 0С.
Вода самое распространённое в природе вещество. Она является главной составной частью водной оболочки земного шара – гидросферы.
Поверхность земного шара на 72 % покрыта водой – это океаны, моря, реки, озёра, болота, ледники. В довольно больших количествах вода находится в атмосфере, а также в земной коре. Общие запасы свободной воды на Земле составляют 1,4 млрд. км3. Почти вся вода на Земле (97,2 %) находится в Мировом океане. Приблизительно 2,1 % воды сосредоточено в полярных льдах и ледниках. Вся пресная вода в озёрах, реках, болотах и в составе грунтовых вод составляет лишь 0,6 %. Остальные 0,1 % воды входят в состав солёных грунтовых и солончаковых вод. Атмосферная вода в виде водяного пара составляет 0,0005 %.
Изотопный состав воды.Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (мол. %): 1H216O – 99,73; 1Н218О – 0,20; 1H217O – 0,04; 1H2Н16O – 0,03; остальные 5 изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного оксида трития 3H2О (или Т2О).
По физическим свойствам тяжёлая вода (оксид дейтерия D2O) с кислородом природного изотопного состава заметно отличается от обычной воды. Содержание D2О в воде составляет 0,0145–0,0146 мас. %.
Вода, содержащая нуклид 18О (тяжёло-изотопная вода), по свойствам ближе к воде с нуклидом 16О.
Различают природную, сточную и денатурированнуюводу.
Природная вода – это вода, которая качественно и количественно формируется под влиянием естественных процессов при отсутствии антропогенного воздействия1 и качественные показатели которой находятся на естественном среднемноголетнем уровне.
Природная вода представляет собой сложную многокомпонентную систему, в состав которой входят минеральные вещества, газы, а также коллоидные и крупнодисперсные частицы, в том числе микроорганизмы.
По величине минерализации (г/л) различают следующие природные воды: ультрапресные – до 0,2; пресные – 0,2–0,5; слабоминерализованные – 0,5–1,0; солоноватые – 1–3; солёные – 3–10; с повышенной солёностью – 10–35; переходные к рассолам – 35–50; рассолы – более 50.
Макрокомпонентами природных вод обычно являются атомы (ионы) элементов Са, Mg, Na, К, Fe (катионогенные воды) и Si, С, S, C1 (анионогенные воды). К микрокомпонентам природных вод относятся редкие и рудные элементы, например,В, Li, Rb, Сu, Zn, Bi, Be, W, Br, I.
Основные газы, которые содержатся в природных водах, – это кислород О2, диоксид углерода СО2 и азот N2 (характерны как для поверхностных, так и для глубинных условий), метан СН4, сероводород Н2S, монооксид углерода СО и водород Н2 (более типичны для подземных вод и для вод вулканически активных областей).
Сточная вода– это вода, бывшая в бытовом, производственном или сельскохозяйственном употреблении, а также прошедшая через какую-либо загрязненную территорию, в том числе населённого пункта.
Денатурированнаяили природно-антропогенная вода –этоприродная вода, подвергаемая антропогенному загрязнению, например, путём смешивания со сточной водой.
Минеральные воды –это природные, обычно подземные, воды, характеризующиеся повышенным содержанием биологически активных минеральных или органических компонентов и обладающие определёнными химическим составом и физико-химическими свойствами (температура, радиоактивность), благодаря которым они оказывают лечебное действие.
В широком смысле к минеральным водам относят и природные воды, из которых извлекают химические элементы (например, галогены, бор), а также термальные воды, используемые в энергетических целях.
По составу минеральные воды подразделяют на азотные, метановые и углекислые. По анионному составу различают следующие классы минеральных вод: гидрокарбонатные (содержат преимущественно НСО3–), сульфатные (SO42–), хлоридные (Сl–), а также гидрокарбонатно-сульфатные, хлоридно-сульфатные, хлоридно-гидрокарбонатные и хлоридно-сульфатно-гидрокарбонатные. По катионному составу различают минеральные воды с преобладанием ионов Са2+ (кальциевые), Na+ (натриевые), Са2+ и Mg2+, Са2+, Mg2+ и Na+, Са2+ и Na+, Mg2+ и Na+.
Сумма находящихся в воде анионов, катионов, недиссоциированных молекул и биологически активных компонентов (исключая газы) определяет общую минерализацию воды, которую выражают в г/л. Различают минеральные воды слабой (1–2 г/л), малой (2–5 г/л), средней (5–15 г/л) и высокой (15–30 г/л) минерализации, а также рассольные (35–150 г/л) и крепкорассольные (свыше 150 г/л) минеральные воды.
По величине рН выделяют сильнокислые (рН < 3,5), кислые (3,5–5,5), слабокислые (5,5–6,8), нейтральные (6,8–7,2), слабощелочные (7,2–8,5) и щелочные (> 8,5) минеральные воды.
По температуре различают холодные (до 20 0С), тёплые (слаботермальные, 20–35 0С), горячие (термальные, 35–42 0С) и очень горячие (высокотермальные, больше 42 0С) минеральные воды.
Лечебные минеральные воды применяют для питья (общая минерализация ≤ 20 г/л), ванн, душей, ингаляций, полосканий и орошений на курортах1. Кроме того, пользуются привозными водами, разлитыми в бутылки. Некоторые минеральные воды применяют в качестве освежающего напитка; общая минерализация таких вод хлоридно-натриевого типа не должна превышать 4–4,5 г/л, гидрокарбонатного типа – 6 г/л.
Дистиллированная вода, полученная конденсацией водяного пара, практически не содержит солей и растворённых газов и потому неприятна на вкус. Кроме того, при продолжительном употреблении она даже вредна для организма. Это связано с вымыванием из клеток тканей желудка и кишечника содержащихся в них солей и микроэлементов, которые необходимы для нормального функционирования организма.
Получение высокочистой воды – весьма сложная задача. Поскольку она хранится в каком–то сосуде, в ней содержатся примеси материала этого сосуда (будь то стекло или металл). Для прецизионных научных исследований наиболее чистую воду получают методом ректификации (перегонкой) дистиллированной воды во фторопластовых колоннах.
Морская вода. Высокая концентрация солей делает морскую воду непригодной для питья и для большинства других целей. Морскую воду часто называют солёной. Под солёностью понимают массу (г) сухих солей в 1 кг морской воды. В пределах мирового океана солёность колеблется от 33 до 37 г/кг, в среднем её можно считать равной 35 г/кг. Это означает, что в морской воде содержится приблизительно 3,5 % по массе растворённых солей.
Удаление солей из воды до предела, близкого к содержанию их в дистиллированной воде (доли или несколько мг/л), называется обессоливанием, а удаление солей до концентраций, допустимых при применении вод для питья (до 1 г/л), – опреснением.
Пресная вода. Основными потребителями пресной воды являются: сельское хозяйство (70 %), промышленность, включая энергетику (20 %), и коммунальное хозяйство (~10 %).
В промышленном производстве наиболее водоёмкими являются химическая, целлюлозно-бумажная и металлургическая промышленность. Так, на изготовление 1 т синтетического волокна расходуется 2500–5000, пластмассы – 500–1000, бумаги – 400–800, стали и чугуна – 160–200 м3 воды.
Норма водоснабжения на одного человека 1000 т воды в год (с учётом промышленности и сельского хозяйства).
Опыт показывает, что на бытовые нужды житель благоустроенного города расходует 200–300 л воды в день. Распределение потребления воды в среднем следующее: на приготовление пищи и питьё расходуется всего лишь 5 %, в смывном бачке туалета – 43, для ванны и душа – 34, на мытьё посуды – 6, на стирку – 4, на уборку помещения – 3 %.
Содержание солей в водопроводной воде, согласно требованиям органов здравоохранения, не должно превышать 0,05 %. Это намного меньше по сравнению с их 3,5 %-ным содержанием в нормальной морской воде или по сравнению с ~0,5 %-ным содержанием в солоноватых подземных водах.
Статистика показывает, что 80 % всех заболеваний в мире связано с плохим качеством питьевой воды и нарушением санитарно-гигиенических норм водоснабжения. И ещё одна цифра – от болезней, связанных с водой, страдает треть населения планеты, то есть 2 млрд. человек. После этих цифр так и хочется сказать: "будьте осторожны" и "берегите воду от загрязнений".
Общее число микроорганизмов в 1 мл питьевой воды должно быть не выше 100, число бактерий группы кишечных палочек (коли-индекс) – не более 3.
Техническая вода. Воду, расходуемую промышленными предприятиями, принято называть технической. Её применяют главным образом в качестве охлаждающего агента, транспортирующей среды для сыпучих материалов (например, гидротранспорт золы на тепловых электростанциях – ТЭС), растворителя. В целом по всем отраслям промышленности 70–75 % от общего расхода воды применяют как хладагент по циркуляционной схеме. В этом случае вода лишь нагревается и практически не загрязняется. Главные источники загрязнения охлаждающей воды систем циркуляционного водоснабжения – вода, добавляемая в системы для восполнения неизбежных потерь, и атмосферный воздух, из которого поглощаются в охладителях воды взвешенные частицы и газы, растворимые в воде.
Основными ионами, которые могут приводить к отложениям минеральных солей в системах циркуляционного водоснабжения, являются анионы: НСО3–, СО32–, ОН–, SО42–, РО43– и SiO32–, а также катионы: Са2+, Mg2+, Fe2+, Fе3+, Al3+ и Zn2+. Наиболее часто встречающийся компонент солевых отложений – карбонат кальция СаСО3. Предотвратить отложение карбонатов можно подкислением воды серной H2SО4 или хлороводородной кислотами НСl, её рекарбонизацией (обычно обработка топочными газами, содержащими СО2), действием органических фосфатов, а также полифосфатов (NaPO3)6 и Na5P3О10.
Для предотвращения (уменьшения) коррозии труб и теплообменного оборудования в воду добавляют ингибиторы коррозии, например, полифосфаты или ингибиторы на основе хромато-цинковых смесей.
Для предупреждения обрастания оборудования микрофитами (водорослями) воду в основном хлорируют (содержание Cl2 до 5 мг/л), а иногда озонируют (обрабатывают озоном О3).
При эксплуатации различных транспортных средств, машин и установок, снабжённых двигателями внутреннего сгорания (ДВС), кроме топлив и смазочных материалов, применяются различные технические жидкости, создаваемые в большинстве своём на водной основе. К ним относятся охлаждающие жидкости, которые заливают в системы охлаждения двигателей, гидравлические и амортизаторные жидкости, которые используют для заполнения гидроподъёмных, тормозных и амортизационных систем, различные промывочные жидкости для очистки масляных систем двигателей без их разборки и др.
Порядок выполнение работы
В воду, налитую в цилиндр диаметром 40–50 мм и высотой не менее 40 см, медленно опускают проволоку с кольцом чёрного цвета толщиной 1 мм и диаметром 20 мм. Кольцо изготовлено на конце прямого участка проволоки и изогнуто под углом 900 к нему.
Кольцо опускают в воду при боковом освещении на глубину, при которой оно станет невидимым, и отмечают глубину погружения кольца в сантиметрах. Затем медленно поднимают кольцо, отмечая глубину, при которой оно снова становится видимым. Средняя величина из этих измерений и характеризует прозрачность воды "по кольцу". Перевод прозрачности по "кольцу" в прозрачность "по шрифту" (Снеллена, рис. 1), которую определяют с использованием специального цилиндра, приведён в таблице.
Количественное определение прозрачности воды (в см)
| Прозрачность | Значение | |||||||||
| "по кольцу", "по шрифту" | 2,5 | |||||||||
| Взвешенные частицы, мг/л | 200–100 | 100–85 | 35–25 | 50–14 | 30–10 | 17–10 | 12–8 | 9–6 | 8–5 | 6–5 |
Опыт 2.Определение запаха воды
(Визуально-органолептический способ)
Запах воды обусловлен наличием в ней летучих пахнущих веществ, которые попадают в воду естественным путём либо со сточными водами. Практически все органические вещества (в особенности жидкие) имеют запах и придают его воде. Обычно запах определяют при нормальной (20 0С) и повышенной (60 0С) температуре воды.
Запах по характеру подразделяют на две группы, описывая его субъективно по своим ощущениям (таблица).
1. Естественного происхождения (от живущих и отмерших организмов, от влияния почв, водной растительности и т. п.).
2. Искусственного происхождения; такие запахи обычно значительно изменяются при обработке воды.
Характер запаха
| Запах естественного происхождения | Запах искусственного происхождения |
| землистый | нефтепродуктов (бензиновый и др.) |
| гнилостный | хлорный |
| плесневый | уксусный |
| торфяной | фенольный и др. |
| травянистый | сероводородный |
| болотный | аммиачный |
Порядок выполнение работы
Для определения запаха отбирают пробу воды в широкогорлую колбу объёмом 0,25–0,5 л. Накрывают горло колбы фильтровальной бумагой или часовым стеклом. Затем нагревают колбу в водяной бане до температуры воды 60–70 0С, и, совершая плавные вращательные движения, открывают колбу.
Соблюдая осторожность, определяют запах.
Определение запаха сильнопахнущих проб воды можно производить без предварительного нагревания.
Количественно интенсивность запаха характеризуют следующие показатели:
отсутствие запаха – едва заметный – заметный – сильный – очень сильный.
Опыт 3.Обнаружение примесей нефтепродуктов
(Визуально-органолептический способ)
Нефтепродуктами называют смеси углеводородов, а также индивидуальные химические соединения, получаемые из нефти и нефтяных газов: алифатические [например н-гептан (I) и изооктан (II)], ароматические [например бензол (III) и толуол (IV)] и алициклические [например циклопентан (V) и циклогексан (VI)] соединения:


Примеси нефтепродуктов бывают трёх типов – плёночные, растворённые и эмульгированные.
Плёночные примеси нефтепродуктов – это нефтепродукты, находящиеся на поверхности водного объекта в виде тонкого, близкого к мономолекулярному слою (плёнки).
Растворённые примеси нефтепродуктов – это нефтепродукты, находящиеся в водной толще в растворённом состоянии.
Эмульгированные примеси нефтепродуктов – это нефтепродукты, находящиеся в водной толще в виде эмульсии (размер частиц более 0,45 нм).
Определение растворённых и эмульгированных примесей нефтепродуктов обычно производится суммарно.
Нефтепродукты обнаруживаются по запаху, радужным плёнкам, плавающим капелькам и мути, а также маслянистому пятну на фильтровальной бумаге после пропускания через неё воды.
Порядок выполнение работы
В стакан объёмом 500 мл наливают пробу исследуемой воды и отмечают наличие радужных плёнок и плавающих капель на поверхности.
В боковом проходящем свете отмечают присутствие мути.
Наличие нефтяных масел в воде определяют также пропусканием 1–2 л исследуемой воды через фильтровальную бумагу и высушиванием последней на воздухе при температуре 40–50 0С.
Появление маслянистого пятна на бумаге свидетельствует о наличии примесей нефтепродуктов в исследуемой пробе.
Порядок выполнение работы
Полоску универсальной индикаторной бумаги смачивают исследуемой водой. Сравнивая цвет полоски с наиболее близкой окраской прилагаемой к набору индикаторной бумаги шкалы, определяют значение рН.
Цвет полоски может не соответствовать в точности цветам, показанным на шкале, а представлять собой промежуточную, переходную окраску. В таком случае значение рН определяют с погрешностью до 0,5.
Метод Б. Инструментально–электролитический метод определения водородного показателя
Порядок выполнение работы
Подключают прибор к электросети и дают прогреться в течение 30 мин. Настраивают прибор по двум буферным растворам – в кислой и щелочной областях значения рН. Для этого наливают в стакан соответствующий буферный раствор, опускают в него электроды, фиксируют значение рН и, если необходимо, корректируют его с помощью специальной настройки.
Перед каждым погружением в буферный или исследуемый раствор электроды тщательно промывают дистиллированной водой и осторожно удаляют избыток воды с их поверхности фильтровальной бумагой.
Измеряют величину рН в анализируемом растворе.
По окончании работы выключают прибор.
Электроды промывают дистиллированной водой и погружают в воду для хранения.
Порядок выполнения работы
К 50 мл исследуемой воды, отмеренной цилиндром в коническую колбу, добавляют 2 капли раствора индикатора фенолфталеина.
Если пурпурная окраска не появляется, то добавляют 2 капли раствора индикатора метилового оранжевого и проводят титрование соляной кислотой до перехода окраски из соломенно-жёлтой в оранжевую.
Если пурпурная окраска при добавлении фенолфталеина появилась, то титрование проводят раствором НСl до её исчезновения, а затем прикапывают раствор метилового оранжевого.
Суммарное количество кислоты, пошедшее на титрование, определяет общую щёлочность воды.
Для уменьшения погрешности титрование следует вести на фоне белой бумаги.
Общую щёлочность воды вычисляют по формуле:
Щ =  · 103,
· 103,
где V1 – объём раствора НСl, расходуемый на титрование пробы воды, мл;
VВ – объём воды, взятой для титрования, мл;
с – молярная концентрация эквивалента (нормальная концентрация) или молярная концентрация НСl, моль/л;
103 – коэффициент перевода моль/л в ммоль/л.
Примечание. Щёлочность свыше 1000 мг/л не даёт чёткой окраски раствора в эквивалентной точке.
Количественное содержание щелочей определяется путём их нейтрализации 0,1 н. раствором НСl в присутствии индикатора фенолфталеина с предварительным кипячением пробы воды в течение 3–5 мин.
Опыт 6. Определение общей кислотности сточных вод
Кислотностью называется содержание в воде веществ, вступающих в реакцию со щелочами (NаОН, КОН). К этим веществам относятся:
а) сильные кислоты (соляная НСl, азотная НNО3, серная Н2SО4 и др.);
б) слабые кислоты (уксусная СН3СООН, сероводородная Н2S, сернистая Н2SО3 и др.);
в) катионы слабых оснований (ионы аммония NН4+, железа Fе2+, алюминия Аl3+);
г) органические основания.
Реактивы и оборудование
Гидроксид натрия, 0,1 н. титрованный раствор; индикатор – 0,1 % водный раствор метилового оранжевого; образец воды для исследования.
Лабораторный штатив с лапкой, бюретка, мерный цилиндр, воронка, коническая колба (колба Эрленмейера) на 250 мл.
Порядок выполнения работы
К 50 мл анализируемой воды прибавляют 1–2 капли раствора индикатора метилового оранжевого (см. сноску в лаб. работе № 2) и проводят титрование 0,1 н. раствором NаОН до перехода окраски раствора в устойчивый жёлтый цвет. Общую кислотность вычисляют по формуле:
К = 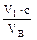 · 103,
· 103,
где V1 – объём раствора NаОН, расходуемый на титрование пробы воды, мл;
VВ – объём воды, взятой для титрования, мл;
с – молярная концентрация эквивалента (нормальная концентрация) или молярная концентрация НСl, моль/л;
103 – коэффициент перевода моль/л в ммоль/л.
Порядок выполнение работы
Колбу объёмом 0,5 л заполняют на 1/3 исследуемой водой и взбалтывают примерно полминуты.
Проба считается положительной, если пена сохраняется более 1 мин.
Значение рН воды при этом должно быть в интервале 6,5–8,5 (при необходимости воду нейтрализуют – подщелачивают или подкисляют).
Опыт 8.Определение содержания взвешенных частиц
В сточной воде содержатся в коллоидном и суспендированном состояниях взвешенные частицы. Содержание этих частиц определяют путём пропускания определённого объёма сточной воды через фильтр: мембранный, из пористого стекла (типа воронки Шотта) или из плотной фильтровальной бумаги.
Порядок выполнение работы
Высушенный при 105–110 0С до постоянной массы фильтр взвешивают на технохимических электронных весах и пропускают через него предварительно взболтанную для равномерного распределения взвешенных частиц исследуемую воду объёмом 1 л. После этого фильтр с остатком взвешенных частиц высушивают до постоянной массы (перед взвешиванием фильтр для охлаждения помещают в эксикатор).

| Содержание взвешенных частиц х (в мг/л) вычисляют по формуле:
х = 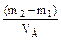 · 106,
где m1 – масса фильтра, г;
m2 – масса фильтра с остатком взвешенных частиц, г;
V – объём исследуемой воды, мл.
106 – коэффициент перевода г/мл в мг/л. · 106,
где m1 – масса фильтра, г;
m2 – масса фильтра с остатком взвешенных частиц, г;
V – объём исследуемой воды, мл.
106 – коэффициент перевода г/мл в мг/л.
|
| Воронка Шотта |
Опыт 9.Определение содержания растворённых веществ
(определение сухого остатка)
Сухой остаток – это остаток, полученный после выпаривания отфильтрованной пробы воды и высушенный до постоянной массы при 110–120 0С.
В процессе определения сухого остатка некоторые растворённые в воде вещества претерпевают изменения. Бикарбонаты кальция и магния Са(НСО3)2 и Мg(НСО3)2 разлагаются и переходят в карбонаты СаСО3 и МgСО3; хлорид магния гидролизуется с выделением хлороводорода: МgСl2 + 2Н2О = Мg(ОН)2 + 2НСl; некоторые органические вещества окисляются; крупные коллоидные частицы задерживаются на фильтре, а сульфаты кальция и магния СаSО4 и МgSО4 удерживают кристаллизационную воду, поэтому по сухому остатку можно лишь приблизительно судить о количестве растворённых в воде веществ.
Реактивы и оборудование
Образец воды для исследования.
Коническая колба (колба Эрленмейера) на 250–1000 мл, фарфоровая чашка, водяная баня, сушильный шкаф, фильтровальная бумага.
Порядок выполнения работы
Около 100 мл анализируемой профильтрованной воды наливают в мерную колбу и часть её помещают во взвешенную фарфоровую чашку, которую устанавливают на кипящую водяную баню. Под чашку подкладывают несколько слоёв фильтровальной бумаги, чтобы её дно не загрязнилось осадками от брызг кипящей воды. По мере выпаривания в чашку добавляют анализируемую воду. После упаривания всей пробы воды остаток в чашке высушивают в течение 2–3 часов в сушильном шкафу при 110-120 0С до постоянной массы. Содержание сухого остатка х (в мг/л) вычисляют по формуле:
х = 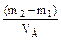 · 106, · 106,
| где m1 – масса чашки, г; m2 – масса чашки с сухим остатком, г; VВ – объём исследуемой воды, мл; 106 – коэффициент перевода г/мл в мг/л. |
Опыт 10.Определение прокалённого остатка
При прокаливании потерю или привес (за счёт образования оксидов) определяют, прокаливая сухой остаток в муфельной печи.
Порядок выполнения работы
Взвешивают 5–10 мг сухого остатка, предварительно полученного по методике (опыт 9) и помещают его в фарфоровую чашку диаметром 5–7,5 см. Выдерживая в муфельной печи при температуре 700–800 0С, остаток доводят до постоянной массы.
Результат взвешивания пересчитывают на количество воды, взятой для получения исходной массы сухого остатка.
Прокалённый остаток выражают в мг на л исследуемой воды.
ЖЁСТКОСТЬ ВОДЫ
Ввиду широкой распространённости кальция, его соли почти всегда содержатся в природной воде. Из природных солей кальция: известняк СаСО3, доломит – СаСО3 · МgСО3, гипс СаSО4 · 2Н2О только последний несколько растворим в воде (см. приложение). Однако, если вода содержит диоксид углерода, то карбонат кальция тоже может переходить в раствор в виде гидрокарбоната кальция:
СаСО3 + СО2 + Н2О = Са(НСО3)2
Природная вода, содержащая в растворе большое количество солей кальция и магния, называется жёсткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их.
Жёсткостью воды называется совокупность свойств воды, обусловленная наличием в ней преимущественно катионов Са2+ (кальциевая жёсткость) и Мg2+ (магниевая жёсткость).
Жёсткость воды бывает двух видов: карбонатная и некарбонатная.
Карбонатная, или временная, жёсткость воды (ЖК) обусловлена содержанием в воде гидрокарбонатов кальция и магния:
Са(НСО3)2 и Мg(НСО3)2
Некарбонатная, или постоянная, жёсткость воды (ЖНК) обусловлена присутствием сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция и магния:
МSО4, МСl2, МSiО3, М(NО3)2, М3(РО4)2 (М – Са2+, Мg2+)
Совокупность карбонатной и некарбонатной жёсткости называется общей жёсткостью воды.
ЖО = ЖК + ЖНК.
Жёсткость воды выражают суммой миллимоль эквивалентов ионов кальция и магния, содержащихся в 1 л воды. Один миллимоль эквивалентов ионов жёсткости отвечает содержанию 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+.
Жёсткость природных вод изменяется в широких пределах: от 0,1–0,2 ммоль/л в реках и озёрах, расположенных в зонах тайги и тундры, до 80–100 ммоль/л и более в подземных водах и морях.
Среднее значение жёсткости воды Мирового океана 130,5 ммоль/л (из них на ионы Са2+ приходится 22,5 ммоль/л, на ионы Mg2+ – 108 ммоль/л).
По значению жёсткости воду условно подразделяют на:
очень мягкую < 1,5 ммоль/л
мягкую 1,5–4 ммоль/л
средней жёсткости 4–8 ммоль/л
жёсткую 8–12 ммоль/л
очень жёсткую > 12 ммоль/л
В зависимости от конкретных условий на различных производствах допускаемая жёсткость воды может быть различной. Жёсткость воды хозяйственно-питьевых водопроводов должна быть не выше 7,0 ммоль/л, сухой остаток – 1000 мг/л, рН – от 6,0 до 9,0. Для питьевой воды, подаваемой без специальной обработки, по согласованию с органами санитарно-эпидемиологической службы допускаются следующие показатели: общая жёсткость – до 10 ммоль/л, сухой остаток – до 1500 мг/л, содержание ионов железа и марганца – соответственно до 1 и до 0,5 мг/л.
Жёсткость воды рассчитывают по формуле:
Ж =  · 103,
· 103,
где m(В) – масса растворённого вещества, г;
Мэкв (В) – молярная масса эквивалентов вещества, г/моль;
V – объём воды, л;
103 – коэффициент перевода моль/л в ммоль/л.
Присутствие в воде значительного количества солей кальция или магния делает её непригодной для многих технических целей. Так, при продолжительном питании паровых котлов жёсткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка уже при толщине слоя в 1 мм сильно понижает передачу теплоты стенками котла и, следовательно, ведёт к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин, как в кипятильных трубах, так и на стенках самого котла.
Жёсткая вода не даёт пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот – пальмитиновой и стеариновой – переходят в нерастворимые кальциевые соли тех же кислот:
2C17 H35COONa + CaSO4 = (C17H35COO)2Ca↓+ Na2SO4
стеарат натрия стеарат кальция
Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Приведённые выше примеры указывают на необходимость удаления из воды, применяемой для технических целей, солей кальция и магния. Удаление этих солей, называемое водоумягчением, входит в систему водоподготовки – обработки природной воды, используемой для питания паровых котлов и для различных технологических процессов.
В ходе водоподготовки вода освобождается от грубодисперсных и коллоидных примесей и от растворённых веществ. Взвешенные и коллоидные примеси удаляют их коагуляцией добавляемыми к воде солями [обычно А12(SО4)3] с последующей фильтрацией.
Для умягчения воды применяют химические и физические методы.
Химические методы
Для водоумягчения применяют методы осаждения и ионного обмена. Путём осаждения катионы Са2+ и Mg2+ переводят в малорастворимые соединения, выпадающие в осадок. Это достигается либо кипячением воды, либо химическим путем – введением в воду соответствующих реагентов.
Термический методприменим для устранения карбонатной (временной) жёсткости воды. При кипячении (1 час и более) гидрокарбонаты металлов разрушаются, образуя трудно растворимые вещества и одновременно выделяется углекислый газ:
М(НСО3)2 = МСО3↓ + СО2↑ + Н2О
(М = Са, Мg)
Разложение гидрокарбонатов магния может идти и другим путём за счёт гидролиза солей:
2Мg(НСО3)2 = (MgOH)2CO3↓ + 3СО2↑ + Н2О
или
Мg(НСО3)2 = Mg(OH)2↓ + 2СО2↑
Разложение гидрокарбонатов железа сопровождается полным гидролизом солей с одновременным окислением:
4Fе(НСО3)2 + О2 = 4FеО(ОН)↓ + 8СО2↑ + 2Н2О
При кипячении жёсткость воды уменьшается на величину карбонатной жёсткости, поэтому карбонатную жёсткость называют временной.
При реагентных методах для умягчения воды используются различные химические вещества (реагенты), которые путём осаждения переводят катионы жёсткости – катионы кальция и магния – в осадок (в нерастворимые вещества).
Карбонатную жёсткость воды можно устранить добавлением щёлочи (обычно гидроксида кальция – гашёной извести).
При химическом методе осаждения чаще всего в качестве осадителя пользуются известью или кальцинированной содой. При этом в осадок [также в виде СаСО3 и Mg(OH)2] переводятся все соли кальция и магния.
| Са(НСО3)2 + Са(ОН)2 | = | 2СаСО3↓ + 2Н2О |
| Са(НСО3)2 + СаО | = | 2СаСО3↓ + Н2О |
| Мg(НСО3)2 + Са(ОН)2 | = | Мg(ОН)2 + 2СаСО3↓ + 2Н2О |
Процесс обработки воды гашёной – Са(ОН)2 или негашёной – СаО известью, при котором происходит устранение временной жёсткости называют известкованием.
Карбонат натрия (кальцинированная сода) и ортофосфат натрия устраняют не только временную, но и постоянную жёсткость воды:
| Са(НСО3)2 + Nа2СО3 | = | СаСО3↓ + 2NаНСО3 |
| 3Са(НСО3)2 + 2Nа3РО4 | = | Са3(РО4)2↓ + 6NаНСО3 |
| СаСl2 + Nа2СО3 | = | СаСО3↓ + 2NаСl |
| МgSО4 + 2Nа2СО3 + Н2О | = | (МgОН)2СО3↓ + Nа2SО4 + СО2↑ |
| 3МgСl2 + 2Nа3РО4 | = | Мg3(РО4)2↓ + 6NаСl |
При одновременном добавлении извести и соды можно избавиться и от карбонатной, и от некарбонатной жесткости. Это известково-содовый способ. Карбонатная жесткость устраняется известью, некарбонатная – содой. Другим часто используемым смягчителем воды является гексаметафосфат натрия:
2СаС12 + Na
Дата: 2016-10-02, просмотров: 296.