Пенистостью считается способность воды сохранять искусственно созданную пену. Данный показатель может быть использован для качественной оценки присутствия таких веществ, как детергенты (поверхностно-активные вещества – ПАВ) природного и искусственного происхождения и др. Пенистость определяют, в основном, при анализе сточных и загрязнённых природных вод.
Порядок выполнение работы
Колбу объёмом 0,5 л заполняют на 1/3 исследуемой водой и взбалтывают примерно полминуты.
Проба считается положительной, если пена сохраняется более 1 мин.
Значение рН воды при этом должно быть в интервале 6,5–8,5 (при необходимости воду нейтрализуют – подщелачивают или подкисляют).
Опыт 8.Определение содержания взвешенных частиц
В сточной воде содержатся в коллоидном и суспендированном состояниях взвешенные частицы. Содержание этих частиц определяют путём пропускания определённого объёма сточной воды через фильтр: мембранный, из пористого стекла (типа воронки Шотта) или из плотной фильтровальной бумаги.
Порядок выполнение работы
Высушенный при 105–110 0С до постоянной массы фильтр взвешивают на технохимических электронных весах и пропускают через него предварительно взболтанную для равномерного распределения взвешенных частиц исследуемую воду объёмом 1 л. После этого фильтр с остатком взвешенных частиц высушивают до постоянной массы (перед взвешиванием фильтр для охлаждения помещают в эксикатор).

| Содержание взвешенных частиц х (в мг/л) вычисляют по формуле:
х = 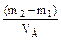 · 106,
где m1 – масса фильтра, г;
m2 – масса фильтра с остатком взвешенных частиц, г;
V – объём исследуемой воды, мл.
106 – коэффициент перевода г/мл в мг/л. · 106,
где m1 – масса фильтра, г;
m2 – масса фильтра с остатком взвешенных частиц, г;
V – объём исследуемой воды, мл.
106 – коэффициент перевода г/мл в мг/л.
|
| Воронка Шотта |
Опыт 9.Определение содержания растворённых веществ
(определение сухого остатка)
Сухой остаток – это остаток, полученный после выпаривания отфильтрованной пробы воды и высушенный до постоянной массы при 110–120 0С.
В процессе определения сухого остатка некоторые растворённые в воде вещества претерпевают изменения. Бикарбонаты кальция и магния Са(НСО3)2 и Мg(НСО3)2 разлагаются и переходят в карбонаты СаСО3 и МgСО3; хлорид магния гидролизуется с выделением хлороводорода: МgСl2 + 2Н2О = Мg(ОН)2 + 2НСl; некоторые органические вещества окисляются; крупные коллоидные частицы задерживаются на фильтре, а сульфаты кальция и магния СаSО4 и МgSО4 удерживают кристаллизационную воду, поэтому по сухому остатку можно лишь приблизительно судить о количестве растворённых в воде веществ.
Реактивы и оборудование
Образец воды для исследования.
Коническая колба (колба Эрленмейера) на 250–1000 мл, фарфоровая чашка, водяная баня, сушильный шкаф, фильтровальная бумага.
Порядок выполнения работы
Около 100 мл анализируемой профильтрованной воды наливают в мерную колбу и часть её помещают во взвешенную фарфоровую чашку, которую устанавливают на кипящую водяную баню. Под чашку подкладывают несколько слоёв фильтровальной бумаги, чтобы её дно не загрязнилось осадками от брызг кипящей воды. По мере выпаривания в чашку добавляют анализируемую воду. После упаривания всей пробы воды остаток в чашке высушивают в течение 2–3 часов в сушильном шкафу при 110-120 0С до постоянной массы. Содержание сухого остатка х (в мг/л) вычисляют по формуле:
х = 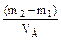 · 106, · 106,
| где m1 – масса чашки, г; m2 – масса чашки с сухим остатком, г; VВ – объём исследуемой воды, мл; 106 – коэффициент перевода г/мл в мг/л. |
Опыт 10.Определение прокалённого остатка
При прокаливании потерю или привес (за счёт образования оксидов) определяют, прокаливая сухой остаток в муфельной печи.
Порядок выполнения работы
Взвешивают 5–10 мг сухого остатка, предварительно полученного по методике (опыт 9) и помещают его в фарфоровую чашку диаметром 5–7,5 см. Выдерживая в муфельной печи при температуре 700–800 0С, остаток доводят до постоянной массы.
Результат взвешивания пересчитывают на количество воды, взятой для получения исходной массы сухого остатка.
Прокалённый остаток выражают в мг на л исследуемой воды.
ЖЁСТКОСТЬ ВОДЫ
Ввиду широкой распространённости кальция, его соли почти всегда содержатся в природной воде. Из природных солей кальция: известняк СаСО3, доломит – СаСО3 · МgСО3, гипс СаSО4 · 2Н2О только последний несколько растворим в воде (см. приложение). Однако, если вода содержит диоксид углерода, то карбонат кальция тоже может переходить в раствор в виде гидрокарбоната кальция:
СаСО3 + СО2 + Н2О = Са(НСО3)2
Природная вода, содержащая в растворе большое количество солей кальция и магния, называется жёсткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их.
Жёсткостью воды называется совокупность свойств воды, обусловленная наличием в ней преимущественно катионов Са2+ (кальциевая жёсткость) и Мg2+ (магниевая жёсткость).
Жёсткость воды бывает двух видов: карбонатная и некарбонатная.
Карбонатная, или временная, жёсткость воды (ЖК) обусловлена содержанием в воде гидрокарбонатов кальция и магния:
Са(НСО3)2 и Мg(НСО3)2
Некарбонатная, или постоянная, жёсткость воды (ЖНК) обусловлена присутствием сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция и магния:
МSО4, МСl2, МSiО3, М(NО3)2, М3(РО4)2 (М – Са2+, Мg2+)
Совокупность карбонатной и некарбонатной жёсткости называется общей жёсткостью воды.
ЖО = ЖК + ЖНК.
Жёсткость воды выражают суммой миллимоль эквивалентов ионов кальция и магния, содержащихся в 1 л воды. Один миллимоль эквивалентов ионов жёсткости отвечает содержанию 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+.
Жёсткость природных вод изменяется в широких пределах: от 0,1–0,2 ммоль/л в реках и озёрах, расположенных в зонах тайги и тундры, до 80–100 ммоль/л и более в подземных водах и морях.
Среднее значение жёсткости воды Мирового океана 130,5 ммоль/л (из них на ионы Са2+ приходится 22,5 ммоль/л, на ионы Mg2+ – 108 ммоль/л).
По значению жёсткости воду условно подразделяют на:
очень мягкую < 1,5 ммоль/л
мягкую 1,5–4 ммоль/л
средней жёсткости 4–8 ммоль/л
жёсткую 8–12 ммоль/л
очень жёсткую > 12 ммоль/л
В зависимости от конкретных условий на различных производствах допускаемая жёсткость воды может быть различной. Жёсткость воды хозяйственно-питьевых водопроводов должна быть не выше 7,0 ммоль/л, сухой остаток – 1000 мг/л, рН – от 6,0 до 9,0. Для питьевой воды, подаваемой без специальной обработки, по согласованию с органами санитарно-эпидемиологической службы допускаются следующие показатели: общая жёсткость – до 10 ммоль/л, сухой остаток – до 1500 мг/л, содержание ионов железа и марганца – соответственно до 1 и до 0,5 мг/л.
Жёсткость воды рассчитывают по формуле:
Ж =  · 103,
· 103,
где m(В) – масса растворённого вещества, г;
Мэкв (В) – молярная масса эквивалентов вещества, г/моль;
V – объём воды, л;
103 – коэффициент перевода моль/л в ммоль/л.
Присутствие в воде значительного количества солей кальция или магния делает её непригодной для многих технических целей. Так, при продолжительном питании паровых котлов жёсткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка уже при толщине слоя в 1 мм сильно понижает передачу теплоты стенками котла и, следовательно, ведёт к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин, как в кипятильных трубах, так и на стенках самого котла.
Жёсткая вода не даёт пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот – пальмитиновой и стеариновой – переходят в нерастворимые кальциевые соли тех же кислот:
2C17 H35COONa + CaSO4 = (C17H35COO)2Ca↓+ Na2SO4
стеарат натрия стеарат кальция
Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Приведённые выше примеры указывают на необходимость удаления из воды, применяемой для технических целей, солей кальция и магния. Удаление этих солей, называемое водоумягчением, входит в систему водоподготовки – обработки природной воды, используемой для питания паровых котлов и для различных технологических процессов.
В ходе водоподготовки вода освобождается от грубодисперсных и коллоидных примесей и от растворённых веществ. Взвешенные и коллоидные примеси удаляют их коагуляцией добавляемыми к воде солями [обычно А12(SО4)3] с последующей фильтрацией.
Для умягчения воды применяют химические и физические методы.
Химические методы
Для водоумягчения применяют методы осаждения и ионного обмена. Путём осаждения катионы Са2+ и Mg2+ переводят в малорастворимые соединения, выпадающие в осадок. Это достигается либо кипячением воды, либо химическим путем – введением в воду соответствующих реагентов.
Термический методприменим для устранения карбонатной (временной) жёсткости воды. При кипячении (1 час и более) гидрокарбонаты металлов разрушаются, образуя трудно растворимые вещества и одновременно выделяется углекислый газ:
М(НСО3)2 = МСО3↓ + СО2↑ + Н2О
(М = Са, Мg)
Разложение гидрокарбонатов магния может идти и другим путём за счёт гидролиза солей:
2Мg(НСО3)2 = (MgOH)2CO3↓ + 3СО2↑ + Н2О
или
Мg(НСО3)2 = Mg(OH)2↓ + 2СО2↑
Разложение гидрокарбонатов железа сопровождается полным гидролизом солей с одновременным окислением:
4Fе(НСО3)2 + О2 = 4FеО(ОН)↓ + 8СО2↑ + 2Н2О
При кипячении жёсткость воды уменьшается на величину карбонатной жёсткости, поэтому карбонатную жёсткость называют временной.
При реагентных методах для умягчения воды используются различные химические вещества (реагенты), которые путём осаждения переводят катионы жёсткости – катионы кальция и магния – в осадок (в нерастворимые вещества).
Карбонатную жёсткость воды можно устранить добавлением щёлочи (обычно гидроксида кальция – гашёной извести).
При химическом методе осаждения чаще всего в качестве осадителя пользуются известью или кальцинированной содой. При этом в осадок [также в виде СаСО3 и Mg(OH)2] переводятся все соли кальция и магния.
| Са(НСО3)2 + Са(ОН)2 | = | 2СаСО3↓ + 2Н2О |
| Са(НСО3)2 + СаО | = | 2СаСО3↓ + Н2О |
| Мg(НСО3)2 + Са(ОН)2 | = | Мg(ОН)2 + 2СаСО3↓ + 2Н2О |
Процесс обработки воды гашёной – Са(ОН)2 или негашёной – СаО известью, при котором происходит устранение временной жёсткости называют известкованием.
Карбонат натрия (кальцинированная сода) и ортофосфат натрия устраняют не только временную, но и постоянную жёсткость воды:
| Са(НСО3)2 + Nа2СО3 | = | СаСО3↓ + 2NаНСО3 |
| 3Са(НСО3)2 + 2Nа3РО4 | = | Са3(РО4)2↓ + 6NаНСО3 |
| СаСl2 + Nа2СО3 | = | СаСО3↓ + 2NаСl |
| МgSО4 + 2Nа2СО3 + Н2О | = | (МgОН)2СО3↓ + Nа2SО4 + СО2↑ |
| 3МgСl2 + 2Nа3РО4 | = | Мg3(РО4)2↓ + 6NаСl |
При одновременном добавлении извести и соды можно избавиться и от карбонатной, и от некарбонатной жесткости. Это известково-содовый способ. Карбонатная жесткость устраняется известью, некарбонатная – содой. Другим часто используемым смягчителем воды является гексаметафосфат натрия:
2СаС12 + Na6P6O18 → Na2Ca2P6O18 + 4NaCl
2Са2+ + Р6О186– → Са2Р6О182–
Гексаметафосфат натрия Na2Ca2P6O18уменьшает концентрацию ионов кальция и магния не за счет образования осадка, а за счёт образования аниона большого размера, не взаимодействующего с мылом.
Ионообменный метод
Ионообменный метод позволяет не только уменьшить жёсткость воды, но и осуществить её глубокую очистку, называемую обессоливанием. Ионообменный метод основан на способности некоторых нерастворимых в воде веществ, стехиометрически обменивать ионы на ионы внешней среды. Вещества, обладающие такими свойствами и называемые ионитами, состоят из каркаса и закреплённых на нём ионогенных групп. По знаку заряда иониты подразделяют на катиониты, аниониты и амфолиты1; по химической природе каркаса – на органические, неорганические и минерально-органические иониты.
Этот метод широко применяется в промышленности. Жёсткость воды устраняют с помощью ионитов (ионообменных смол: катионитов или анионитов) – сложных веществ, способных связывать содержащиеся в воде ионы: катионы или анионы.
В качестве катионитов применяют алюмосиликаты типа:
Na2Al2Si2O8 · nH2O
(Na2R – условное обозначение катионита в Na-форме)
Воду пропускают через катиониты, при этом ионы Са2+ и Мg2+ замещаются на катионы Н+, NH4+, Na+, образуя растворимые соединения, не обуславливающие жёсткость воды.
Таким образом, жёсткая вода, проходя через слой катионита, освобождается от ионов кальция и магния за счёт обмена с катионитом на ионы натрия. Процесс ионного обмена можно представить схемой:
Na2R + 2Са2+ = CaR + 2Na+
Ионы натрия не образуют накипи в трубах и водяных котлах и не образуют с мылом нерастворимых соединений. После насыщения смолы ионами кальция или магния её регенерируют (восстанавливают), пропуская через смолу концентрированный раствор хлорида натрия:
CaR + 2Na+ = Na2R + 2Са2+
Регенерированный катионит снова можно использовать для умягчения новых порций жёсткой воды.
Наиболее совершенным методом очистки воды является катионный и анионный обмен на полимернных смолах. Смолы, сорбирующие (поглощающие) катионы, содержат группы: –СООН, –SO3H и другие.
Н-Катиониты обменивают ионы водорода на ионы металлов:
2R–COOH + Са2+ = (RCOO)2Ca + 2Н+
Для удаления ионов водорода воду пропускают через анионит-смолу, содержащую аминогруппу (R–NH2) и сорбирующую эти ионы:
R–NH2 + Н+ = [R–NH3]+
Пользуясь ионообменными смолами, можно добиться полного обессоливания воды. Отработанные Н-катиониты и аниониты регенерируют обработкой концентрированными растворами серной кислоты или гидроксида натрия:
(RCOO)2Ca + H2SO4 = 2RCOOH + CaSO4
[RNH3]C1 + NaOH = RNH2 + NaCl + H2O
Снижение жёсткости воды проводят в ионообменных колоннах в динамическом режиме: пропусканием воды через неподвижный слой ионита в периодических процессах либо противоточным движением воды и ионита в непрерывных процессах. Для эффективности химического взаимодействия воды с ионитом процесс проводят многократно. Ионный обмен, происходящий при умягчении воды, может быть описан следующей схемой:
М2+ (р-р) + 2R–SО3Nа (т) → (R–SО3)2М (т) + 2Nа+ (р-р)
где R–SO3Na – катионит (Nа+-форма);
М2+ – ионы Са2+ и Mg2+.
В некоторых случаях требуется удалить из воды не только ионы Са2+ и Mg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н-катионит), и анионит, содержащий гидроксид-ионы (ОН-анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка называется обессоливанием воды.
Когда процесс ионного обмена доходит до равновесия, ионит перестает работать, то есть утрачивает способность умягчать воду. Однако любой ионит легко подвергается регенерации. Для этого через катионит пропускают концентрированный раствор NaCl (Na2SO4) или НСl (H2SO4). При этом ионы Са2+ и Mg2+ выходят в раствор, а катионит вновь насыщается ионами Na+ или Н+. Для регенерации анионита его обрабатывают раствором едкого натра или карбоната натрия [последний, вследствие гидролиза по карбонат–иону (СО32– + Н2О  НСО3– + ОН–), также имеет щелочную реакцию]. В результате поглощённые анионы вытесняются в раствор, а анионит вновь насыщается ионами ОН–.
НСО3– + ОН–), также имеет щелочную реакцию]. В результате поглощённые анионы вытесняются в раствор, а анионит вновь насыщается ионами ОН–.
Физические методы
Физические методы уменьшения жёсткости воды во многих случаях экономически более выгодны, чем химические, и более экологичны. Энергетические затраты на них в ряде случаев также незначительны. Преимущества физических методов заключаются также в их сравнительной простоте, возможности автоматизации и осуществлении непрерывной обработки значительных количеств воды.
К физическим методам умягчения воды относятся магнитная и ультразвуковая обработка воды, метод электродиализа и магнитно-ионизационный метод.
Магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. При этом происходит уменьшение степени гидратации растворённых веществ и их объединение в более крупные частицы, которые выпадают в осадок.
Ультразвуковая обработка воды так же, как и магнитная, приводит к образованию более крупных частиц растворённых веществ с образованием осадка.
При электродиализе воду заливают в электролизёр между двумя полупроницаемыми перегородками (мембранами). На электроды подаётся напряжение порядка 500 В, и в системе возникает электрический ток, вследствие чего положительно заряженные ионы металлов (катионы) перемещаются к катоду, а отрицательно заряженные ионы (анионы) к аноду. И таким образом, вода в пространстве между мембранами очищается (рис. 2).

Рис. 2. Модель простейшего электродиализатора
Очистка воды методом обратного осмоса1 заключается в следующем. При обычном осмосе с использованием полупроницаемой перегородки возникает давление в направлении от растворителя к раствору или от разбавленного раствора к более концентрированному. Если же использовать внешнее противодавление, больше осмотического, то растворитель (вода) будет продавливаться через мембрану из концентрированного раствора в разбавленный, оставляя за мембраной растворённые вещества (рис. 3).

Рис. 3. Схема очистки воды методом обратного осмоса
Магнитно-ионизационный методочистки воды заключается в том, что перед прохождением через магнитное поле вода подвергается воздействию ионизирующего излучения, способствующего увеличению степени электролитической диссоциации растворённых в ней веществ. Имевшиеся ранее и образующиеся ионы при прохождении через силовые линии постоянного магнитного поля отклоняются к полюсам магнита, в результате чего их концентрация в средней зоне между полюсами уменьшается. Отобранная из этой зоны вода является более чистой по сравнению с исходной (рис. 4).

ЛАБОРАТОРНАЯ РАБОТА № 2
Дата: 2016-10-02, просмотров: 393.