Рідина кристалізується при тієї температурі, при якій тиск насиченого пару над нею такий же, як над кристалами цієї речовини. Так як тиск насиченого пару розчинника над розчином завжди менший ніж над чистим розчинником, тоді розбавлений розчин буде кристалізуватися при більш низької температурі, ніж розчинник. Для таких розчинів Рауль знайшов, що зниження температури замерзання розчину пропорційне його моляльності:
∆t=K*b (15) де ∆t – зниження температури замерзання розчинів, яке дорівнює різності температур замерзання розчинника (t0) та розчину (t); ∆t= t0- t; b – моляльність розчину; К – константа, яка має назву молярним зниженням точки замерзання розчинника або кріоскопічній постійній. Вона чисельно дорівнює зниженню температури замерзання розчину, який містить 1 моль розчиненої речовини на 1 кг розчинника, якщо властивості розчиненого розчину зберігаються до тієї концентрації: для води Ккр = 1,86: для бензолу Ккр = 5,1; для оцтової кислоти Ккр =3,9.
Величина К залежить від природи розчинника та не залежить від природи розчиненої речовини, якщо його молекули не дисоціюють та не асоціюють.
Так як маси наважок розчиненої речовини m та розчинника L частіше мають вираз у грамах, то  , де М – молярна маса розчиненої речовини. Підставив цей вираз у формулу (15), отримаємо:
, де М – молярна маса розчиненої речовини. Підставив цей вираз у формулу (15), отримаємо:
 (16)
(16)
Це рівняння застосовується для розрахунку ∆tзам. Якщо зниження температури замерзання визначено з досліду, тоді співвідношення (16) може бути використано для розрахунків відносної молекулярної маси розчиненої речовини (кріоскопічний метод).
За допомогою цього рівняння експериментально знаходиться кріоскопічна постійна. У цьому випадку визначають ∆tзам для декількох розчинів різного складу та з розрахованих значень К враховується середня величина. Кріоскопічна постійна теоретично може бути розрахована з фізичних властивостей розчинника за допомогою формули
 (17) де R – газова постійна, яка дорівнює 8,314 Дж/(моль*К); Т0 – температура замерзання розчинника у кельвінах; lпл – удільна теплота плавлення розчинника (Дж/кг), К в К*кг/моль.
(17) де R – газова постійна, яка дорівнює 8,314 Дж/(моль*К); Т0 – температура замерзання розчинника у кельвінах; lпл – удільна теплота плавлення розчинника (Дж/кг), К в К*кг/моль.
Температура кипіння розведених розчинів
Рідина кипить при температурі, при який тиск насиченого пару рідини дорівнює атмосферному тиску. Так як тиск насиченого пару розчинів нелетучих або малолетучих речовин менший за тиск насиченого пару розчинника, то ці розчини киплять при більш високій температурі, ніж розчинник. Для розведених розчинів таких речовин Рауль установив, що збільшення температури кипіння розчину пропорційне його моляльності.
Закони зниження температури замерзання розведених розчинів та підвищення температури їх кипіння подібні, тому й формули для підвищення температури кипіння (18-20) будуть аналогічні формулам (15-17):
∆tкіп=Kе*b (18)
 (19)
(19)
 (20)
(20)
де Δt – підвищення температури кипіння розчинів, яке дорівнює різності температур кипіння розчину (t) та розчинника (t0); ∆t= t -t0; Ке –ебуліоскопічна константа. Ебуліоскопічна константа показує на скільки градусів вище кипить одномоляльний розчин неелектроліту порівняно з чистим розчинником; вона залежить тільки від природи розчинника: для води Ке = 0,52 ; для бензолу Ке = 5,5; для оцтової кислоти Ке = 16,65.
Осмотичний тиск
Вант – Гофф встановив, що осмотичний тиск розведених розчинів підлягає законам, подібним законам ідеальних газів.
Осмотичний тиск розведених розчинів чисельно дорівнює тому тиску, який би виготовляв дану кількість розчиненої речовини, якщо б воно знаходилось у газоподібному стані при заданій температурі та займало об’єм розчину (закон Вант - Гофф).
Рівняння (1,5,6,7,8,9 лабораторної роботи 1) застосовуються до розчинених розчинів, якщо в них тиск газу замінити осмотичним тиском. Наприклад, рівняння 1 має вигляд:
Pосм*V=nRT (21) де Росм – осмотичний тиск, V – об’єм розчину, n – кількість розчиненої речовини, моль, T - абсолютна температура, R - молярна газова постійна. Вставляючи у цей вираз молярну концентрацію С=  , отримуємо
, отримуємо
Pосм=cRT (22)
Рівняння 21 показує, що при постійній температурі та об’ємі осмотичний тиск залежить тільки від числа розчинених частин та не залежить від природи розчиненої речовини. Якщо осмотичний тиск визначається на досліді та знаємо температуру та концентрацію розчину, то можна розрахувати відносну молекулярну масу розчиненої речовини.
Для дуже розведених розчинів у тих випадках, коли молярну концентрацію розчину (моль/л) можно дорівняти до моляльності, з рівняння (22) та (15) отримуємо співвідношення
 (23) де Росм 1 та Росм 2 – осмотичний тиск відповідно першого та другого розчинів, ∆t1 та ∆t2 зниження температури їх замерзання.
(23) де Росм 1 та Росм 2 – осмотичний тиск відповідно першого та другого розчинів, ∆t1 та ∆t2 зниження температури їх замерзання.
Контрольні питання:
1. Які сили діють між молекулами у розчині? Яка внутрішня структура розчину?
2. Від яких факторів залежить тиск насиченого пару рідини?
3. Сформулюйте закон Рауля, напишіть його математичний вираз та поясніть вхідні у нього члени.
4. Що таке кріоскопічна постійна? Як визначається кріоскопічна постійна?
5. Що таке ебуліоскопічна постійна? Як визначається ебуліоскопічна постійна? Від яких факторів залежить її величина?
6. Що таке осмотичний тиск?
7. Які перепони мають назву напівпроникні? Наведіть приклади.
Задачі:
1. Молярна доля хлориду цинку у водному розчині дорівнює 0,0422, густина розчину дорівнює 1,238г/см3. Визначити: а) моляльність, б) молярну концентрацію розчину.
2. Тиск пару розчину, який містить анілін масою 0,425г у ефірі масою 100г, при 20 0С дорівнює 587,7 гПа. Тиск пару над чистим ефіром при цієї ж температурі дорівнює 589,7 гПа. Визначити відносну молекулярну масу аніліну.
3. Зниження температури замерзання бензолу при розчиненні у ньому камфори дорівнює 0,6260. Температура замерзання бензолу 5,5 0С, а удільна теплота плавлення його 126 Дж/г. Розрахувати відносне зниження тиску насиченого пару розчину у відсотках.
4. Розчин саліцилової кислоти у етиловому спирті кипить при температурі 78,5840С. Температура кипіння спирту дорівнює 78,30С, а удільна теплота випарювання його при цієї температурі 853,5 Дж/г. Розрахувати тиск пару над розчином при 78,30С.
5. Осмотичний тиск водного розчину гемоглобіну, який містить 32 г/л при 170С, дорівнює 4384 Па. Визначити відносну молекулярну масу гемоглобіну.
Лабораторна робота № 17.
РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Мета роботи – ознайомитися з теорією електролітичної дисоціації, теорією сильних електролітів Дебая – Гюккеля, навчитися розраховувати константу дисоціації слабких електролітів, визначати коефіцієнт активності іонів та порівнювати хімічну активність кислот, характер дисоціації гідроксидів та солей.
ТЕОРЕТИЧНА ЧАСТИНА
У попередній лабораторній роботі було показано, що відповідно до законів Рауля, такі фізичні властивості розчинів, як зниження тиску насиченої пари, підвищення температури кипіння розчинів, зниження температури замерзання розчинів, визначаються числом молів (частинок) розчинених речовин і не залежать від їх природи. Але для розчинів електролітів (солей, кислот, основ), тобто речовин, які у розплавленому стані або у розчині здатні проводити електричний струм, спостерігаються відхилення від законів Рауля. Вант-Гофф установив, що такі самі відхилення спостерігаються стосовно зниження тиску насиченої пари ∆Р та підвищення температури кипіння розчину ∆ТК. Тому для кількісного врахування всіх цих відхилень досить ввести один поправочний множник, названий ізотонічним коефіцієнтом і, який дає змогу застосовувати закони Рауля до розбавлених розчинів електролітів. Цей множник визначається із співвідношення:
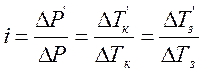 (1)
(1)
де у чисельнику - експериментальні, а у знаменнику — теоретичні значення вказаних параметрів розчину. Якщо відоме значення і, то параметри ∆Р', ∆Т'к , ∆Т'з для розчинів електролітів можна обчислити за формулами:
∆Р'= і*∆Р = і*Р0 *N(Х); (2)
∆Т'к = і*∆Тк=і*Е*b(Х); (3)
∆Т'з = і*∆Т3=і*к* b (Х). (4)
Числові значення ізотонічного коефіцієнта залежать від природи електроліту та його концентрації в розчині. Для прикладу наведемо значення і для розчинів деяких електролітів однакової моляльної концентрації, що дорівнює 0,1 моль/кг: КС1 - 1,85; Ва(ОН)2 - 2,54; Н2SО4 - 2,2; СН3СООН - 1,01; NH40Н - 1,01.
Зі зменшенням концентрації електроліту (з розбавленням розчину) значення і зростають, поступово наближаючись до цілих чисел: для розчину КС1 - до 2, для СН3СООН і NH40H - теж до 2, але дуже повільно, Ва(ОН)2 і Н2SО4 - до 3.
Аналізуючи ці дані, С.Арреніус дійшов висновку, що кількість частинок у розчині електроліту збільшується, тому що електроліти в процесі розчинення розпадаються на дрібніші заряджені частинки - іони, їх рух в електричному полі пояснює здатність електролітів проводити електричний струм. Позитивно заряджені частинки рухаються до негативного електрода — катода і називаються катіонами, а негативно заряджені частинки рухаються до позитивного електрода -анода і називаються аніонами. За своїми властивостями іони суттєво відрізняються від нейтральних атомів та молекул, з яких утворилися.
С.Арреніус з'ясував фізичний зміст ізотонічного коефіцієнта. Цей коефіцієнт показує, у скільки разів збільшується число частинок у розчинах електролітів внаслідок їх дисоціації на іони. Якби електроліти повністю розпадалися на іони, число частинок збільшилося б у ціле число разів. Так, за повної дисоціації КС1, NH40H, СН3СООН коефіцієнт і має дорівнювати двом, Н2SО4, Ва(ОН)2 - трьом і т.д. Оскільки знайдені значення і були меншими від цих чисел, Арреніус припустив, що дисоціація відбувається неповністю, тобто зворотно.
Для кількісної характеристики процесу дисоціації було введено поняття ступінь дисоціації а- відношення числа молекул, що розпалися на іони Nдис, до вихідного числа N розчинених молекул:
α=  (5)
(5)
Ступінь дисоціації можна обчислити за значенням ізотонічного коефіцієнта, який визначають, вимірюючи температури замерзання або кипіння розчину (1). Для того, щоб встановити зв'язок між цими величинами, рівняння (5) представимо у вигляді:
Nдис= α*N
Якщо під час дисоціації однієї молекули електроліту утворюється g іонів, то з α*Nтаких молекул - g α*N іонів. У розчині залишиться (N- α*N)недисоційованих молекул. Загальне число частинок розчиненої речовини (молекул та іонів) у розчині становитиме gα*N + (N- α*N). Ізотонічний коефіцієнт - це відношення загального числа частинок у розчині до числа вихідних розчинених молекул:
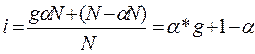 звідки:
звідки:  (6)
(6)
Для розчинів багатьох електролітів на основі експериментально визначених ∆Т'к і ∆Т'з були розраховані значення ізотонічного коефіцієнта та ступеня дисоціації. Ці значення ступенів дисоціації збігалися з величинами а, які були знайдені іншим методом - вимірюванням електропровідності розчинів. Це підтвердило положення теорії електролітичної дисоціації, розробленої Арреніусом.
Дата: 2016-10-02, просмотров: 404.