1. 1 В три склянки налийте по 1О мл 0,1 н розчинів: в першу - сірчаної
кислоти, в другу - гідроксид натрію, в третю - гідроксид амонію. Визначити електричну провідність цих розчинів.
1.2 Налийте в пробірку 1/3 її об'єму 2н. розчин сірчаної кислоти, в
іншу - таку ж кількість щавлевої кислоти. В обидві пробірки внести однакові шматочки цинку. В якій з пробірок реакція протікає більш бурхливо? .
Завдання. Напишіть молекулярні і іонні рівняння реакції. Від концентрації яких іонів в розчині залежить швидкість виділення водню. Яка кислота сильніше? Що є кількісною характеристикою кислот?
Дослід 2. Залежність активності кислот від їх концентрації.
До одної пробірки налити до 1/3 її об'єму розчин хлсроводневої кислоти, до другої - декілька крапель хлороводневої кислоти та додати до рівня першої пробірки води. Потім до двох пробірок внести однакові шматочки цинку (або мармуру). Відмітити, в якій з пробірок реакція протікає більш енергійно.
Завдання. Напишіть молекулярні та іонні рівняння реакції. Зробити висновок про залежність активності розчинів кислот від їх концентрації.
Дослід 3. Обмінні реакції в розчинах електролітів.
а) реакції, що ідуть з утворенням осаду.
В пробірку налийте розчин хлориду натрію і додайте 2-3 краплини розчину нітрату срібла. Що спостерігається при проведенні цих реакцій?
б) реакції, що йдуть з утворенням легких сполучень.
В пробірку налийте розчин карбонату натрію і додайте по краплинам хлороводневу кислоту. Що спостерігається?
в) реакції, що йдуть з утворенням малодисоціюючих речовин.
В пробірку налийте розчин ацетату натрію і додайте трохи хлороводневої кислоти. За запаху визначити речовину, що утвориться.
Завдання. Запишіть рівняння реакцій в молекулярному і іонному вигляді. Зробити висновок про умови протікання реакцій іонного обміну до кінця.
Контрольні питання:
1. Відхилення від законів Рауля, Вант – Гоффа. Ізотонічний коефіцієнт Вант - Гоффа.
2. Чому розчини електролітів виявляють зниження температури замерзання і більш підвищення температури кипіння, ніж еквімолекулярні розчини неелектролітів?
3. В чому полягає суть електролітичної дисоціації та її механізм?
4. Що називається ступенем дисоціації електроліту? Фактори від яких вона залежить.
5. В чому суть східчастої дисоціації? Що називається константою дисоціації?
6. Сильні та слабкі електроліти.
7. Закон розведення Освальда.
8. Теорія сильних електролітів Дебая – Хюккеля.
9. Теорія кислот і основ.
Задачі:
1. Складіть молекулярні рівняння реакцій, яким відповідають слідуючи іонно – молекулярні рівняння: а) SO32- + 2H+ = SO2 + H2O, б) Pb2+ + CrO42- = PbCrO4, в) HCO3- + OH- = CO32- + H2O, г) ZnOH+ + H+ = Zn2+ + H2O.
2. Константа дисоціації ціановодню (синильна кислота) дорівнює 7,9*10-10. Знайти ступінь дисоціації цієї кислоти в 0,001М розчині.
3. Східчасті константи дисоціації сірководню К1 та К2 дорівнюють відповідно 6*10-8 та 1*10-14. Розрахувати концентрації іонів H+, HS-, S2- в 0,1М розчині кислоти.
4. Розчин, який містить 0,85г хлориду цинку в 125г води кристалізується при -0,230С. Розрахувати ступінь дисоціації хлориду цинку.
5. Знайти ізотонічний коефіцієнт для 0,2М розчина електроліту, якщо відомо, що у 1 л цього розчину міститься 2,18*1023 частинок (молекул та іонів) розчиненої речовини.
Лабораторна робота № 18.
РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Мета роботи – ознайомитися з класифікацією провідників, іонним добутком води та водневим показником та властивостями буферних систем. Навчитися складати рівняння гідролізу.
ТЕОРЕТИЧНА ЧАСТИНА
Чиста вода за звичайних умов незначною мірою проводить електричний струм. Це пояснюється тим, що приблизно лише одна з 10 млн. молекул дисоціює на іони: Н2О ⇄ Н+ + ОН-; ∆Н = 57,3 кДж.
Константа дисоціації води (  ) за ст. у. (298 К) дорівнює 1,8*10-16. Цей процес є ендотермічним і зворотним до реакції нейтралізації сильної кислоти сильною основою. Внаслідок незначної дисоціації можна вважати, що концентрація недисоційованої частини (молекул Н2О) є сталою. Розрахуємо [Н2О], прийнявши до уваги, що маса 1 л води за звичайних умов близька до 1000г (точно 1000 г за 4°С):
) за ст. у. (298 К) дорівнює 1,8*10-16. Цей процес є ендотермічним і зворотним до реакції нейтралізації сильної кислоти сильною основою. Внаслідок незначної дисоціації можна вважати, що концентрація недисоційованої частини (молекул Н2О) є сталою. Розрахуємо [Н2О], прийнявши до уваги, що маса 1 л води за звичайних умов близька до 1000г (точно 1000 г за 4°С):
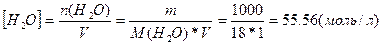
Перенесемо сталі члени у виразі константи дисоціації в ліву частину: 
Це означає, що за певної температури добуток К • [Н2О] є сталою величиною. За 298 К він дорівнює 1,8*10-16 * 55,56 = 10-14 і називається іонним добутком води Кв.
Кв = [Н+] • [ОН-] = 10-14. (1)
Кв - є сталою величиною не тільки в чистій воді, а й у розбавлених водних розчинах кислот, основ і солей, коли концентрація розчиненої речовини істотно менша від концентрації води. Умовно межею розбавлених розчинів можна вважати такі, концентрація розчиненої речовини в яких не перевищує 1 моль/л, тобто не більше 2% молярної концентрації води.
Іонний добуток залежить від температури. За нагрівання, згідно з принципом ле Шательє, посилюється процес, що йде з поглинанням теплоти, тобто процес утворення іонів. Тому іонний добуток води збільшується: при 0; 25 і 100°С його значення відповідно дорівнюють 0,13*10-14, 1*10-14 і 76*10-14.
У чистій воді та нейтральних розчинах солей і неелектролітів виконується умова: [Н+] = [ОН-]. Оскільки добуток цих величин дорівнює Кв, то: [Н+] = [ОН-] = √Кв
За температури 298 К, коли Кв =10-14, [Н+] = [ОН-] = 10-7моль/л.
У розчинах кислот [Н+] збільшується. Рівновага процесу дисоціації води зсувається так, щоб послабити зростання концентрації цих іонів, тобто в бік недисоційованих молекул води.
Тому концентрація іонів ОН- зменшується, а іонний добуток Кв залишається сталим. У кислому середовищі [Н+] > 10-7 моль/л, а [ОН-] <10-7 моль/л.
У розчинах лугів [ОН-] > 10-7 моль/л. Рівновага дисоціації води також зсувається в бік утворення молекул води і концентрація іонів Н+ зменшується. Отже, в лужних розчинах [Н+] < 10-7 моль/л, а добуток концентрацій іонів Н+ і ОН- (тобто Кв) також не змінюється.
Для характеристики кислотності середовища зручно користуватися водневим показником рН, який дорівнює від'ємному десятковому логарифму активності іонів гідрогену: рН = -lg aн+
Щодо розбавлених розчинів, можна вважати, що ан+ =[Н+], тому:
рН =- lg [Н+]. (2)
У чистій воді та в нейтральних середовищах, де [Н+] = 10-7 моль/л, рН =-lg 10-7 =7. У кислих середовищах, де [Н+] > 10-7, значення рН < 7 і в лужних середовищах, де [Н+] < 10-7 моль/л, значення рН > 7.
Таким чином, у розведених водних розчинах, коли концентрація сильної кислоти або лугу не перевищує 1 моль-екв/л, за 298 К (25°С) можна прийняти, щоу кислому середовищі значення рН змінюється в межах від 0 до 7, а в лужному від 7 до 14, виключаючи саме значення 7 (нейтральне середовище). Наведені значення рН є дещо наближеними, оскільки в розрахунках нехтували різницею між активними та аналітичними концентраціями іонів.
На практиці для визначення рН середовища використовують індикатори та спеціальні вимірювальні прилади іонометри (рН-метри).
Поряд з показником рН використовують показник рОН:
рОН = - lg [ОН-]. (3) Виходячи зі значення іонного добутку води Кв , при 295К
рН + рОН = 14 (4)
У випадках розрахунку рН розчину лугу слід скористатися наведеною схемою для обчислення рОН, а потім знайти рН:
рН = 14 – рОН
При розрахунках рН водних розчинів слабких кислот і основ слід враховувати оберненість процесу їх електролітичної дисоціації (α < 1):
СН3СОO- + Н+ = СН3СООН
Концентрація Н+ в розчинах слабких кислот і концентрація іонів ОН- в розчинах слабких основ чисельно дорівнюють концентрації продисоційованих молекул електроліту, а не вихідній концентрації розчину, як у випадку сильних кислот і основ.
При розрахунку водневого показника середовища водних розчинів сильних кислот і основ слід враховувати не оберненість процесу їх електролітичної дисоціації (α = 1).
НС1 → Н+ + СI-
Концентрація іонів Н+ в розчинах сильних кислот та концентрація іонів ОН- в розчинах лугів чисельно дорівнюють полярності розчинів.
Щоб розрахувати значення водневого або гідроксильного показників середовища, необхідно знати активність аОН- = ƒОН- - СОН-.
Гідроліз солей
Середні солі внаслідок процесу дисоціації не утворюють іонів Н+ та ОН-, тому в їхніх розчинах, як і в чистій воді, повинна виконуватись умова: [Н+] = [ОН-]. Дійсно, відомо багато солей (NaСІ, К2SО4, Ва(NО3)2 та ін.), водні розчини яких мають нейтральну реакцію. В той же час, водні розчини деяких солей (наприклад Na2СО3, К3РО4, Nа2S) мають лужну, інші (ZnSО4, Fе(NО3)3, АІС13) - кислу реакцію. Причиною цього є взаємодія солі з водою, або реакція гідролізу.
В основі всіх варіантів гідролізу лежать процеси часткового зв'язування іонів Н+ або ОН- з іонами розчиненої солі з утворенням слабких електролітів. В результаті рівновага Н2О ⇄ Н+ + ОН- зсувається вправо, що приводить до збільшення концентрації вивільнених іонів Н+ або ОН- , які не зв'язуються з іонами солі.
Розглянемо рівновагу в розчині солі сильної основи і слабкої кислотиунаприклад ацетату натрію. Розчиняючись у воді, ця сіль повністю дисоціює на іони:
СН3СООNa →СН3СОО- + Na+
Ацетат-іон (кислотний залишок слабкої оцтової кислоти) зворотно зв'язує йон Н+ води, іони Nа+ з іонами ОН- води у розчині не зв'язуються, оскільки NаОН - сильна основа, яка в розчині повністю розпадається на іони:
Na+ + CH3COO- +HOH ⇄CH3COOH + Na+ + OH-
Оскільки іони Nа+ не беруть участі в реакції, їх можна виключити з іонного рівняння гідролізу:
СН3СОО- + НОН ⇄ СН3СООН + ОН-.
У молекулярній формі це рівняння має вигляд:
СН3СООNa + Н2О ⇄СН3СООН + NaOH
Іонне рівняння краще відображає суть і причину процесу гідролізу - часткового зв'язування залишку слабкої кислоти з іонами Н+ води і те, що розчин матиме лужнуреакцію (зростання концентрації іонів ОН- , тобто рН>7). Реакція гідролізу оборотна, оскільки слабкі електроліти Н2О і СН3СООН знаходяться по різні боки від знака рівності і в розчині встановлюється динамічна рівновага.
Солі багатоосновноїслабкої кислоти і сильної основи гідролізують ступінчасто. Наприклад, в процесі гідролізу карбонату натрію кислотний залишок слабкої вугільної кислоти на першому ступені приєднує один іон Н+ з молекули води:
СО32- + НОН ⇄ НСО3- + ОН-,
на другому - до іона НСО3- , що утворився в першій стадії, приєднується другий іон Н+ води:
НСО3- + НОН ⇄Н2СО3 + ОН- .
При цьому двозарядний іон СО32- зв'язує іони Н+ води на першому ступені набагато активніше, ніж однозарядний НСО3- - на другому. Тому перший ступінь гідролізу відбувається в значно більшій мірі, ніж другий, і в багатьох випадках досить врахувати тільки цю першу стадію процесу.
Молекулярні рівняння гідролізу карбонату натрію мають вигляд:
Nа2СО3 + Н2О ⇄ NаНСО3 + NaОН (перший ступінь),
NаНСО3 + Н2О ⇄ Н2СО3 + NаОН (другий ступінь).
У розчині солі слабкої основи і сильної кислотивідбувається оборотне ступінчасте часткове зв'язування іонів ОН- води з катіоном, який утворює слабку основу. Наприклад, стадії гідролізу солі ZnС12 можна виразити такими рівняннями:
Перша стадія: Zn2+ + НОН ⇄ (ZnОН)+ + Н+;
ZnС12 + Н2О ⇄ (ZnОН)С1 + НС1.
Друга стадія: (ZnОН)+ + НОН ⇄ Zn(ОН)2 + Н+;
(ZnОН)С1 + Н2О ⇄Zn(ОН)2 + НС1.
Реакція розчину є кислою(рН < 7), оскільки утворюється надлишок іонів Н+. Як і в попередньому прикладі, перший ступінь гідролізу відбувається інтенсивніше, ніж наступні.
У розчині солі слабкої основи і слабкої кислоти іон Н+ води
зв'язується з залишком слабкої кислоти, а іон ОН- - із залишком слабкої основи. Як приклад, запишемо рівняння гідролізу солі СН3СООNН4 в іонній і молекулярній формах:
СН8СОO- + NH4 + + HOH ⇄ CH3COOH + NH4OH
СН8СОONH4 + HOH ⇄ CH3COOH + NH4OH
Оцтова кислота СН3СООН і основа NН4ОН - слабкі електроліти, константи дисоціації яких майже однакові. Тому їх залишки СН3СОО- та NH4 + приблизно в однаковій мірі зв'язують іони Н+ та ОН- води і в розчині цієї солі значення рН практично дорівнює семи (рН = 7). Але гідроліз відбувається в значній мірі, оскільки і аніон, і катіон солі беруть участь у процесі гідролізу.
Деякі солі слабкої кислоти і слабкої основи зазнають повного (необоротного і неступінчастого) гідролізу. Так, внаслідок гідролізу А12S3 утворюється слабка нерозчинна основа А1(0Н)3 і слабка кислота Н2S, частина якої переходить в газову фазу:
А12S3 + 6Н2О = 2А1(ОН)3↓ + ЗН2S↑.
Все це приводить до того, що рівновага цієї реакції практично повністю зміщується в бік продуктів гідролізу. Через гідроліз спроби добути подібні солі "мокрим способом" (у розчині) закінчуються утворенням продуктів гідролізу.
У розчині солі сильної кислоти і сильної основи, наприклад NаСІ, ні катіон, ні аніон не зв'язуються з іонами Н+ та ОН- води. Отже, процес гідролізу не відбувається.
Стан рівноваги реакції гідролізу характеризується ступенем гідролізуβ, що дорівнює відношенню концентрації тієї частини солі, яка вступила в реакцію гідролізу Сгідр, до загальної концентрації розчиненої солі (С):
 (5)
(5)
Ступінь гідролізу залежить насамперед від природи розчиненої солі: чим слабкіші кислота і основа, що утворили сіль, тим сильніше відбувається зв'язування іонів Н+ і ОН- з відповідними іонами солі і тим вищий ступінь гідролізу β.
З підвищенням температуриендотермічний процес дисоціації води посилюється, рівновага зміщується в бік утворення іонів Н+ і ОН-. Збільшення концентрації іонів, що утворюються внаслідок дисоціації води, посилює процеси зв'язування їх з катіонами або аніонами солі, і ступінь гідролізу β зростає.
Якщо в розчині солі, що зазнала гідролізу, підвищити концентрацію одного з продуктів реакції, то рівновага гідролізу, за принципом ле Шательє, зміститься в бік вихідної солі і ступінь гідролізу зменшиться. Наприклад, якщо до розчину ацетату натрію додати гідроксид натрію, концентрація іона ОН- збільшиться; рівновага гідролізу цієї солі (див. наведене вище рівняння гідролізу) зміститься таким чином, щоб послабити збільшення концентрації цих іонів, тобто в бік вихідних речовин, і ступінь гідролізу зменшиться.
Від розбавленняводою кількість частинок розчиненої речовини в одиниці об'єму зменшується і рівновага гідролізу зміщується в такому напрямі, щоб послабити зменшення кількості частинок розчиненої речовини. Якщо під час гідролізу з одного іона розчиненої солі утворюються дві частинки розчиненої речовини (див. іонні рівняння гідролізу ацетату натрію, карбонату натрію, хлориду цинку), то рівновага таких реакцій зсувається в бік утворення продуктів (більшого числа частинок) і ступінь гідролізу зростає. При перебігу гідролізу солі слабкої основи і слабкої кислоти число частинок розчиненої речовини у розчині не змінюється (див. рівняння гідролізу ацетату амонію), тому рівновага гідролізу від розбавлення не зміщується.
Контрольні питання:
1. Дисоціація води. Що називають іонним добутком води?
2. Поняття про водневий (рН) та гідроксильний (рОН) показники.
3. Поняття про буферні розчини.
4. Буферна ємність.
5. Гідроліз солей.
Задачі:
1. Розрахуйте рН розчину, що містить 0,001 моль/л гідроксиду барію.
2. Концентрація іонів водню у розчині дорівнює 4*10-3 моль/л. Обчислити рН розчину.
3. Обчислити концентрацію іонів водню у розчині, рН якого дорівнює 4,60.
4. Обчислити концентрацію НСО3 - та СО3 2- у 0,01М розчині вугільної кислоти, якщо рН цього розчину дорівнює 4,18.
5. Обчислити ступінь гідролізу ацетату калію у 0,1М розчині та рН розчину.
Лабораторна робота № 19.
Дата: 2016-10-02, просмотров: 303.