Мета роботи – повторити матеріал середньої школи та навчитися вирішувати завдання за рівнянням стану ідеального газу.
ТЕОРЕТИЧНА ЧАСТИНА
Хімія належить до числа природничих наук, що вивчають світ, який нас оточує, з усіма проявами його різноманітних форм і явищ.
Хімія як фундаментальна наука бере участь у вирішенні величезного числа різноманітних професійних задач. Вона тісно пов’язана практично з усіма виявами людських контактів з матеріальним світом, і тому в сучасний період хімія перетворилася в невід’ємну частину загальнолюдської культури. Вона тісно пов’язана з організацією побуту людини. Її витвори у вигляді різноманітних речей, виробів, матеріалів використовуються у нашому повсякденному житті.
Фізколоїдна хімія – це теоретичні основи хімії. Вперше зародилася в 1752 – 1754 році в Росії з робот Ломоносова М.В. „Введение в истинную химию”. У 1864 році курс фізичної хімії почали читати в Харківському університеті.
Головні розділи фізколоїдної хімії:
- будова речовини;
- термодинаміка;
- розчини молекулярні та електролітів;
- рівновага;
- кінетика;
- електрохімія;
- колоїдна хімія.
Методичні вказівки складені у відповідності до програми з фізколоїдної хімії для підготовки бакалаврів в аграрних вищих навчальних закладах Ⅱ - Ⅳ рівнів акредитації з спеціальності „Агрономія”.
За звичайних умов атоми, молекули і іони найчастіше існують у вигляді більш високої організації речовин, яка називається агрегатним станом. Залежно від відстані між частинками і енергій їх взаємодії речовини можуть існувати у газовому, рідкому або твердому стані. Твердий і рідкий стан об’єднують під загальною назвою конденсований.
Газовий станхарактеризується тим, що відстані між молекулами набагато перевищують їхні розміри. Середня кінетична енергія молекул значно більша від середньої потенційної енергії притягання між ними (Екін >> Епот). Сили взаємодії частинок газу є недостатніми для утримання їх одна біля одної, тому всі гази можуть змінювати форму та об’єм. За відносно низького тиску й не дуже низьких температур можна знехтувати силами міжмолекулярної взаємодії. У цих умовах гази поводять себе однаково, підлягаючи законам ідеальних газів. При зростанні тиску і зменшенні температури відстані між молекулами газу зменшуються, збільшується енергія міжмолекулярної взаємодії, тому зростають відхилення від законів ідеальних газів.
Рідкий станвиникає внаслідок конденсації газів або плавлення твердих речовин. Цей стан можна характеризувати приблизною відповідністю середніх значень кінетичної і потенційної енергій частинок (Екін ≈ Епот). Сили взаємодії частинок є достатніми, щоб перешкодити їх безладному рухові, але недостатні для припинення переміщення частинок одна відносно одної. Подібно до твердих речовин рідини мають певну структуру, яка все ж поширюється лише на найближче оточення даної частинки, тобто структура рідини має „ближній” порядок. Наприклад, структура рідкої води подібна до структури льоду, але, на відміну від нього, тетраедричне оточення молекул рухоме й може просторово змінюватися.
Часто рідини застосовують як розчинники. Молекули рідин можуть бути полярними або неполярними. Здебільшого в рідинах, які складаються з полярних молекул, добре розчиняються інші полярні речовини, а також іонні сполуки; в таких розчинах зазвичай відбуваються процеси дисоціації з утворенням іонів. Прикладами таких розчинників є вода, рідкий аміак, деякі спирти та ін. Навпаки, у рідинах, що складаються з неполярних молекул (ССІ4, бензол, етер), краще розчиняються неполярні речовини, процеси іонізації у цих випадках набагато менш характерні.
Твердий станнасамперед характеризується тим, що в ньому між’ядерні відстані близькі до розмірів самих частинок, а середня потенційна енергія протягування між ними значно більша за їхню середню кінетичну енергію (Епот>> Е кін). Сили, що діють між ними, утримують частинки у стані рівноваги, за рахунок чого тверді речовини мають певні просторові форми.
Тверді речовини можуть бути кристалічними або аморфними.
Стан даної маси газу визначається за трьома параметрами: тиску Р, об’ємі V та температурі Т. Ці величини зв’язані між собою функціональною залежністю, яка може бути представлена співвідношенням f (P, V, T) = 0 та має назву рівняння стану. Рівняння стану ідеального газу витікає з трьох законів – Бойля – Маріотта, Гей – Люссака та Авогадро.
Закон Бойля – Маріотта:при постійній температурі об’єм даної маси газу зворотньо пропорцієн тиску. Якщо  V1 та V2 – об’єми газу при тиску Р1 та Р2 відповідно, тоді
V1 та V2 – об’єми газу при тиску Р1 та Р2 відповідно, тоді
 , (1)
, (1)
або


 V1* Р1 = V2* Р2 або V* Р = const.
V1* Р1 = V2* Р2 або V* Р = const.
Закони Гей – Люсака та Шарля:при постійному тиску зі збільшенням температури на 10С об’єм даної маси газу збільшується на 1/273,15 його об’єму при 00С:
V = V0  , (2)
, (2)
де V – об’єм газу при температурі t0C, а V0 – об’єм газу при 00С.
При зміні шкали Цельсію абсолютною температурною шкалою (шкалою Кельвіну), для якої Т=273,15+ t, цей закон можна сформулювати слідуючим образом: при постійному тиску об’єм даної маси газу пропорцієн його абсолютній температурі:
 , (3)
, (3)
де  V1 та V2 - об’єми газу при абсолютних температурах Т1 та Т2 відповідно.
V1 та V2 - об’єми газу при абсолютних температурах Т1 та Т2 відповідно.
При постійному об’ємі залежність тиску даної маси газу від температури записується рівняннями, аналогічними (2) та (3):
Р = Р0  ; (4)
; (4)
 (5)
(5)
Об’єднаний закон Бойля – Маріотта – Гей – Люсака можемо описати рівнянням:
 (6)
(6)
де Р1 – тиск та V1 – об’єм даної маси газу при абсолютній температурі Т1, а Р2 – тиск та V2 - об’єм той же маси газу при абсолютній температурі Т2.
Закон Авагадро:у рівних об’ємах різних газів при однакових умовах міститься рівне число молекул.
Число молекул (NA) в одному молі речовини однаково для всіх речовин та NA =6,02*1023 (число Авагадро). Отож, молі речовин, які знаходяться у газоподібному стані при однаковій температурі та однаковому тиску, займають рівні об’єми. При нормальних умовах (температура 00С та тиск 1атм = 760 мм рт ст. = 1,01325*105 н/м2) об’єм одного молю газу дорівнює 22,414л2.
Рівняння стану ідеального газу – рівняння Менделєєва – Клапейрона для одного молю газу має вигляд:
Рυ = RT, (7)
а для любого числа n моль газу : PV=nRT, (8)
де R – універсальна газова постійна, чисельне значення якої залежить від одиниць виміру інших величин. Величина її визначається в одиницях: енергія/моль*град або енергія/кмоль*град.
Рівняння (8) може бути використано для визначення молекулярної маси. Замінюючи у ньому величину n відношенням m/M, де m – маса газу, а М – маса одного молю даного газу, та вирішуючи його відносно М, отримуємо:
 , (9)
, (9)
Молекулярна маса чисельно дорівнює отриманій величині.
Закон Дальтона:загальний тиск суміші газів дорівнює сумі парціальних тисків складових частин (компонентів):
Р = р1 + р2 + ... +рk, (10)
де Р – загальний тиск суміші газів, р1, р2, рk – парціальні тиски компонентів суміші. Парціальним тиском єтиск кожного компоненту, якщо б він займав об’єм, рівний об’єму суміші при тій же температурі.
Рівняння (8) та (9) застосовуються до суміші газів, хімічно не взаємодіючи один з одним, а також до кожного компоненту суміші. У першому випадку n – загальне число молей, яке дорівнює сумі молей компонентів (n = n1 + n2 + ... + nk = ∑ nі, де і = 1, 2, ...,k), М – середня „змішана” молекулярна маса; в другому випадку n – число молей кожного компоненту, тобто n1, n2, або nk , р – парціальний тиск компоненту, V – загальний об’єм суміші.
Залежність між парціальними тисками та загальним має вираз:
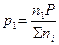 ,
, 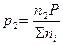 , ...,
, ...,  . (11а)
. (11а)
Співвідношення n1/ ∑nі , n2/ ∑nі , ..., nk/ ∑nі мають назву мольні або молярні долі даного компоненту. Якщо мольну долю візьмемо за N, то парціальний тиск любого і- го компонента суміші (де і = 1, 2, ..., k) буде дорівнювати:
pi = NiP. (11б)
Таким чином, парціальний тиск кожного компонент дорівнює добутку його мольній долі до загального тиску суміші.
Для ідеальних газів мольна доля N дорівнює об’ємній долі φ (υ1/ ∑υі , υ2/ ∑υі , ..., υk/ ∑υі). Якщо склад суміші має вираз у об’ємних відсотках q, то
q1/100 = N1, q2/100 = N2, ..., qk/100 = Nk, (12)
Кінетична теорія газів.Загальним рівнянням кінетичної теорії газів для одного молю є рівняння:
 (13)
(13)
де m – маса молекули, ū – середня квадратична швидкість молекул, NА – число молекул в одному молі. Для будь – якої кількості речовини в рівняннях замість NА входить N.
З загального рівняння кінетичної теорії газів можна вивести викладені вище газові закони та деякі нові положення.
Зіставляючи рівняння (7) та (13), отримуємо для одного молю газу:
 (14)
(14)
1. Звідси знаходимо середню квадратичну швидкість молекул:
 , (15)
, (15)
де М= NАm – маса одного молю газу.
З цього рівняння слідує, що для одного й того ж газу середня квадратична швидкість молекул прямо пропорційна кореню квадратному з абсолютної температури:
 , (16)
, (16)
де  - середня квадратична швидкість при температурі Т1, а
- середня квадратична швидкість при температурі Т1, а 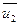 - теж саме при Т2.
- теж саме при Т2.
Для різноманітних газів при однаковій температурі середня квадратична швидкість молекул зворотньо пропорційна кореню квадратному з молекулярних мас:
 , (17)
, (17)
У цьому рівнянні  та М1 відносяться до першого газу, а
та М1 відносяться до першого газу, а 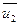 та М2 – до другого.
та М2 – до другого.
2. З рівняння (14) знаходимо:
 . (18)
. (18)
Вираз, який знаходиться у лівій частині цього рівняння, є середня кінетична енергія поступового руху молекул одного молю ідеального газу. Позначивши її через Е, отримаємо:
 (19)
(19)
Поділивши обидві частини рівняння (18) на NА, знайдемо, що середня кінетична енергія поступового руху однієї молекули газу дорівнює:
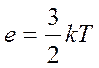 , (20)
, (20)
де  , а
, а  - константа, яка має назву постійної Больцмана.
- константа, яка має назву постійної Больцмана.
Тобто, кінетична енергія ідеального газу пропорційна абсолютній температурі.
Контрольні питання:
1. Який газ називають ідеальним? Виведіть рівняння стану ідеального газу.
2. Сформулюйте закон Дальтона. Який зв’язок між парціальним тиском компоненту та загальним тиском суміші?
3. Що таке критична температура, критичний тиск, критичний об’єм? Як визначаються ці величини?
4. З головного рівняння кінетичної теорії газів виведіть газові закони?
5. Дайте загальну характеристику рідкого стану. Яка структура рідини? Які сили діють у рідинах?
6. Які види твердих сполук відомі? Надайте характеристику властивостей твердої речовини. Яка найбільш загальна ознака присуща кришталевим речовинам?
7. У чому полягає схожість та різність між рідкими та твердими речовинами?
Задачі:
1. За методом В. Майера визначалась молекулярна маса етилового ефіру. При випарюванні 0,0856 г ефіру його пари витиснули у евдіометричну трубку 29,2 мл повітря; висота водяного стовпу у евдіометричній трубці 22,5 см, температура повітря 170С, атмосферний тиск 754 мм рт ст. Тиск насиченого пару води при 170С дорівнює 14,53 мм рт ст. Визначити молекулярну масу ефіру та знайти відносну помилку досліду у відсотках.
2. Змішано 3 л водню під тиском 2*105 Па з 2 л кисню під тиском в 1*105 Па. Загальний об’єм суміші дорівнює 4л. Визначити парціальний тиск газів та загальний тиск суміші.
3. Суміш з двох молей азоту, трьох молей кисню та деякої кількості аміаку при 200С та тиску 4*105 Па займає об’єм 40 дм3. Визначити число молей аміаку у суміші та парціальний тиск кожного з газів.
4. Водень (0,5 моль) та 0,25 моль азоту знаходяться у газометрі ємністю 5 л при 100С. Визначити парціальний тиск кожного з газів та склад суміші у об’ємних відсотках.
5. Визначити тиск кисню при 00С, якщо у 10 л знаходиться 0,25 моль його. Середня квадратична швидкість молекул кисню при цій температурі дорівнює 461 м/сек.
6. При якій температурі середня квадратична швидкість молекул хлору буде дорівнювати 500 м/сек?
Лабораторна робота № 16.
РОЗЧИНИ НЕЕЛЕКТРОЛІТІВ
Мета роботи – ознайомитися із впливом концентрації розчинів неелектролітів на зниження температури їх замерзання та підвищення їх температури кипіння.
ТЕОРЕТИЧНА ЧАСТИНА
Дата: 2016-10-02, просмотров: 424.