Мета роботи – ознайомити студентів з найбільш важливими фізичними та хімічними властивостями d-елементів, а також із застосуванням їх важливіших сполук.
ТЕОРЕТИЧНА ЧАСТИНА
VIВ групу періодичної системи утворюють перехідні метали: хром, молібден, вольфрам. В їх атомах добудовуються d-підрівні передостаннього рівню. При цьому у атомів хрому та молібдену електронна конфігурація d5s1, а у атому вольфраму d4s2. Хімічний зв’язок цих елементів здійснюється за рахунок втрачання s-електронів зовнішнього рівню та d-електронів передостаннього. Максимальний ступень окислення у всіх металів цієї групи +6, проте стійки також сполуки хрому, в яких його ступень окислення +2, +3. для молібдену та вольфраму характерні ступені окислення +4, +6. Атомні та особливо іонні радіуси молібдену і вольфраму близькі в зв’язку з лантаноїдним стягуванням. Тому молібден і вольфрам подібні за фізичними і хімічними властивостями, Але істотно різняться з хромом.
VIІ В групу періодичної системи утворюють Манган, технецій і реній. Атоми їх елементів мають електронну конфігурацію d5s2, орбіталі d-підрівня мають по одному неспареному електрону. В утворенні хімічного зв’язку можуть приймати участь всі валентні електрони, тому виший ступень окислення +7. Для Мангану малохарактерні сполуки, де він проявляє ступень окислення +1, +5. Відновна активність металів VIІ В групи знижується від Мангану до ренію.
Ферум, Кобальт і Нікол – елементи першої тріади VIIIВ групи називають родиною Феруму. Атоми цих елементів на зовнішньому енергетичному рівні мають два s-електрони та відповідно 6, 7, 8 d-електронів. У збудженому стані один s-електрон атома Феруму переходить на р-підрівень в результаті чого максимальний ступень окислення Феруму +6, для кобальту - +5, для Ніколу - +4. Проте, в найбільш стійких сполуках елементів родини Феруму вони проявляють ступені окислення +2, +3.
До ІВ групи періодичної системи входять Купрум, Аргентум та Аурум. Атоми їх елементів мають електронну конфігурацію d10s1, більш стійку, ніж d9s2. подібно елементам ІА групи Купрум, срібло та золото мають один s-електрон на зовнішньому рівні, проте дуже мало сходні з лужними металами. Наявність d електронів, а також значно менші радіуси атомів приводять до різкої зміни властивостей цих елементів порівняно з лужними металами. Не зважаючи на те, що d-підрівень заповнений до кінця, він ще не зовсім стабільний. Від нього можуть відриватися два електрони. Ось чому ці елементи можуть проявляти ступені окислення від +1 до +3. в дійсності для Купруму найбільш характерний ступень окислення +2, для аргентуму +1, для ауруму +3.
Метали ІВ групи за звичайних температур стійкі до дії повітря і води. З Гідрогеном і Нітрогеном вони безпосередньо не взаємодіють. В ряду напруг металів вони стоять після Гідрогену, тому не витискують його з розчинів кислот. Купрум та срібло розчиняються у концентрованій сірчаній кислоті при нагріванні, а також в нітратній кислоті любої концентрації. Аурум розчиняється в „царській горілки” – суміш концентрованих нітратної і хлороводневої кислот (1:4) з утворенням H[AuCl4].
До ІІВ групи періодичної системи входять Цинк, Кадмій та Ртуть, які закінчують декаду d елементів 4-го, 5-го, 6-го періодів. Атоми їх елементів мають електронну конфігурацію d10s2. Передостанній електронний рівень атомів Цинку, Кадмію та Ртуті на відміну від атомів І-В групи стабільний та електронів не віддає. Тому, в утворенні хімічного зв’язку приймають участь лише s-електрони. Цинк, Кадмій і Ртуть можуть у сполуках проявляти ступень окислення +2, але для Ртуті формально можливий і ступень окислення +1.
Від Цинку до ртуті зростає густина та атомні об’єми, знижуються температури плавлення і кипіння. Відновна активність цих елементів слабкіша за елементи ІІА групи і згасає при переході від Цинку до Ртуті.
Всі метали ІІВ групи за звичайних температур стійкі на повітрі і не взаємодіють з водою. У вологому повітрі Цинк вкривається захисною плівкою основної солі ZnCO3*3Zn(OH)2. Цинк та Кадмій розчиняються у розведених кислотах з виділенням Гідрогену.
Всі метали, за виключенням ртуті, у звичайних умовах є твердими речовинами. У компактному стані вони мають характерний блиск, а у подрібненому (порошкоподібному) стані всі мають чорний або темно-сірий колір.
Метали мають добру пластичність, тобто вони добре деформуються (особливо під впливом високої температури); більшість їх прокатуються у дріт, куються, штампуються, пресуються. Найбільш пластичними є золото, срібло, мідь. З 1г золота можна витягнути дріт довжиною 3км або виробити “золоту” фольгу товщиною 0,0001мм.
Найбільшу електропровідність і теплопровідність має срібло, потім йдуть мідь, золото; найменшу – мають свинець і ртуть.
Під час нагрівання металів їх електропровідність зменшується, а при охолодженні – зростає; біля абсолютного нуля вона прямує до нескінченності – явище надпровідності.
Метали дуже відмінні один від одного за твердістю. Найм’якіші– індій; найтвердіший – хром, який за твердістю наближається до алмазу.
Метали розподіляються на легкоплавкі і тугоплавкі. Температура плавлення найменш тугоплавкого цезію дорівнює 28,50С, а найбільш тугоплавкого вольфраму 33800С.
У металургії залізо та його сплави, марганець і хром називаються чорними металами, решта – кольорові метали. У свою чергу кольорові метали за різними ознаками поділяються на підгрупи: важкі (Cu, Zn, Pb, Hg), легкі (K, Na, Mg, AI), рідкісні (Li, Rb, Cs, Be, Mo, W, Zr, Hf, V, Nb, Ta), рідкісноземельні (Se, V, La і лантаноїди), розсіяні (Ga, In, Te, Ge), благородні (Au, Hg, Pt, Pd, Rh, Ir, Ru, Os) і радіоактивні (Ra, Th, U, Ac і актиноїди).
ХІМІЧНІ ВЛАСТИВОСТІ.
Найхарактерніша хімічна властивість всіх металів – їх відновна активність, тобто здатність атомів легко віддавати валентні електрони і перетворюватися у позитивні іони.
Здатність віддавати електрони у металів неоднакова. Чим легше метал віддає електрони, тим активніше і більш енергійно він взаємодіє з неметалами та іонами інших металів.
За ознакою активності всі метали розташовуються у ряді, що називається радом активності або рядом напруги.
Li, Ca, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, W, H2,Cu, Ag, Hg, Au
У ряді напруги стоїть також водень, який віддає електрони і утворює позитивно заряджений іон, тобто поводить себе як метал.
З ряду напруги можна зробити три основних висновки, щодо хімічної активності металів:
1. Всі метали, що розташовані лівіше за водень, витискують (відновлюють) його з кислот.
Концентрована сірчана кислота взаємодіє майже із всіма металами незалежно від їх розташування у ряді напруги, але водень при цьому не виділяється. Продукт, до якого відновлюється кислота, залежить від відновної активності металу. Наприклад, при взаємодії з міддю – відновлюється до диоксиду сірки (ІV) SO2, з цинком – до вільної сірки, з кальцієм – до сірководню.
Специфічно взаємодіє з металами азотна кислота HNO3. Навіть її розведені водні розчини окислюють метали без виділення водню. Продукт відновлення нітрат-іона залежить і від концентрації азотної кислоти і від активності металу, що з нею взаємодіє.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
2. Кожний метал витискує (відновлює) з солей інші метали, розташовані у ряді напруги правіше від нього і може відновлюватися металами, які розташовані лівіше.
3. Чим лівіше у ряді напруги розташовується метал, тим він більш активний і кращий відновник.
ПРАКТИЧНА ЧАСТИНА
ДОСЛІД 1. Отримання та властивості гідроксиду Хрому (ІІІ)
В дві пробірки налити 4-5 крапель сульфату Хрому (ІІІ) і додати по краплям гідроксид Натрію до випадіння осаду сіро-зеленого кольору. Для визначення властивостей гідроксиду Хрому (ІІІ) додати по краплям: до першої пробірки – розчин хлороводневої кислоти, до другої – гідроксид Натрію до повного розчинення осадів.
Завдання. Скласти рівняння реакції утворення гідроксиду Хрому (ІІІ) та його взаємодії з кислотою та лугом. Зробити висновок про кислотно-основні властивості гідроксиду Хрому (ІІІ).
ДОСЛІД 2. Перехід хроматів у дихромати та навпаки
До розчину дихромату Калію додати декілька крапель розчину гідроксиду Калію. Спостерігати зміну забарвлення розчину. До утвореного розчину хромату додати декілька крапель розчину сірчаної кислоти. Відмітити зміну кольору розчину.
Завдання. Скласти рівняння окисно-відновних реакцій переходу дихромату до хромату та навпаки. Зробити висновок про стійкість хроматів та дихроматів в залежності від реакції середовища.
ДОСЛІД 3. Отримання та дослідження властивостей гідроксиду Мангану (ІІ)
До двох пробірок внести 5-7 крапель розчину сульфату Мангану (ІІ) і 4-5 крапель розчину гідроксиду Натрію. Відмітити колір осаду. Вміст першої пробірки перемішати скляною паличкою до зміни забарвлення, а до вмісту другої прилити розчин хлороводневої кислоти до розчинення осаду.
Завдання. Скласти рівняння реакції. Зробити висновок про властивості гідроксиду Мангану (ІІ).
ДОСЛІД 4. Окисні властивості сполук Мангану (VІІ)
В пробірку внести декілька крапель розчину перманганату Калію та розчину сірчаної кислоти і по краплям додавати розчин йодиду Калію до знебарвлення розчину. Визначити вільний йод за допомогою йод-крохмальної реакції.
Завдання. Скласти рівняння реакції, якщо Mn7+ переходить до Mn2+.
ДОСЛІД 5. Якісні реакції на іони Феруму (ІІ) та (ІІІ)
1.1. До розчину сульфату Феруму (ІІ) додати 1 краплю розчину гексаціаноферату (ІІІ) Калію. Відмітити забарвлення осаду (турнбулеву синька).
1.2. До пробірки внести 3-4 краплі розчину хлориду Феруму (ІІІ) і додати 1 краплю розчину гексаціаноферату (ІІ) Калію. Звернути увагу на забарвлення осаду берлінської блакиті.
1.3. Внести до пробірки 8-10 крапель розчину хлориду Феруму (ІІІ) і 1 краплю розчину роданіду Калію або амонію. Відмітити забарвлення розчину, що утворився.
Завдання. Скласти рівняння реакції в молекулярному та іонно-молекулярному вигляді. Зробити висновок про якісні реактиви на іони Феруму (ІІ) та (ІІІ).
ДОСЛІД 6. Отримання гідроксидів Феруму (ІІ) та (ІІІ)
6.1. В дві пробірки внести по 5-7 крапель розчину сульфату Феруму (ІІ) і додати декілька крапель розчину гідроксиду Натрію. Відмітити забарвлення осадів. До першої пробірки прилити – хлороводневу кислоту, вміст другої – перемішати скляною паличкою до зміни забарвлення.
6.2. До 5-7 крапель хлориду Феруму (ІІІ) по краплям прилити розчин гідроксиду Натрію. Відмітити колір осаду. Додати розчин сірчаної кислоти до розчинення осаду.
Завдання. Скласти рівняння реакцій, що відбуваються. Зробити висновок про властивості гідроксидів Феруму (ІІ) та (ІІІ).
ДОСЛІД 7. Отримання та дослідження властивостей гідроксиду Купруму (ІІ)
В три пробірки налити 5-7 крапель сульфату Купруму і додати в усі пробірки розчин гідроксиду Натрію до випадіння осаду. Потім додати при перемішуванні до повного розчинення осадів: до першої – розчин хлороводневої кислоти, до другої – розчин аміаку. Вміст третьої пробірки нагріти до кипіння та відмітити зміну забарвлення.
Завдання. Скласти рівняння реакцій в молекулярному та іонно-молекулярному вигляді. Зробити висновок про властивості гідроксиду Купруму (ІІ).
ДОСЛІД 8. Отримання амінокомплексу Купруму (ІІ)
В пробірку налити 5-7 крапель сульфату Купруму і по краплях додати розчин аміаку до повного розчинення осаду основної солі, що випадає спочатку. Відмітити забарвлення розчину.
Завдання. Скласти рівняння реакції в молекулярному та іонно-молекулярному вигляді, якщо утворюється сульфат тетраамінкупруму (ІІ). Зробити висновок про здатність іону Купруму до комплексоутворення.
ДОСЛІД 9. Комплексні сполуки Цинку
До пробірки внести 5-6 крапель розчину сульфату Цинку та по краплях додати розчин гідроксиду амонію до утворення осаду, а потім до повного його розчинення.
Завдання. Скласти рівняння реакції утворення комплексної сполуки Цинку, якщо координаційне число 4.
ДОСЛІД 10. Якісні реакції на Hg2+ та [Hg2]2+
10.1. До пробірки налити декілька крапель розчину нітрату Ртуті (ІІ) та по краплях додати розчин гідроксиду Амонію до утворення білого осаду нітрату меркурамонію.
10.2. До пробірки налити декілька крапель розчину нітрату Ртуті (І) та по краплях додати розчин гідроксиду Амонію до утворення спочатку білого осаду, який забарвлюється у чорний колір металічної Ртуті.
2Hg2(NO3)2 + 4NH3 + H2O = [Hg2ONH2]NO3+ 2Hg + 3NH4NO3
[Hg2ONH2]NO3 = [HgONH2]NO3 + Hg
Завдання. Записати рівняння якісної реакції з утворенням комплексної сполуки Ртуті.
КОНТРОЛЬНІ ПИТАННЯ
1. Напишіть електронні формули атомів Хрому та Молібдену.
2. Які ступені окислення властиві для хрому, молібдену і вольфраму?
3. Вкажіть, яка з кислот – H2CrO4, H2MoO4, H2WO4 є найбільш сильною?
4. Як змінюються кислотно-основні властивості оксидів в ряду: CrO, Cr2O3, CrO3?
5. Які продукти практично утворюються при гідролізі сульфату і сульфіду Хрому? Напишіть рівняння реакцій. Що слід додати до розчину сульфату Хрому, щоб послабити гідроліз цієї солі?
6. Як отримати з оксиду Хрому (ІІІ) хроміт Калію та хромат Калію?
7. Чому не можна змішувати оксид Хрому (VI) з спиртом?
8. Вкажіть область використання Хрому, оксиду Хрому (ІІІ), солей Хрому.
9. Напишіть електронні формули атомів Мангану, технецію і ренію.
10. Які ступені окислення властиві для Мангану?
11. Пояснити, чому Манган розчиняється в воді у присутності хлориду амонію?
12. Як змінюються кислотно-основні властивості оксидів в ряду: MnО – Mn2O3 – MnO2 – MnO3 – Mn2O7?
13. Які сполуки Мангану можливо використовувати для отримання Хлору з хлоридів? Відповідь підтвердити відповідними рівняннями реакцій.
14. Розрахуйте коефіцієнти, визначте окисника та відновника в реакції:
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O
1. Напишіть електронні формули атомів Феруму, Кобальту і Ніколу.
2. Які ступені окислення найбільш характерні для Феруму?
3. Як Ферум, Кобальт і Нікол відносяться до концентрованих та розведених кислот (Хлороводневій, сірчаній, нітратній)? Чи впливає температура на цю взаємодію?
4. Як з металічного Феруму отримати сульфат Феруму (ІІ) та сульфат Феруму (ІІІ)? Скласти рівняння реакцій.
5. Як змінюються окисно-відновні властивості іонів в ряду: Fe2+ - Со2+- Ni2+?
6. Які сполуки називають ферітами і фератами? Навести приклади.
7. Чому при приготуванні водних розчинів солей Феруму (ІІІ) додають кислоту?
8. Здійснити перетворення:
Ni → NiO → NiSO4 → Ni(OH)2 → Ni(OH)3 → NiCl2
15. В чому подібність та різниця у будові атомів елементів підгрупи Купруму від лужних металів?
16. Чим пояснити появу зеленого нальоту на виробах з Купруму при тривалому контакті з атмосферним повітрям? Підтвердить рівнянням реакції.
17. Складіть рівняння реакції розчинення Купруму і Аргентуму у концентрованій сірчаній кислоті при нагріванні.
18. Яка речовина випадає в осад при зливанні гарячих розчинів нітрату Купруму (ІІ) і гідроксиду Калію?
19. Здійсніть перетворення:
Cu → Cu(NO3)2 → Cu(OH)2 → CuSO4 → (CuOH)2SO4
20. Вкажіть окисника і відновника в реакції взаємодії оксиду Аргентуму з пероксидом Гідрогену, якщо при цьому відбувається виділення газоподібного Оксигену? Написати рівняння реакції.
21. Які процеси відбуваються при електролізі розчинів сульфату Купруму з мідними та з платиновими електродами?
22. Написати електронні формули атомів Цинку і Кадмію. Який з цих елементів володіє більш виразними металічними властивостями?
23. На основі будови атомів пояснити, в чому полягає подібність та різниця хімічних властивостей металів головної та побічної підгруп ІІ групи періодичної системи?
24. Який з гідроксидів Цинку чи Кадмію повинен проявляти більш основні властивості?
25. За допомогою яких реакцій можливо відрізнити іони, що знаходяться у розчині: а) Zn2+ та Cd2+, б) Hg2+ та Hg22+? Написати рівняння відповідних реакцій.
26. Написати рівняння реакцій взаємодії хлоридів Цинку та Кадмію з розчином аміаку.
27. Що відбудеться, якщо розчин нітрату Ртуті (ІІ) обробити надлишком йодиду Калію? Написати рівняння реакції.
28. Здійснити наступні перетворення:
Zn → ZnO → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4]
29. Металічна ртуть часто містить домішки „неблагородних” металів – Цинку, Стануму, Плюмбуму. Для їх видалення Ртуть обробляють розчином Hg(NO3)2. на чому заснований такий засіб очищення Ртуті?
Задачі
1. Визначити масу осаду, що утворюється при зливанні розчинів, які містять по 16,2 г хромату Натрію та хлориду Барію.
2. Який об’єм сірководню (за н.у.) необхідно пропустити для знебарвлення 200мл 0.1 М розчину перманганату Калію?
3. Яка маса перманганату Калію потрібна для окислення 7,6 г сульфату Феруму (ІІ) в нейтральному та кислому розчинах?
4. Розрахуйте масу мідного купоросу, необхідну для приготування 0,2 л 0,5 н. розчину сульфату Купруму.
5. Яку масу ZnSO4*7H2O необхідно взяти для приготування 5 л 2 н. розчину сульфату Цинку?
Лабораторна робота №14.
ТЕМА: КОМПЛЕКСНІ СПОЛУКИ
Складні хімічні сполуки, що існують як у кристалічному, так і у розчинному станах та мають хоча б один з хімічних ковалентних зв’язків утворений за донорно-акцепторним механізмом називають комплексними. Молекула комплексної сполуки складається з внутрішньої (координаційної) сфери та зовнішньої сфери.
Наприклад у комплексній сполуці сульфат тетраамінкупруму (ІІ) - [Cu(NH3)4]SO4 внутрішньою сферою або комплексним іоном є іон [Cu(NH3)4]2+, а зовнішньою сферою є сульфат –аніон SO42-. Комплексні сполуки у розчинах дисоціюють на комплексний іон та зовнішню сферу.
[Cu(NH3)4]SO4 ® [Cu(NH3)4]2+ + SO42-
Комплекси бувають катіонні [Cu(NH3)4]2+, аніонні [Fe(CN)6]3-? Та нейтральні [Ni(CO)4]. Комплексний іон має центральний атом – комплексоутворювач, в ролі якого виступають іони d-елементів (купруму, феруму, платини, кобальту). Коло комплексоутворювача координуються молекули або іони ліганди.
Координаційним сполукам властива ізомерія, коли речовини при однаковому якісному та кількісному складі володіють різною будовою а відтоді і різними властивостями. Розрізняють геометричну, оптичну, гідратну, іонізаційну та інші види ізомерій комплексних сполук.
Комплексні сполуки ведуть себе як слабкі електроліти, які дисоціюють неповністю, наприклад:
[Cu(NH3)4]2+ « Cu2+ + 4 NH3
Важливою характеристикою комплексів, яка визначає їх стійкість, є константа нестійкості. Згідно до закону діючих мас можна записати математичний вираз константи нестійкості для вищенаведеного прикладу.
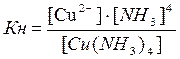
Чим більше значення константи нестійкості комплексного іону, тим менша його стійкість. Руйнування комплексів можливо 1) при додаванні сполук, які будуть зв’язувати іони, що утворюються при дисоціації; 2) при утворенні більш стійкого комплексу з меншим значенням Кн.
Один з класів координаційних сполук – внутрикомплексні сполуки. В цих сполуках комплексоутворювач утворює з лігандами зв’язки двома способами – як за рахунок неспарених електронів, так і за донорно-акцепторним механізмом. Внутрикомплексні сполуки утворюються різними катіонами з органічними реагентами. Вони мають циклічну будову, більшість з них малорозчинні і виразно забарвлені. Гемоглобін і хлорофіл – важливіші природні пігменти - є внутрикомплексними сполуками.
При взаємодії солей до складу яких входить комплексоутворювач можливо отримувати подвійні солі (ацидокомплекси). При додаванні до солі надлишку лугу отримують гідроксокомплекси.
Експериментальна робота
Дата: 2016-10-02, просмотров: 382.