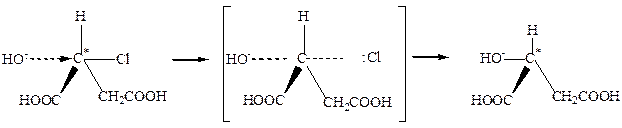Большое теоретическое и практическое значение имеют реакции, которые осуществляются с участием связей асимметрического С*, в частности реакции замещения. Достаточно подробно изучены реакции нуклеофильного замещения возле асимметрического атома С* (SN- реакции). Такого типа реакции впервые наблюдал и изучал Л. Вальден в 1896 г. Он установил, что реакции возле асимметрического атома С* во многих случаях сопровождаются инверсией (обращением) знака вращения плоскости поляризации света. Это явление было названо вальденовским обращением, т. е. изменением конфигурации молекулы в процессе реакции без рацемизации ее продукта.
Изменение или сохранение знака вращения, а соответственно и конфигурации молекул, существенно зависит от условий и механизма реакции замещения. Так, (-)-хлорянтарная кислота в процессе щелочного гидролиза превращается в (+)-яблочную. А при действии на (-)-хлорянтарную кислоту влажного оксида серебра, который трудно растворяется в воде и поэтому создает в растворе низкую концентрацию ионов ОН-, образуется (-)-яблочная кислота. Таким образом, в первом случае осуществляется не только замена атома хлора на гидроксильную группу, но и перегруппирование (обращение) групп атомов, соединенных с асимметрическим атомом С*. Изменение конфигурации осуществляется также при действии PCl5 на оптические изомеры яблочной кислоты, которые при этом превращаются в хлорянтарные кислоты с противоположными знаками вращения. Вышесказанное можно изобразить такой схемой:


Таким образом, замена возле асимметрического атома С* галогена на гидроксильную группу во время гидролиза водным раствором щелочи и замена возле асимметрическогоС* ОН-группы на галоген под действием PCl5 осуществляется с изменением конфигурации. Установлено, что причиной такого обращения конфигурации является механизм реакции замещения. Вальденовское обращение наблюдается в реакциях нуклеофильного замещения, которые осуществляются по бимолекулярному механизму (SN2-реакции). При таком механизме замещения анион ОН- атакует асимметрический атом С8 с противоположной относительно атома галогена стороны – с “тыла,,. В результате конечным продуктом реакции является молекула с противоположной конфигурацией соответственно с противоположным знаком вращения:
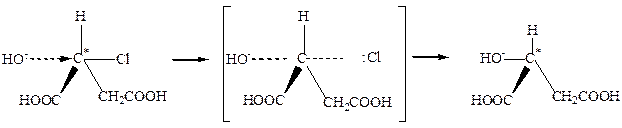
|
| (-)-хлорянтарная кислота
| переходное состояние
| (+)-яблочная кислота
|
Таким образом, если в процессе химического взаимодействия наблюдается обращение конфигурации (изменение знака вращения), то можно сделать вывод, что эта реакция вероятно протекает по SN2-механизму. В тех случаях, когда нуклеофильные реакции замещения возле асимметрического атома С* протекает по мономолекулярному механизму (SN1), осуществляется рацемизация, которая сопровождается частичным вальденовским обращением. Реакции этого типа проходят через стадию предварительной диссоциации исходного вещества с образованием карбониевого иона, который имеет плоскую конфигурацию, и анион ОН- может его атаковать как справа, так и слева. Частичное вальденовское обращение объясняется тем, что карбониевый ион не успевает приобрести полностью плоскую конфигурацию.
В тех случаях, когда молекула содержит группу, которая препятствует карбониевому иону приобрести плоскую конфигурацию, например карбоксил, реакции SN1 осуществляются с сохранением конфигурации: