Многоосновные гидроксикислоты содержат в молекуле две, три и больше карбоксильных групп. Представителями дикарбоновых гидроксикислот являются гидроксиянтарные кислоты. Гидроксиянтарная кислота, или яблочная кислота впервые была выделена еще в 1785 г. К. Шееле из недозрелых яблок. Она широко распространена в природе и содержится в кислых яблоках, рябине, барбарисе, крыжовнике, махорке и т.д. Яблочная кислота имеет один асимметрический атом С*, проявляет оптическую активность и существует в виде (+) - D - и (-) -L - стереоизомеров ( tпл.=1000С):

зеркало
(+) - D - яблочная кислота (-) -L - яблочная кислота
В природе распространена (-) -L - яблочная кислота. Рацемическую яблочную кислоту (tпл.=1300С) можно получить гидратацией малеиновой кислоты или действием гидроксида серебра на рацемическую бромянтарную кислоту:
|
|

|
Соли и сложные эфиры яблочной кислоты называются малатами.
Дигидроксиянтарные кислоты называют винными. Они содержат два асимметрических атома С*:

Количество оптических изомеров, как уже говорилось, вычисляют по формуле 2n, где n – число асимметрических атомов С*. Таким образом, стереоизомерных дигидроксиянтарных кислот должно быть четыре ( два изомера D - ряда, два -L - ряда). Каждая пара этих оптических изомеров должна давать по одному рацемату. В природе существуют, а также получены синтетически такие винные кислоты: (+) –винная ( I), ее антипод (-)-винная (II). Мезовинная (III) и рацемат – (±)-винная кислота, которая называется виноградной. В молекуле мезовинной кислоты оба асимметрических атома С* соединены с одинаковыми лигандами, и она имеет внутреннюю симметрию. Кроме того, в мезовинной кислоте осуществляется внутренняя компенсация вращения плоскости поляризации света противоположно построенными асимметрическими центрами с одинаковыми лигандами. Поэтому мезовинная кислота является оптически неактивной и у нее нет антипода:

(+)-винная (-)-винная мезовинная виноградная
кислота кислота кислота кислота
Причину оптической не активности мезовинной кислоты можно объяснить следующим образом. Допустим, что расположение Н, СООН и ОН возле асимметрического атома С* в таком порядке – от атома водорода через карбоксил к гидроксилу по часовой стрелке – обуславливает вращение плоскости поляризации света вправо, а расположение этих групп в противоположном порядке (против часовой стрелки) – вращение плоскости поляризации света влево. После такого предположения легко заметить, что в мезовинной кислоте Н, СООН и ОН возле верхнего атома С* расположены по часовой стрелке и должны обуславливать правое вращение, а возле нижнего атома С* эти же самые группы расположены против часовой стрелки и должны обуславливать левое вращение. Поскольку группы возле верхнего и нижнего атомов С* одинаковые, то правое вращение верхней части молекулы должно полностью компенсироваться левым вращением левой части молекулы. В результате такая винная кислота, хотя и имеет асимметрические атомы С*, оптическую активность не проявляет.
(+)-, (-) –винные кислоты являются оптическими антиподами. Мезовинная кислота относительно этих винных кислот уже не является их антиподом. Такие стереоизомеры, которые не являются антиподами, называют диастереоизомерами. Таким образом. (-)-винная и мезовинная кислоты диастереоизомеры. Диастереоизомеры отличаются друг от друга не только оптическим вращением,но и другими физико-химическими свойствами. тогда как у антиподов физико-химические свойства одинаковые, но отличающиеся направлением вращения плоскости поляризации света ( см. табл.1). Диастереоизомеры образуют также различающиеся по свойствам производные. Так, соли диастереоизомерных винных кислот в значительной степени отличаются по растворимости в воде. Это свойство имеет важное практическое значение и используется для разделения данных диастереоизомеров.
|

При нейтрализации этой соли гидроксидом натрия образуется смешанная калиево-натриевая соль винной кислоты – известная под названием сегнетова соль. При действии на сегнетову соль гидроксида меди (II) в щелочной среде получают жидкость Фелинга – реактив для обнаружения альдегидов. Сегнетова соль используется также в радиотехнике ( пьезокристаллы).

сегнетова соль
Двойная соль калия и сурьмы 2С4Н4О6К×(SbO)2×Н2О под названием “рвотного камня,, используется в медицине, а также при протравном крашении.
Винную кислоту применяют в пищевой промышленности, например при изготовлении напитков.
Антипод виннокаменной кислоты – (-)-винная кислота в природе не встречается. Ее можно получить из рацемической (±)-винной виноградной кислоты разделением кристаллов на лево-и правовращающие изомеры.
Виноградная, или (±)-винная кислота является рацематом. Она представляет собой химическое соединение равномолекулярных количеств (+)-винной кислоты и поэтому не является оптически активной. В водном растворе виноградная кислота имеет мономерную, а не удвоенную молекулярную массу. Это свидетельствует о том, что при растворении рацемат диссоциирует на (+)- и (-)-винные кислоты. Виноградную кислоту можно получить при длительном нагревании (+)- или (-)-винной кислоты, а также при окислении фумаровой кислоты водным раствором KМnO4:
|

Во время кипячения (+)-, (-)-винных или виноградной кислот со щелочами, а также при окислении малеиновой кислоты водным раствором KМnO4 образуется мезовинная кислота:
|

Представителем трехосновных гидрокислот является лимонная кислота (2-гидроксипропан-1,2,3-трикарбоновая кислота):

В молекуле лимонной кислоты нет асимметрического атома С*, и поэтому она является оптически неактивной. Лимонную кислоту впервые получил в 1784 г. К. Шееле из лимонного сока, в котором ее содержание 6-10%. Эта кислота найдена также в смородине, малине, крыжовнике, апельсинах, свекловичном и виноградном соках, а также в виде солей – в махорке, и в небольших количествах в молоке и крови. В промышленности лимонную кислоту получают лимонно-кислым брожением глюкозы и патоки, а также из махорки после удаления из нее никотина. Лимонная кислота используется в пищевой промышленности при изготовлении кондитерских изделий (конфет, кремов, безалкогольных напитков), в текстильной промышленности при крашении тканей и медицине.

Соли лимонной кислоты называются цитратами. Лимонная кислота, как и яблочная, играет важную роль в процессах обмена веществ в живых организмах. Она принимает участие в цикле трикарбоновых кислот. Называемом циклом лимонной кислоты или циклом Кребса – универсальном этапе окислительного катаболизма ( процесс распада веществ в организме ) углеводов, липидов и других соединений в присутствии кислорода.
При дегидратации лимонной кислоты как β-гидроксикарбоновой кислоты получается цис-акотиновая кислота, которая при последующей гидратации образует изолимонную кислоту:
|

изолимонная кислота
Разложение лимонной кислоты при нагревании в присутствии серной кислоты происходит по типу разложения a-гидроксикарбоновых кислот. Образующиеся при этом муравьиная и ацетондикарбоновая кислоты в результате последующих превращений дают конечные продукты – воду, оксид углерода, диоксид углерода и ацетон.
|

Хлоряблочные или гидроксихлорянтарные кислоты относятся к дикарбрновым гидроксикислотам с двумя асимметрическими атомами углерода:

Поэтому для хлорянтарных кислот существует (22=4) оптических изомера, которые изображаются проекционными формулами I-IV:

| 
| 
| 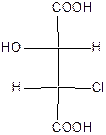
|
| эрито (-) – tпл.=173оС | эрито (+) – tпл.=173оС | трео (+) – tпл.=167оС | трео(-) – хлоряблочная кислота tпл.=167оС |
Вещества, в молекулах которых одинаковые заместители расположены у асимметрических атомов С* с одной стороны, называют эритро-изомерами. Если же эти заместители расположены с разных сторон, то их называют трео-изомерами. Кроме стереоизомеров I-IV, существуют две рацемические хлоряблочные кислоты: рацемат ( tпл.=146оС),который состоит из (+)- и (-)-эритро-форм, и рацемат (tпл.=153оС), который состоит из (+)- и (-)-трео-форм.
Смесь стереоизомерных хлоряблочных кислот можно получить присоединением хлорноватистой кислоты к малеиновой или фумаровой кислоте:

Дата: 2016-10-02, просмотров: 511.