Гидроксикарбоновые кислоты *(гидроксикислоты) или (спиртокислоты) – это органические соединения, молекулы которых содержат одновременно карбоксильную и гидроксильную группы. Таким образом, гидроксикислоты являются бифункциональными органическими соединениями. Количество функциональных групп в гидроксикислотах может быть разным: одна гидроксильная и одна карбонильная, две гидроксильных и одна карбоксильная, две гидроксильных и две карбоксильных и т.д.
Гидроксикислоты можно рассматривать как производные соответствующих органических кислот:
| Органическая кислота | Гидроксикислота |
| Н3С-СООН** уксусная | НО-СН2-СООН гидроксиуксусная или гликолевая |
| Н3С-СН2-СООН пропионовая |  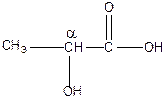
 α-гироксипропионовая α-гироксипропионовая
 β-гидроксипропионовая
β-гидроксипропионовая
 гидроксиянтарная или яблочная
гидроксиянтарная или яблочная
 дигидроксиянтарная, или винная
дигидроксиянтарная, или винная
|
Гидрокислоты классифицируют по основности и по атомности. Количество карбоксильных групп указывает на основность кислоты, а количество гидроксильных групп, учитывая и гидроксил карбоксила – на её атомность. Например, гидроксиуксусная кислота, α – и β - гидроксипропионовые кислоты являются односновными двухатомными гидроксикислотами, а яблочная кислота – двухосновной трехатомной гидроксикислотой, винная – двухосновной четырех атомной гидроксикислотой и т. д. Для гидроксикислот используют преимущественно исторические названия, которые происходят от названий природных источников нахождения этих гидроксикислот. Так, α –гидроксипропионовая кислота впервые была найдена в кислом молоке и потому называется молочной кислотой, гидроксиянтарная кислота впервые была найдена в яблоках и её называют яблочной, дигидроксиянтарная содержится в винограде и потому её называют виноградной и т.д. Часто гидроксикислоты называют по названию соответствующих карбоновых кислот, обозначая греческими буквами положение спиртовой группы в молекуле относительно карбоксильной например: α – гидроксипропионовая кислота, β – оксипропионовая кислота и т.д. По систематической номенклатуре название гидроксикислоты образуют из названия соответствующей карбоновой кислоты, перед которой ставят приставку гидрокси-(окси-), что указывает на присутствие ОН – группы в молекулах этих кислот. Положение гидроксильной группы в цепи указывают номером углеродного атома, с которым она соединена, причем нумерацию углеродных атомов в цепи начинают с углеродного атома карбоксильной группы. Например: 2 – гидроксипропановая кислота, 3 – гидроксипропановая кислота. В табл.1 приведены названия наиболее распространенных гидроксикислот. Изомерия в ряду гидроксикислот зависит от структуры углеводородной цепи и положения спиртового гидроксила. Гликолевая кислота изомеров не имеет. Следующий гомолог ряда гидроксикислот существует в виде двух изомеров - α – гидроксипропионой и β – гидроксипропионой кислот, которые отличаются положением спиртового гидроксила. Одноосновная гидроксикислота с четырьмя углеродными атомами может существовать в виде пяти структурных изомеров:
 
 2- гидроксибутановая кислота 2- гидроксибутановая кислота
 α – гидроксимасляная кислота α – гидроксимасляная кислота
|  3 – гидроксибутановая, или β – гидроксимасляная кислота
3 – гидроксибутановая, или β – гидроксимасляная кислота
|
 4-гидроксибутановая кислота
или
γ – гидроксимасляная кислота (ГОМК)
4-гидроксибутановая кислота
или
γ – гидроксимасляная кислота (ГОМК)
|  2-метил-3-гидроксипропановая кислота
2-метил-3-гидроксипропановая кислота
|
 2-метил-2-гидроксипропановая кислота
2-метил-2-гидроксипропановая кислота
|
Первые три из приведённых гидроксикислот являются изомерами, которые отличаются положением спиртового гидроксила, изомерия остальных обусловлена еще и разветвлением углеводородной цепи. Кроме того, гидроксикислоты, молекулы которых содержат асимметрические атомы углерода существуют в виде оптических изомеров.
2. ОДНООСНОВНЫЕ ГИДРОКСИКИСЛОТЫ.
Ряд гидроксикислот, как, например, молочная, винная, лимонная и др., являются продуктами жизнедеятельности организмов. Поэтому некоторые гидроксикислоты и в промышленных масштабах получают путем биосинтеза - синтеза с помощью живых организмов. Так, молочную кислоту получают молочнокислым брожением углеводородов. Кроме того, существуют синтетические методы получения гидрокислот. Из этих методов для получения α – гидроксикислот чаще всего используют следующие:
1. Кислотный гидролиз циангидридов (осксинитрилов), которые получают из альдегидов или кетонов и синильной кислоты:

молочная кислота.
2.Щелочной гидролиз α – галогенкарбоновых кислот:

β – гидроксикислоты получают одним из таких методов:
1. Кислотно-каталитической гидратацией непредельных кислот:
 акриловая кислота β-гидроксипропионовая кислота.
акриловая кислота β-гидроксипропионовая кислота.
Присоединение воды происходит по правилам Марковникова.
2. Реакцией Реформаторского (1889 г.), который установил, что сложные эфиры α – галогенкарбоновых кислот в присутствии цинка взаимодействуют с карбонильными соединениями и образуют сложные эфиры β –гидроксикислот. Последние омылением можно легко превратить в β –гидроксикислоты. В реакции Реформаторского как промежуточные продукты сначала образуются цинкорганические соединения, которые потом реагируют с карбонильными соединениями. Так, β – гидроксимасляную кислоту можно получить с помощью этой реакции из этилового эфира бромуксусной кислоты и уксусного альдегида:
| * Растворы, которые содержат меньше, чес 33% яблочной кислоты, 20оС вращают плоскость поляризации света влево, более концентрированные – вправо. В ацетоновом растворе левое вращение левое вращение постоянно [α]Д= -5,7о | 
| 
| 
| НО-СН2-СН2-СООН | 
| НО – СН2 - СООН | Формула | Номенклатура и физические свойства некоторых гидроксикислот. | Таблица 1 | ||
| 2-Гидрокси- пропан-1,2,3-трио-вая | 2,3-Дигидро- ксибутандиовая | 2-Гидрокси-бутандиовая | 3-Гидрокси-пропановая | 2-Гидрокси-пропановая | Гидроксиэтановая | систематическая | Название в соответствии с номенклатурой. | ||||
| Лимонная | (±)-Винная, виноградная, (+)-Винная (-)-Винная Мезовинная | (±)-Яблочная гидроксиянтарная (+)-Яблочная (-)-Яблочная | Гидракриловая, β-гидроксипропионовая | (±)- Молочная кислота, α-гидроксипропановая, (+)- Молочная кислота, (-)- Молочная кислота | Гликолевая, гидроксиуксусная | историческая, по названию карбоновой кислоты | |||||
| tпл оС | |||||||||||
| неактивная | неактивная +12,0 - 12,0 неактивная | неактивная * | неактивная | неактивная +3,82 - 3,82 | неактивная | Угол вращения градусы.  
| |||||
| 8,4 при 18оС | 10,2 13,0 6,0 | 3,9 | 31,1 | 1,38 | 1,48 | КD1ּ10-4 | Константа диссоциации в воде при 25оС | ||||
| 1,7 при 18оС | 4,0 6,9 1,4 | 0,9 | - | - | - | КD2ּ10-5 | |||||
 Восстановление оксокарбоновых кислот приводит к образованию гидроксикарбоновых кислот:
Восстановление оксокарбоновых кислот приводит к образованию гидроксикарбоновых кислот:
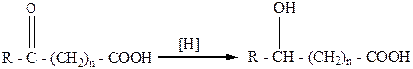 ,
,
где n =0, 1, 2, 3 и т.д., R = H, AIr, Ar.
Окисление спиртовой или альдегидной группы в карбоксильную используется обычно только для получения гидроксикислот, например:

этиленгликоль гликолевая кислота

3 – гидроксибутаналь (альдоль) β – гидроксимасляная кислота.
Физические свойства.
Одноосновные гидроксикислоты с небольшой молекулярной массой это сиропообразные жидкости или твердые вещества (табл.1). Двухосновные гидроксикислоты – кристаллические вещества. Гидроксикислоты лучше растворяются в воде, чем соответствующие им карбоновые кислоты, но ограниченно растворяются в эфире и других органических растворителях. Гидроксикислоты имеют значительно более высокие температуры плавления и кипения, чем карбоновые кислоты с тем же самым количеством углеродных атомов. Многие гидрокислоты проявляют оптическую активность.
Химические свойства.
Гидрокислоты содержат две функциональные группы, и их химические свойства определяются присутствием как карбоксильной, так и гидроксильной групп. Поэтому гидроксикислоты одновременно проявляют свойства карбоновых кислот и спиртов. Причем карбоксильная и гироксильная группы могут участвовать в химических реакциях отдельно, независимо одна от другой, или обе вместе. Так, гидроксикислоты, как карбоновые кислоты, в водных растворах диссоциируют:

Однако гидроксикислоты, и в первую очередь  α – гидроксикислоты, имеют более сильные кислотные свойства, чем соответствующие им карбоновые кислоты. Например, константы диссоциации гликолевой (KD=1,48ּ10-4) и α – гидроксипропановой (КD=1,38ּ10-4) кислот приблизительно в 8 – 10 раз больше, чем соответственно уксусной (КD=1,75ּ10-5) и пропановой (КD=1,34ּ10-5) кислот. Причиной усиления кислотных свойств гидроксикислот являетя (–) I – эффект спиртовой ОН-группы, которая обуславливает смещение электронов по системе σ – связей НО ← СН2 ← С ← О ← Н.
α – гидроксикислоты, имеют более сильные кислотные свойства, чем соответствующие им карбоновые кислоты. Например, константы диссоциации гликолевой (KD=1,48ּ10-4) и α – гидроксипропановой (КD=1,38ּ10-4) кислот приблизительно в 8 – 10 раз больше, чем соответственно уксусной (КD=1,75ּ10-5) и пропановой (КD=1,34ּ10-5) кислот. Причиной усиления кислотных свойств гидроксикислот являетя (–) I – эффект спиртовой ОН-группы, которая обуславливает смещение электронов по системе σ – связей НО ← СН2 ← С ← О ← Н.
||
O
Поэтому атом водорода карбоксильной группы легче протонизируется, чем в карбоновых кислотах, и сила гидроксикислот увеличивается. Чем ближе спиртовый гидроксил расположен к карбоксильной группе, тем сильнее будет гидроксикислота, поскольку по мере удаления ОН-группы от СООН-группы влияние (–) I-эффекта постепенно “затухает,,. Поэтому β-, γ -, δ -гидроксикислоты проявляют значительно меньшую кислотность. Чем соответствующие им  α –гидроксикислоты.
α –гидроксикислоты.
1. Кислотные свойства.
Гидроксикислоты, как и карбоновые кислоты. Образуют соли, сложные эфиры, амиды и т.д. Например:

этиловый эфир молочная молочнокислый
молочной кислоты кислота натрий
(этиллактат) (лактат натрия)
2. Спиртовые свойства.
Гидроксикислоты, вступая в реакции как спирты. Образуют алкоголяты, простые эфиры, замещают гидроксил на галоген. Так, при взаимодействии гидроксикислот с щелочными металлами сначала образуются соли этих кислот. Которые далее реагируют с этими же веществами и образуют алкоголяты:

молочная Nа-соль алкоголят молочной
кислота молочной кислоты (и одновре-
кислоты менно соль)
При действии на гидроксикислоты галогенводородов спиртовый гидроксил их молекул замещается на галоген и образуются соответствующие галогенкислоты:

α –гидроксипропионовая α-хлорпропионовая
кислота ( молочная ) кислота
Пятихлористый фосфор замещает на галоген одновременно как спиртовый гидроксил, так и гидроксил карбоксила молекулы гидроксикислот и превращает их таким образом в хлорангидриды хлорорганических кислот:
 α –гидроксипропионовая хлорангидрид
α –гидроксипропионовая хлорангидрид
кислота α –хлорпропионовой
кислоты
При взаимодействии гидроксикислот с диметилсульфатом образуются простые эфиры :

молочная α-метиловый
кислота эфир молочной
кислоты
Гидроксикислоты, как и спирты, могут окисляться. Это свойство гидроксикислот отличает их от карбоновых кислот, которые, как правило, устойчивы к окислению. Гидроксикислоты,которые содержат первичную ОН-группу, при окислении превращаются в альдегидокислоты. А гидроксикислоты с вторичной ОН-группой - в кетокислоты:

гликолевая глиоксалевая
кислота кислота

молочная пировиноградная
кислота кислота
Аналогичное окисление молочной кислоты в пировиноградную осуществляется и в живых организмах.
Специфические реакции.
Кроме реакций, которые осуществляются с участием карбоксильной и спиртовой групп, гидроксикислотам свойственны также специфические реакции, обусловленные взаимным влиянием двух функциональных групп в их молекулах. Так, α-, β -,γ-,δ-, и ε -гидроксикислоты по-разному превращаются при нагревании. Гидроксикислоты при повышенных температурах дегидратируются, но в зависимости от взаимного расположения спиртовой и карбоксильной групп дегидратация их происходит по-разному и с образованием разных продуктов реакции.
α-Гидроксикислоты при нагревании отщепляют воду межмолекулярно за счет гидроксила карбоксильной группы одной молекулы гидроксикислоты и атома водорода спиртовой группы другой молекулы гидроксикислоты. Продуктами такой дегидратации являются циклические межмолекулярные сложные эфиры, которые называют лактидами. Так, гликолевая кислота в таких условиях дает кристаллический лактид (2,5-диоксо-1,4-диоксан, или гликолид):

Молочная кислота при дегидратации также образует лактид ( 3,6-диметил-2,5-диоксо-1,4-диоксан):

β-Гидроксикислоты при нагревании дегидратируются внутримолекулярно. Вода при этом отщепляется за счет спиртового гидроксила и весьма подвижного α-водородного атома метиленовой группы. В результате образуются α-, β - нередельные кислоты. Так, β-гидроксипропионовая кислота при этом превращается в акриловую кислоту:

γ - и δ-гидроксикислоты при нагревании вступают во внутримолекулярную этерификацию между спиртовым гидроксилом и карбоксильной группой, образуя внутримолекулярные циклические сложные эфиры, которые называют лактонами. Так, γ-гидроксимасляная кислота при дегидратации превращается в бутиролактон (tкип.=204оС ):

Реакцию лактонизации гидроксикислот открыл в 1873 г. А.М. Зайцев. Лактоны являются биологически активными веществами и используются для синтеза кровезаменителей. Некоторые лактоны имеют приятный запах и их используют в парфюмерии.
ε -Гидроксикислоты и гидроксикислоты с еще более удаленной спиртовой группой при нагревании вступают в реакции конденсации и образуют при этом линейные полимеры.
Важнейшие представители.
Гликоливая кислота (tпл.=79оС) содержится во многих растениях, например в соке недозрелого винограда, свекле, а также сахарном тростнике. Гликоливую кислоту можно получить окислением этиленгликоля или восстановлением щавелевой кислоты:

этиленгликоль гликолевая щавелевая
кислота кислота
Гликоливую кислоту применяют при дублении кож.
Молочная кислота ( tпл.=18оС) впервые была открыта в 1780 г. К. Шееле в кислом молоке ( в связи с чем и получила свое название ). Молочная кислота является продуктом жизнедеятельности молочнокислых бактерий Bacillus acidi laevolactici , которые превращают углеводы молока ( преимущественно лактозу).
Кислое молоко, кефир, ряженка, кислая капуста, моченые яблоки,соленые огурцы, помидоры и т.д. содержат в значительном количестве молочную кислоту.
В промышленности молочную кислоту получают молочнокислым брожением углеводов в щелочном водном растворе. Этот процесс описывается общей схемой:
|

Cоли и сложные эфиры молочной кислоты, называют лактатами. Молочная кислота довольно давно используются как консервирующее средство, предохраняя от гниения, при засолке капусты, огурцов, помидоров и других овощей и фруктов, при силосовании кормов. Молочная кислота применяется также для протравного крашения тканей, в кожевенной промышленности, медицине. Так, лактаты алюминия и аммония предотвращают кровотечение десен, лактат железа назначается больным гипохромной анемией.
В организме L-(+)-молочная кислота, называемая также мясомолочной кислотой, является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мышцах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты – недостаток кислорода,что вызывает восстановление пировиноградной кислоты в молочную под действием НАDּН:

пировиноградная кислота L-(+)-молочная кислота
Во время отдыха запасы кислорода возобновляются и молочная кислота превращается в пировиноградную.
g -Гидроксимасляная кислота (ГОМК) НО-СН –СН –СН –СООН обладает наркотическим действием, практически нетоксична. Применяется в виде натриевой соли НО-СН –СН –СН –СООNa ( g -гидроксибутират натрия ) как снотворное средство, а также в анестезиологии в качестве неингаляционного наркотического средства при операциях.
Дата: 2016-10-02, просмотров: 962.