Известно большое количество веществ, которые способны вращать плоскость поляризованного света, т.е. отклонять ее вправо ( по часовой стрелке) или влево ( против часовой стрелки). Эта способность веществ была названа оптической активностью, а сами вещества – оптически активными, или оптически деятельными. Оптически активные вещества существуют в виде оптических изомеров. Явление оптической активности особенно распространено среди органических веществ природного происхождения ( гидроксикислоты, аминокислоты, углеводы, белки, нуклеиновые кислоты, алкалоиды и др.). Это явление имеет большое биологическое значение, поскольку оно связано с асимметрией веществ, которые входят в состав живых организмов, и с явлением жизнедеятельности.
В 1848 г. французский ученый Л. Пастер установил, что оптическую активность имеют соли винной кислоты, которые существуют в виде ,,правого,, и ,,левого,, оптических изомеров , в 1860 г. он же высказал предположение, что оптическая активность является результатом пространственного асимметричного строения этих веществ. Существование оптически активных изомеров, которые отклоняют плоскость поляризованного света влево и вправо, объяснили в 1874 г. Я. Вант-Гофф и Ле Бель. Эти ученые почти одновременно независимо друг от друга опубликовали работы, в которых сформулировали стереохимическую гипотезу, которая потом стала теорией. Основные положения стереохимической теории оптической изомерии органических веществ можно сформулировать следующим образом:
1.Оптически активные вещества, как правило, содержат асимметрические атомы углерода, которые обозначаются звездочкой: С*. Асимметрическим называется атом углерода, связанный с четырьмя разными атомами или группами атомов (лигандами). Например, глицериновый альдегид и молочная кислота содержат один асимметрический атом углерода:

Существуют органические вещества, которые содержат два, три и большее количество асимметрических углеродных атомов. Оптическая активность может быть обусловлена присутствием в молекуле и других асимметрических атомов (азота, фосфора).
2.Четыре лиганда расположены в пространстве по вершинам тетраэдра, в центре которого находится асимметрический атом С*. Пространственная форма молекулы, которая при этом образуется, называется конфигурацией. Конфигурация тетраэдра асимметрического атома углерода всегда неправильная, поскольку лиганды, которые соединены с этим атомом, разные.
3.Молекулы, которые содержат асимметрические атомы углерода, несимметричны, потому что у них нет таких элементов, как центр и плоскость симметрии. Несимметричные молекулы нельзя совместить с их зеркальным изображением, как нельзя совместить правую и левую руки. Поэтому такие молекулы называют еще хиральными ( от греческого “хирос,, - рука). В последнее время вместо терминов “асимметрический атом,, , “асимметрическая молекула,, используют более точные термины “хиральный атом,, , “хиральная молекула,, , поскольку термин “асимметрический,, говорит об отсутствии в молекуле вообще любых элементов симметрии, что является неточным. Хиральность – это свойство молекулы (объекта) не совмещаться со своим зеркальным изображением.
4.Молекулы с асимметрическим атомом углерода существуют в виде правых (+)-форм ( конфигураций) и левых (-)-форм ( конфигураций), т.е. в виде стереоизомеров, которые отличаются разным расположением лигандов в пространтстве вокруг асимметрического атома С*. Правый и левый стереоизомеры, зеркально подобные между собой, но не совместимые (хиральные), или энантиоморфные ( от греческого “энантиос” - противоположный ). Таким образом, оптическая ( зеркальная ) изомерия – это вид пространственной изомерии, при которой стереоизомеры отличаются расположением в пространстве лигандов вокруг асимметрического атома углерода, но подобны между собой как предмет и его зеркальное изображение, т.е. являются энантиоморфными.
Право (+) – и лево (-) – вращающие изомеры имеют одинаковую структуру ( одинаковую последовательность химических связей в молекуле ), одинаковые температуры кипения и плавления, растворимость, теплопроводность и т.д. , но отличаются между собой следующими свойствами:
1) в жидком, газообразном состояниях и в растворах они отклоняют плоскость поляризованного света на одинаковый угол, но в противоположных направлениях;
2) оба изомера кристаллизуются в энантиоморфных (зеркально противоположных ) формах один относительно другого, т.е. являются оптическими антиподами;
3) право (+)- и лево (-)- вращающие изомеры отличаются реакционной способностью относительно других оптически активных реагентов;
4) эти изомеры проявляют разное физиологическое действие на живые организмы;
5)  при смешении равномолекулярных количеств (+)- и (-)- изомерных форм образуются оптически неактивные ( недеятельные или инактивные ) соединения, которые называются рацематами и обозначают знаком r(i) (от французского acide racemique – виноградная кислота, на примере которой Л. Пастер наблюдал это явление): (+)-изомер+(-)-изомер r((i) (рацемат, i – инактивный).
при смешении равномолекулярных количеств (+)- и (-)- изомерных форм образуются оптически неактивные ( недеятельные или инактивные ) соединения, которые называются рацематами и обозначают знаком r(i) (от французского acide racemique – виноградная кислота, на примере которой Л. Пастер наблюдал это явление): (+)-изомер+(-)-изомер r((i) (рацемат, i – инактивный).
Рацематы отличаются от (+)- и (-) –изомеров по физическим и другим свойствам.
Оптическую активность веществ определяют с помощью поляриметра. Оптическая активность веществ характеризуется углом удельного вращения  (Д – желтая линия натрия ) – устойчивой величиной угла вращения плоскости поляризации света раствором вещества при его концентрации С, которая равняется 1 г вещества в 1 мл раствора, при толщине слоя l дм :
(Д – желтая линия натрия ) – устойчивой величиной угла вращения плоскости поляризации света раствором вещества при его концентрации С, которая равняется 1 г вещества в 1 мл раствора, при толщине слоя l дм :
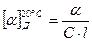
При наличии в молекуле органического вещества n асимметрических углеродных атомов количество пространственных изомеров выражается формулой 2n . В молекуле молочной кислоты содержится один асимметрический атом С*. Поэтому должны существовать (и существуют) два (21 =2) пространственных изомера этой кислоты. Действительно, еще в 1847 г. Ю. Либих выделил из мышц ( мясного экстракта ) молочную кислоту, которая отклоняет плоскость поляризации света вправо. Поэтому (+) – молочную кислоту назвали мясомолочной. Она образуется в мышцах в процессе анаэробного расщепления углеводов. Левовращающая (-) – молочная кислота была получена во время брожения сахаристых веществ под влиянием микроорганизмов Bacillus acidi laevofactici .

Зеркало
 Зеркало
Зеркало 
Рис.1. Модели (+) – молочной кислоты (а) и (-) - молочной кислоты (б)
Тетраэдрические и шаростержневые модели молекул этих кислот изображены на рис.1. Молочная кислота, которая образуется в процессе скисания молока, является практически неактивной и представляет собой рацемическое соединение равномолекулярных количеств (+)- и (-) – молочных кислот: (+)- +(-) – молочная кислота = r – молочная кислота. Обе (+)- и (-) – молочные кислоты имеют одинаковую температуру плавления (26оС), что отличается от температуры плавления рацемической молочной кислоты, которая плавится при 18оС.
Э.Фишер в 1891 г. предложил для удобства и простоты изображать стереоизомеры не в виде рисунков их молекул, а проекционными формулами, которые представляют собой проекции тетраэдрических моделей соответствующих моделей на плоскость. Для написания проекционных формул тетраэдр размещают относительно наблюдателя так, чтобы линия горизонтального ребра связи Н-С-ОН проходила через центр тетраэдра ( через ядро атома С* ). При проектировании связей Н-С-ОН и Н3С-С-СООН на плоскость получают проекционную формулу в виде двух линий, которые пересекаются под прямым углом. В точке пересечения этих линий находится атом С*, а на концах линий – лиганды.

(-) – молочная кислота (+) – молочная кислота
Одно из главнейших правил применения проекционных формул состоит в том, что эти формулы можно вращать только в плоскости рисунка на 180о, но их нельзя вращать на 90о или выводить из плоскости рисунка. Поэтому проекционную формулу правой формы молочной кислоты нельзя совместить с формулой левой ее формы. В несовместимости этих двух форм можно убедиться, переходя от атома Н к группе ОН через карбоксил. Для (+) – формы такой переход осуществляется по часовой стрелке, а для (-) – формы - против часовой стрелки.
Дата: 2016-10-02, просмотров: 394.