Реакции катиона Na+:
1. Реактив KH2SbO4 – дигидроантимонат калия К 2-3 каплям раствора соли натрия прибавляют 2-3 капли реактива. На холоде, при потирании стеклянной палочкой образуется белый мелкокристаллический осадок. NaCl + KH2SbO4 ® NaH2SbO4 ¯ + KCl
(бел. кр.)
Реакция исследуемого раствора должна быть нейтральной, так как в кислой среде идет разложение реактива с образованием белого аморфного осадка м-сурьмяной кислоты HSbO3.
KH2SbO4 + HCl ® H3SbO4 + KCl
H3SbO4 ® HSbO3¯ + H2O
(бел. аморфн.)
В щелочной среде осадок растворяется: NaH2SbO4 ¯ + 2NaOH® Na3SbO4 + 2 H2O
Обнаружению Na+ мешают соли аммония,которые в растворе гидролизуются и создают кислую реакцию среды, в которой реактив на катион натрия разлагается:
Гидролиз NH4+ + HOH Û NH4OH + H+ pH< 7
Разложение реактива H+ + H2SbO4- ® HSbO3¯ + H2O
2. Крупинка соли Na+, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Реакции катиона К+:
1. Реактив NaHC4H4O6 гидротартрат натрия К 2-3 капли раствора соли калия прибавляют 2-3 капли реактива. На холоде, при потирании стеклянной палочкой образуется белый мелкокристаллический осадок. KCl + NaHC4H4O6 ® KHC4H4O6¯ + NaCl
(белый)
При нагревании, добавлении сильных минеральных кислот и щелочей осадок растворяется:
KHC4H4O6¯ + HCl ® KCl + H2C4H4O6
KHC4H4O6¯ + KOH ® K2C4H4O6 + H2O
KHC4H4O6¯ + NaOH ® KNaC4H4O6 + H2O
Если вместо NaHC4H4O6 используют свободную кислоту H2C4H4O6, то для предотвращения растворения осадка реакцию ведут в присутствии ацетата натрия CH3COONa:
KCl + H2C4H4O6 CH3COONa KHC4H4O6¯ + HCl
 HCl + CH3COONa ® NaCl + CH3COOH
HCl + CH3COONa ® NaCl + CH3COOH
KCl + H2C4H4O6 + CH3COONa ® KHC4H4O6¯ + NaCl + CH3COOH
2. Реактив кобальти нитрит натрия или гексанитрокобальтат (III) натрия Na3[Co(NO2)6] К 2-3 каплям раствора соли калия прибавляют равный объем реактива. При стоянии образуется осадок желтого цвета. 2KCl + Na3[Co(NO2)6] ® K2Na[Co(NO2)6]¯ +2 NaCl
В щелочной среде реактив разлагается
Na3[Co(NO2)6] + 3NaOH ® Co(OH)3¯ + 6NaNO2
(бурый)
3. Крупинка соли К+, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет.
Реакции катиона NH4+:
1. Едкие щелочи NaOH или KOH . При действии на 2-3 капли раствора соли аммония раствором щелочи при нагревании выделяется газообразный аммиак. NH4Cl + KOH ® NH3 + H2O + KCl
Выделяющийся аммиак определяют по запаху или по: - посинению влажной красной лакмусовой бумаги; - покраснению белой фенолфталеиновой бумаги;
NH3 + H2O Û NH4+ + OH- pH >7
2. Реактив Несслера - K2[HgI4] в KOH тетрайодомекрурат калия в насыщенном растворе щелочи. К 1 капле раствора соли аммония прибавляют 1 каплю раствора реактива Несслера. Образуется осадок красно-бурого цвета.
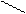
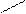 Hg
Hg
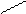
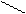 NH4Cl + 2K2[HgI4] + 4KOH ® [O NH2]I¯ + KCl + 7KI + 3H2O
NH4Cl + 2K2[HgI4] + 4KOH ® [O NH2]I¯ + KCl + 7KI + 3H2O
Hg
(кр.-бур.)
оксодимеркураммония йодид
При очень малых количествах солей аммония появляется желтое окрашивание.
Дата: 2019-11-01, просмотров: 332.