В этом разделе не предусматриваются методические рекомендации при решении задач, т.к. диапазон решения теоретических задач очень широк и при решении таких задач происходит акт творчества, находится новый путь в решении сложных проблем или создается нечто новое. Но при решении таких задач студенты опираются на законы химии, физики и математики.
Примеры решения задач
1. а). Чтобы незаметно было, что молоко прокисло, в него добавляли соду. Как это можно выявить?
б) Молоко разбавляли водой, а чтобы прозрачность его не увеличивалась, добавляли крахмал. Как распознать фальсификацию?
Решение:
Вариант 1. В 50 мл кислого молока добавим 10 г пищевой соды, тщательно перемешаем стеклянной палочкой. Ярких внешних изменений нет, но кислый вкус молока исчезает. Происходит реакция нейтрализации молочной кислоты гидрокарбонатом натрия:
CH3-CHOH-COOH + NaHCO3 → CH3-CHOH-COONa + CО2↑+ H2O.
Причем на нейтрализацию молочной кислоты идет только часть гидрокарбоната натрия. Остальная часть гидролизуется:
NaHCO3 + НОН 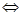 NaOH + CО2↑ + Н2О;
NaOH + CО2↑ + Н2О;
НСО  3 + НОН
3 + НОН 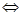 ОН
ОН  + СО2↑ + Н2О.
+ СО2↑ + Н2О.
Проверив индикаторной бумагой, раствор молока, убеждаемся, что рН равен 9,0. Фенолфталеин меняет окраску в растворе на малиновую, что указывает на щелочную среду. Таким образом, для обнаружения в кислом молоке соды необходимо проверить среду раствора.
Вариант 2. В 32 мл свежего молока добавим 18 мл воды, чтобы раствор не был прозрачным, и 20 г крахмала, тщательно перемешаем. Для обнаружения крахмала в растворе добавим 2-3 капли раствора йода. Цвет молока изменяется на темно-синий. Таким образом, качественная реакция на крахмал вскрывает фальсификацию.
2. Хозяйственное мыло представляет собой смесь натриевых солей нескольких органических кислот с большой молекулярной массой. Если к раствору мыла добавить кислоту, то в результате обменной реакции образуется стеарин, из которого можно изготовить сувенирную свечу. Попытайтесь изготовить свечу из кусочка хозяйственного мыла. При желании сделайте ее окрашенной.
Решение:
Ножом нарезаем кусочки хозяйственного мыла и складываем их в чистую консервную банку. Наливаем воды, чтобы она с избытком накрывала кусочки мыла, и ставим банку на водяную баню, непрерывно помешивая ее содержимое до растворения. Когда мыло полностью растворится и раствор станет однообразной кашицей, консервную банку снимаем с водяной бани и приливаем (осторожно!) 7-8 мл 2 н. раствора уксусной кислоты. Под действием уксусной кислоты из раствора выделяется и всплывает на поверхность густая белая масса - стеарин (смесь стеариновой С17Н35СООН и пальмитиновой С15Н31СООН кислот):
C17H35COONa + CH3COOH →С17Н35СООН + CH3COONa.
стеарат натрия уксусная кислота стеарин ацетат натрия
Даем ей остыть и, собирая стеарин с поверхности ложкой, перекладываем его в чистую посуду. Затем два-три раза промываем водой и заворачиваем в чистую белую тряпку или фильтровальную бумагу, чтобы впиталась лишняя влага. Обезвоженный стеарин расплавляем. Для изготовления свечи окунаем многократно толстую витую нить в полученный расплавленный стеарин, каждый раз давая стеарину затвердеть на фитиле. Поступать, таким образом, следует до тех нор, пока на фитиле не нарастет свеча достаточной толщины.
Чтобы получить красивую фигурную свечу, фитиль желательно сначала пропитать 1-2 слоями стеарина и закрепить в форме так, чтобы он проходил точно по центру формы и был немного натянут. Затем в форму заливают горячий стеарин. Для окрашивания свечи в рабочую смесь вводят ионы
(Сг3+ — зеленый, Си2+ — голубой, Ni3+ — светло-зеленый, Со2+ - синий). Данный опыт можно проводить при изучении темы «Жиры» в X классе, а также на факультативных занятиях.
3. Как вытряхнуть песок из чернильницы-непроливайки? Примерно с такой проблемой столкнулись инженеры-литейщики. Отлитые из металла детали очищают струей песка. Поверхность деталей становится чистой, но отдельные песчинки попадают во внутренние полости и там остаются. Переворачивать тяжелые металлические детали и вытряхивать из них песок невозможно. Что делать?
Решение:
Используем изученный — «использование фазовых переходов».
Сначала надо четко сформулировать противоречие, которое нужно устранить: песок должен быть, чтобы очищать, и песка не должно быть, чтобы не загрязнять полости. Слово «песок» заменяем словом «вещество» - ведь абразивными свойствами обладает не только песок. Противоречие принимает вид: вещество должно быть, чтобы очищать, и вещество должно исчезнуть, чтобы не загрязнять полости. Известно, что вещество просто так исчезнуть не может, оно может только измениться, например, перейти в другое агрегатное состояние при изменении температуры. Подбираем вещество, которое, будучи твердым, выполнит работу, а потом исчезнет. Большинство веществ при повышении температуры сначала переходят в жидкое состояние, а жидкость тоже трудно удалить из полости. Значит, останавливаемся на явлении возгонки (сублимации). Известные учащимся вещества, способные возгоняться, - это йод, белый фосфор, «сухой лед». Для возгонки йода требуется высокая температура, белый фосфор огнеопасен и ядовит. Решение найдено: надо использовать «сухой лед», который после работы испарится, превратившись в газ.
4. Как изготовить конфеты в виде шоколадных бутылочек, наполненных густым малиновым сиропом? Учащиеся чаще всего предлагают сначала сделать шоколадную бутылочку, а потом залить в нее сироп. Однако сироп обязательно должен быть густым, иначе конфета получится непрочной. А густой сироп трудно залить в бутылочку. Можно, конечно, нагреть сироп, он станет более жидким. Но вот беда - горячий сироп расплавит шоколадную бутылочку. Как быть?
Решение:
Используем прием «сделать наоборот», т. е. не сироп заливать в бутылочку, а шоколадом покрывать сироп. Но возникает новое противоречие: как можно покрыть шоколадом жидкий сироп? Опять применяем тот же прием: пусть жидким будет шоколад, а сироп твердым. Придется изменить агрегатное состояние: сироп нужно заморозить в форме бутылочки и окунуть в жидкий шоколад. Шоколад застынет, а сироп растает. Конфетка готова.
Прием «сделать наоборот» — один из самых распространенных в изобретательстве. Закрепить знания о возможностях этого приема можно на примерах нескольких великих открытий: закона Ньютона (ученый задал себе вопрос: почему Земля не падает на яблоко? Попытавшись на него ответить, он сделал открытие). Закона Архимеда (он тоже сделал наоборот: измерил не объем предмета, погруженного в воду, а объем воды, им вытесненной. Это привело к открытию); гелиоцентрического устройства мира (Джордано Бруно предположил, что не Солнце движется вокруг Земли, а Земля вокруг Солнца, и оказался прав, хоть это предположение и стоило ему жизни).
5. Кристаллы оксида алюминия выращивают из очень чистого расплава. Нельзя даже плавить оксид алюминия в платиновом тигле — в расплав могут попасть атомы платины. Как получить сверхчистый расплав?
Решение:
Выявляем и формулируем противоречие: сосуд должен быть, чтобы расплав не разлился, и сосуда не должно быть, чтобы расплав не загрязнялся. Выбираем прием, соответствующий данному противоречию, — это «использование принципа однородности»: объекты, взаимодействующие с данным объектом, должны быть сделаны из того же материала или близкого ему по свойствам. В соответствии с этим принципом придется плавить оксид алюминия в... оксиде алюминия. Любой сосуд, наполненный оксидом алюминия, следует нагревать так, чтобы расплавилась только центральная часть. Получится расплав оксида алюминия в «тигле» из твердого оксида алюминия. Но тут же возникает следующая проблема: как нагреть оксид именно в центре, не прикасаясь к нему? Вспоминая физику, выясняем, что для нагрева без прямого контакта надо использовать электромагнитную индукцию: при этом источник энергии не соприкасается с нагреваемым веществом. Но твердый оксид алюминия — диэлектрик, он не проводит электрический ток. Значит, электромагнитная индукция не может возникнуть. Правда, расплавленный оксид проводит ток, но для плавления нужен нагрев.
Итак, возникает следующее противоречие: в оксид алюминия необходимо добавить кусочки металла, чтобы возникала электромагнитная индукция, и нельзя добавлять кусочки металла, потому что загрязнение оксида недопустимо. Для устранения этого противоречия используем принцип дробления, т. е. разделение объекта на независимые части — алюминий и кислород.
Изобретение оказалось удивительно простым. В оксид алюминия перед началом плавки вводят кусочки алюминия, который хорошо проводит электрический ток и поэтому йод действием электромагнитного поля быстро нагревается сам и нагревает оксид до плавления. Теперь, когда алюминий не нужен (расплавленный оксид сам проводит ток), он исчезает — просто-напросто сгорает при высокой температуре, превращаясь в оксид алюминия.
6. Одна из самых драматических истории в изобретательстве связана с обыкновенной электрической лампой. Неразрешимое, казалось бы, противоречие надолго затормозило развитие этого технического устройства. Чтобы улучшить качество излучения, сделать свет лампы более похожим на солнечный, нужно повысить температуру нити накала. Но чем выше температура нити, тем быстрее идет испарение металла: нить становится тоньше, перегорает, на внутренней поверхности колбы быстро образуется темный налет испарившегося вольфрама, преграждающий путь свету, лампа еще больше разогревается, светимость падает. Как решить задачу?
Решение:
Формулируем противоречие: вольфрамовая нить должна накаляться, но не должна испаряться. В данном противоречии заданы параметры нового вещества для нити накала. Но подобное вещество еще не получено, т. е. избавиться от вредного влияния (испарение вольфрамовой нити) прямым путем мы не можем.
Придется обратить вред в пользу. Уточним, что происходит в лампе.
При высокой температуре амплитуда колебаний атомов вольфрама в кристаллической решетке возрастает настолько, что отдельные атомы отрываются от нити и улетают. Куда? В соответствии с законами физики теплота переносится от более нагретого тела (нити) к менее нагретому (колбе). Как заставить атомы вольфрама вернуться назад и «приземлиться» на старое место, причем не где попало, а именно там, откуда их больше всего вылетает? Физические законы страшнее юридических, их невозможно нарушить даже при очень сильном желании. Перенос вольфрама из холодной зоны в горячую и точная «посадка» на нить накала противоречат законам физики. Здесь поможет химия. Известны так называемые транспортные реакции, при которых твердые или жидкие вещества, взаимодействуя с газообразными, образуют газообразные продукты, а полученные вещества после переноса в другую часть системы при повышении температуры разлагаются с выделением исходного вещества. Такой перенос может происходить как из холодной зоны в горячую, так и в обратном направлении. Параметры заданы. Осталось определить соединение вольфрама, обладающее транспортными функциями. В ртутной лампе используют бром (или хлор). В лампах накаливания в роли «извозчиков» может работать, например, йод. Он взаимодействует с осевшим на колбу вольфрамом, образуя йодид вольфрама(II), который разлагается на раскаленной нити, и вольфрам оседает туда, откуда он испарился. Замечательно то, что этот процесс не потребляет энергию извне, не требует никаких дополнительных обслуживающих систем — все обеспечивается безупречным поведением «дрессированных» молекул.
7. В одном институте разрабатывали проект не совсем обычного трубопровода: по одним и тем же трубам должны были друг за другом идти разные жидкости. Чтобы они не спешивались, их надо разделить специальным устройством, например, после первой жидкости идет шар, словно поршень, а за шаром другая жидкость. Такая система ненадежна, так как при большом давлении в трубопроводе жидкости будут смешиваться. Можно использовать другие разделители, например пробку из трех резиновых дисков. Но любой разделитель не пройдет через насосы, установленные на насосных станциях. Предложите разделитель, способный проходить через насосы и гарантирующий несмешивание жидкостей.
Решение:
Начнем с дробления: мысленно уменьшаем размеры шара. Вместо одного большого шара - множество футбольных мячей. Или теннисных. Или еще меньше - дробинок, плавающих в жидкости. (На такую «пробку» выдано авторское свидетельство.) Замена жесткой пробки на динамичную соответствует общей тенденции развития технических систем. А если продолжить мысленный эксперимент? Перейдем от дроби к еще более мелким частицам - молекулам. Возникает идея пробки из жидкости или газа. Газовая пробка не сможет быть разделителем: транспортируемая жидкость пройдет сквозь нее. А вот жидкая пробка возможна. Один нефтепродукт, например керосин, затем водяная пробка, а за ней другой нефтепродукт, скажем бензин. У жидкой пробки огромные преимущества: она никогда не застрянет в трубопроводе и свободно пройдет через насосы промежуточных станций. Но и недостаток у этой пробки существенный: нефтепродукты будут проникать в жидкий разделитель, головная и хвостовая части пробки постепенно смешаются с ними. Отделить их от воды трудно, на конечной станции пробку и попавшие в нее нефтепродукты придется выбросить. Но жидкое вещество пробки, прибыв в резервуар на конечной станции, должно само отделиться от нефти. Для этого есть только две возможности: жидкость становится твердым веществом и выпадает в осадок или превращается в газ и улетучивается. Переход в газ заманчивее, так как твердый осадок надо отфильтровывать. Значит, нужно вещество, которое при высоком давлении в нефтепроводе (десятки атмосфер) будет жидким, а при нормальном давлении — газообразным. Кроме того, учтем, что подобное растворяется в подобном. Чтобы пробка не растворялась в нефти, ее нужно изготовить из полярной жидкости, дешевой, безопасной, инертной по отношению к нефтепродуктам. Имея столь подробный перечень примет, нетрудно найти подходящее вещество по справочнику. Всеми интересующими нас качествами обладает аммиак. Пробка из жидкого аммиака надежно разделит идущие по трубопроводу жидкости. В дороге она частично смешается с нефтепродуктами, но это нестрашно: на конечной станции аммиак превратится в газ, в нефть останется в резервуаре.
8. Для изготовления листового стекла раскаленную стеклянную ленту подают на конвейер. Лента перекатывается с одного металлического ролика на другой, постепенно остывая. При этом не застывшая еще стеклянная лента прогибается, на стекле образуются неровности, поэтому его приходится долго полировать. Впервые столкнувшись с этой проблемой, инженеры предложили сделать ролики как можно тоньше, чтобы стеклянная лента получалась ровнее. Но чем тоньше ролики, тем сложнее изготовить из них огромный - в десятки метров — конвейер. Если толщина ролика равна толщине спички, на каждый метр конвейера потребуются 500 роликов и устанавливать их придется прямо-таки с ювелирной точностью. Как усовершенствовать процесс изготовления листового стекла?
Решение:
Попробуем опять применить принцип дробления. Уменьшаем диаметр роликов. Минимальная толщина — один атом. Раскаленная стеклянная лента движется по слою шариков-атомов. Отличный конвейер, идеально ровный.
Итак, под стеклянную ленту надо насыпать шарики-атомы. Это не могут быть атомы газа (они сразу улетучатся) или твердого тела (они не будут свободно двигаться). Остается одна возможность — использовать атомы жидкости. Какую жидкость взять для такого конвейера? Не будем искать наугад, используем знания по химии (или хотя бы справочники). Прежде всего, нужна жидкость легкоплавкая, но у нее должна быть высокая температура кипения, иначе она легко закипит, и поверхность стекла покроется пузырьками. Плотность жидкости должна значительно превышать плотность стекла (2,5 г/см3), иначе стеклянная лента не будет держаться на ее поверхности. Итак, искомое вещество имеет температуру плавления не выше 200-300°С, температуру кипения не ниже 1500 °С, плотность не менее 5-6 г/см3.
Таким сочетанием свойств обладают только металлы. Если не брать во внимание редкие металлы, претендентов совсем мало: висмут, олово, свинец. Висмут дорог, пары свинца ядовиты, остается олово. Итак, вместо конвейера — длинная ванна с расплавленным оловом. Вместо роликов — атомы.
Система перешла на микроуровень, появилась возможность дальнейшего развития. И действительно, сразу после этого изобретения потоком пошли патенты на различные усовершенствования. Например, если через олово пропустить ток, то с помощью магнитов можно придавать его поверхности любую форму - только на эту тему сделано несколько сотен изобретений.
9. При выплавке чугуна в домне образуется ишак. Шлак, имеющий температуру 1000°С, спивают в большие ковши и на железнодорожных платформах отвозят на переработку. Расплав шлака — ценное сырье для изготовления строительных материалов. Но затвердевший шлак перестает быть таким сырьем. Снова расплавлять его невыгодно. В ковше сначала весь шлак жидкий, однако при транспортировке на его поверхности образуется и быстро нарастает твердая корка. Приходится пробивать ее с помощью специальных (довольно громоздких) устройств. Корка удерживает часть жидкого шлака. В результате из ковша сливают только 2/3 шлака, остальное идет на свалку. К тому же нужно потратить немало труда, чтобы освободить ковш от затвердевшего шлака, а потом вывезти этот шлак с территории завода. Было бы выгодно сделать ковш с хорошей теплоизоляцией, но она займет много места, ковш станет шире, а это недопустимо при железнодорожных перевозках. Если же сделать теплоизолирующую крышку на ковш, который размером с комнату, то и устанавливать, и снимать ее придется с помощью крана. Предложите решение.
Решение:
Модель задачи: есть раскаленный шлак, а над ним холодный воздух. ИКР: холодный воздух сам не дает застыть шлаку. Применяем прием «обратить вред в пользу»: холодный воздух должен защищать шлак от холодного воздуха.
Какая зона воздуха не соответствует этому требованию? Очевидно, та, которая непосредственно соприкасается с горячей поверхностью расплавленного шлака. Теперь видно физическое противоречие: эта зона (там сейчас слой холодного воздуха) должна быть чем-то заполнена, чтобы задерживать тепло, и эта зона не должна быть ничем заполнена, чтобы можно было свободно заливать и выливать шлак. В подобных случаях не вводят посторонние вещества, а видоизменяют уже присутствующие («использовать принцип однородности») – шлак и воздух. Возможны только три ответа.
Изменять воздух – нагревать тот слой, который лежит у поверхности шлака. Это плохое решение: придется ставить горелки, а они будут загрязнять атмосферу.
Изменять шлак – покрыть поверхность жидкого шлака шариками из твердого шлака. Термоизоляция получится неплохая, но возникает масса неудобств: надо изготавливать шарики, как-то удерживать их в ковше, когда сливается шлак.
Использовать смесь шлака и воздуха – смешать компоненты и получить пену. Отличный теплоизолятор. Залили шлак в ковш, сделали слой пены, получили прекрасную теплозащитную крышку. Сливать шлак можно, не обращая внимания на эту крышку, - жидкий шлак свободно пройдет сквозь пену. Крышка есть, и как бы нет. Задача в принципе решена, нужно выяснить чисто технический вопрос: как получить пену? Простейший способ – при заливке шлака подавать одновременно немного воды. Обратите внимание на парадокс: чтобы шлак сохранил тепло его поливают холодной водой.
10. Хороший термос долго (до 2 суток) хранит тепло, но когда жидкость в термосе остыла, то для нагревания ее необходимо вылить из термоса, нагреть и снова залить. А если для этого нет условий? Почему бы воду не нагреть сразу в термосе? Но колба термоса не герметична, в простенках вакуум. Если в колбу ставить еще один металлический цилиндр, чтобы в нем нагревать воду, вес изделия увеличится. Это грубое решение проблемы. Изобретите термос – чайник.
Решение:
Формулируем техническое противоречие: вакуум в колбе должен быть теплопроводным, когда вода нагревается, и не должен проводить тепло, когда нагревание прекращено. Заменяем слово вакуум на словом вещество: вещество в сосуде должно проводить тепло при нагревании сосуда и быть теплоизолятором при прекращении нагревания. Лучший теплоизолятор тепла – вакуум. Уточняем: вещество появляется при нагревании и проводит тепло; вещество исчезает при прекращении нагревания, образуется вакуум. Для решения этой задачи более всего подходят гидриды металлов, т.к. они обладают способностью поглощать водород при охлаждении и выделять при нагревании. А водород хороший проводник тепла. Итак, в термосе между стенками глубокий вакуум, а на дне - горсть гидрида. Если немного нагреть гидрид, то выделившийся водород станет проводником тепла между стенками. Выключим нагрев, и водород полностью поглотится гидридом, восстановится вакуум. Внутри термоса может быть аккумулятор тепла и холода. По энергоемкости водородные термосы в 20 раз превосходят электробатареи.
Выводы
1. Определена тематика задач по теоретическим основам химической технологии в рамках изучения курса прикладная химия.
2. Составлены и подобраны задачи по выбранным темам.
3. Показано, что при решении задач по прикладной химии студенты испытывают затруднения при математических расчетах с использованием дифференциального и интегрального исчисления, разложением сложного многостадийного процесса в условии задачи на отдельные стадии и проведении расчетов по всей совокупности стадий.
4. Разработана методика решения задач, в качестве примера представлены подробные решения типовых задач каждого раздела и приведены задачи для самостоятельного решения.
5. Показано, что курс прикладная химия, изучаемый на завершающем этапе подготовки будущих учителей химии следует рассматривать как курс обобщения, повторения и систематизации ранее приобретенных химических знаний.
Список литературы
1. Абкин Г.Л. Методика решения задач по химии. М.: Просвещение, 1971. – 200 с.
2. Аликберова Л.Ю., Хабарова Е.И. Задачи по химии с экологическим содержанием. М.: Центрхимпресс, 2001. – 70 с.
3. Андреева М.П. Овладение студентами педагогических ВУЗов методическими приемами обучения учащихся решению задач по химии. // Химия и методика преподавания. 2005, № 3. – С. 23-26.
4. Аранская О.С. Сборник задач и упражнений по химической технологии и биотехнологии. Минск: Университетское, 1989. – 296с
5. Аркавенко Л.Н., Гапонцеа В.Л., Белоусова О.А. Для чего классифицировать расчетные задачи. // Химия в школе. 1998, № 3. – С. 60-63.
6. Артемьев В.П. Задание по методике преподавание химии. Тесты и усложненные задачи (задачи экологического содержания). Пенза, 2002. 122 с.
7. Архангельская О.В., Тюльков И.А. Трудная задача? Начнем по порядку…
// Химия в школе. 2003, № 2. – С. 51-55.
8. Ахметов М.А. Конспект лекции по общей химии. Введение в термодинамику химических реакций. // Первое сентября. 2005, № 15. – С. 35-37.
9. Безуевская В.А. Химические задачи с экологическим содержанием. // Химия в школе. 2000, №2. – С. 59-61.
10. Бердоносов С.С. Конспект лекции по общей химии. Тепловые эффекты химических реакций. // Первое сентября. 2005, №20 – С. 11-18.
11. Бердоносов С.С. Конспект лекции по общей химии. Равновесие. // Первое сентября. 2005, №21. – С. 18-23.
12. Бондарь Д.А., Гариев И.А. Трудная задача? Начнем по порядку… // Химия в школе. 1997, № 3. – С. 44-48.
13. Бондарь Д.А., Тюльков И.А. Трудная задача? Начнем по порядку. // Химия в школе. 1999, №2. – С. 31-34.
14. Бондарь Д.А., Гариев И.А. Трудная задача? Начнем по порядку… // Химия в школе. 1997, № 6. – С. 61-64.
15. Веденяпин А.В. Решение расчетных задач по химии. М.: Просвещение, 1972. – 160 с.
16. Гаврусейко Н.П. Наш опыт решения расчетных задач. // Химия в школе. 1981, № 1. – С. 46-50.
17. Гольдфарб Я.Л., Ходаков Ю.В., Додонов Ю.Б. Сборник задач и упражнений по химии. М.: Просвещение, 1988. – 156 с.
18. Гудкова А.С., Ефремова К.М., Магдесиева Н.Н., Мельчакова Н.В. 500 задач по химии. М.: Просвещение, 1977. – 120 с.
19. Гузеев В.В. О системе задач и задачном подходе к обучению. // Химия в школе. 2001, № 8. – С. 12-14.
20. Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии. М.: Просвещение, 1989. – 176 с.
21. Ерыгин Д.П. Фоминых Н.А. Задачи экологического содержания в курсе органической химии. // Химия в школе. 1992, №5-6. – С. 47-49.
22. Задачи и упражнения по общей химии. Под редакцией профессора Н.В. Коровина. М.: «Высшая школа», 2006. – 155 с.
23. Зуева М.В. Развитие учащихся при обучении химии. М.: Просвещение, 1978. – 184 с.
24. Игнатенков В.И., Бесков В.С. Примеры и задачи по общей химической технологии. М.: ИКЦ «Академкнига», 2005. – 200 с.
25. Керимов Э.Ю. Курс лекций по физической химии: химическая термодинамика. Пенза, 2005. – 104 с.
26. Керимов Э.Ю. Курс лекций по физической химии: химическая кинетика. Пенза, 2004. – 109 с.
27. Кирюшкин Д.М. Методика обучения химии: Просвещение, 1970. 186 с.
28. Климов И.И., Филько А.И. Сборник вопросов и задач по физической и коллоидной химии. М.: Просвещение, 1975. – 190 с.
29. Ключников Н.Г. Практические занятия по химической технологии. М.: Просвещение, 1972. – 165 с.
30. Кудряшов И.В., Каретников Г.С. Сборник примеров и задач по физической химии. М.: Высшая школа, 1991. – 510 с.
31. Кушнарев А.А. Учимся решать задачи по химии. // Химия в школе. 1993,
№ 5. – С. 46-54.
32. Кушнарев А.А. Учимся решать задачи по химии. // Химия в школе. 1994,
№ 2. – С. 44-51.
33. Кушнарев А.А. Учимся решать задачи по химии. // Химия в школе. 1995, № 5. – С. 51-57.
34. Лабий Ю.Н. Решение задач по химии с помощью уравнений и неравенств. М.: Просвещение, 1987. – 80 с.
35. Логинов Н.Я., Ключков Н.Г. Практикум по химической технологии. М.: Просвещение, 1963. – 210 с.
36. Магдесиева Н.Н., Кузменко Н.Е. Учись решать задачи по химии. М.: Просвещение, 1986. – 259 с.
37. Мациевский А.Э. К методике решения задач на тепловые эффекты. // Химия в школе. 1979 № 4. – С. 54-57.
38. Методика преподавания химии. Под редакцией Кузнецовой Н.Е. М.: Просвещение, 1984. – 406 с.
39. Мурзина Т.Б, Оржековский П.А. Новые подходы в обучении решению расчетных задач по химии. // Химия и методика преподавания. 2002, № 8. – С. 28-33.
40. Пичугина Г.В. Задание для самостоятельной работы по курсу прикладной химии. // Химия в школе. 1997, № 3. – С. 29-31.
41. Плетнер Ю.В., Полосин В.С. Практикум по методике преподавания химии. М.: Просвещение, 1981. – 210 с.
42. Протасов П.Н., Цитович И.К. Методика решения расчетных задач по химии. М.: Просвещение, 1978. – 123 с.
43. Радецкий А.М. Задачи с производственным содержанием по органической химии. // Химия в школе. 1996, № 1. – С. 40-41.
44. Соколов Р.С. Химическая технология том 1. М.: ВЛАДОС, 2003. – 363 с.
45. Соколов Р.С. Химическая технология том 2. М.: ВЛАДОС, 2003. – 444 с.
46. Строкатов С.Ф., Майзель В.В., Ильинова Г.Н., Юркъян О.В. Методика решения расчетных химических задач. // Химия в школе. 1999, № 5. С. 60-61.
47. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 2001. – 516 с.
48. Тюльков И.А. Трудная задача? Начнем по порядку… // Химия в школе. 2000, № 3. – С. 56-60.
49. Хомченко Г.П. Пособие по химии для поступающих в ВУЗы. М.: Новая волна, 1997. – 447 с.
50. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в ВУЗы. М.: Новая волна, 2001. – 271 с.
51. Цитович И.К., Протасов П.Н. Методика решения расчетных задач по химии. М.: Просвещение, 1983. – 245 с.
52. Чернобельская Г.М. Методика обучения химии в средней школе. М.: ВЛАДОС, 2000. – 303 с.
53. Чечевицына М.Б. Использование теории решения изобретательских задач // Химия в школе. 2004, № 4. – С. 26-38.
54. Чунихина Л.Л. Из опыта обучения решению расчетных задач // Химия в школе. 1900, № 3. – С. 33-36.
55. Шаповаленко С.Г. Методика обучения химии, М.: Просвещение, 1963. – 660 с.
56. Шишкин Е.А. Пути решения расчетной задачи. // Химия в школе. 2005, № 4. – С. 46-52.
57. Штремплер Г.И Хохлова А.И. Методика решения расчетных задач по химии. М.: Просвещение, 1998. – 195 с.
Дата: 2019-07-30, просмотров: 307.