Функционирование биологических систем основано на реакциях атомов и молекул, протекающих в соответствии с теми же фундаментальными законами физики и химии, которые управляют их реакциями вне организма. Молекулы ДНК были первыми молекулами – они выполняли функции катализа, передачи и хранения генетической информации. Молекулы ДНК – первые молекулы жизни, так как обладают способностью к самокопированию. В основе всех биохимических и биофизических реакций лежат элементарные процессы переноса электрона и протона.
4. Структура воды. Все функциональные реакции клетки протекают в водном окружении. Вода обеспечивает правильную конформацию и функционирование всех клеточных биополимеров. Все вещества в клетке вступают в биохимические реакции только в растворённом виде.Вода наиболее распространённое и наиболее непонятное вещество на планете. В клетке выделяют 2 типа воды:
Свободную (жидкую)
Связанная (льдоподобная)
Уникальные свойства воды связаны со структурой молекулы воды. Молекула воды представляет диполь. Дипольный момент воды чрезвычайно высок м(мю)=1,84 D (Дебая).
Благодаря своей структуре молекула воды способна образовывать 4 водородные связи. Таким образом, вся структура воды пронизана сетью водородных связей.Водородные связи упорядочивают структуру H 2 O .
Существует 2 теории строения воды :
Квазикристаллическая
Микрокристаллическая
Согласно микрокристаллической модели происходит постепенное исчезновение порядка по мере удаления от рассматриваемой молекулы воды. Согласно квазикристаллической модели вода представляет собой набор кластеров (айсбергов, групп), пространство между которыми заполнено свободными молекулами воды. Внутри кластеров вода находится в кристаллическом состоянии. Согласно этой модели, вода представляет собой набор водородносвязанных кластеров и мономерных молекул воды.
Согласно теории кристаллической воды структура воды характеризуется ближним порядком, то есть соседствующие молекулы H 2 O строго ориентированы друг от друга. Дальше молекулы лишены этого порядка.
Молекула H 2 O находится в постоянном движении. Время перескока молекулы воды из одного положения в другое 10-8 секунд.
Грамм белка содержит 0,3- 0,4 грамма связанной воды. Связанная вода образует несколько монослоёв в структуре белка и выполняет роль молекулярной смазки.
В активный центр молек. белка могут входить как аминокислоты находящиеся рядом по полип.цепи, так и оказавшиеся сближенными в резерв сворачивания полип. цепи. Неправильное сворачивание полип.цепи может привести к нарушению или полной потере функциональной активности, к развитию патологий. Молек. белка наход. в пост.движении - это так называемая конформационная подвижность. Функционирование молек. белка связано с определ. конформационными перестройками в его молекуле. Скорость катализируемых белком процессов определяется структурной подвижностью белка. Самый важный структурный переход в мол.белка-это переход между нативным и денатурированным состоянием. Денатурированное состояние-лишенное всякой структуры, так называемый, хаотичический клубок. Исследования процессов денатурации белков дает инф. о стабильности молек. белка. Этот метод основан на регистрации количества тепла, выделяющегося в процессе денатур. белка. Денатурацию белка можно вызвать нагреванием, изменением РН, высокими концентрациями солей, взаимод. с ионами тяж.металлов. Денатур. молек. Белка - фазовый переход 1рода, протекающий по принципу все или ничего т. е. напоминает процесс плавления кристалла.
Динамика белковой молекулы. Изменение конформационного состояния молекулы белка за счет различных внешних воздействий (рН, температура, ионный состав) отражается и на его функциональной активности. Конформационные перестройки происходят весьма быстро. На первых стадиях они носят локальный микроконформационный характер, вызывая смещения лишь отдельных атомных групп.
10. Функции белков. Классификация функций белков. Белковые макромолекулы представляют основные структурные компоненты клетки и межклеточных и внеклеточных образований. В клетке белки выполняют ряд важнейших функций:
1) Каталитическая, или ферментативная (избирательное связывание молекул субстрата и осуществление химических реакций. Белки могут ускорять химические реакции в 106 раз. Предполагают, что существует 200 000 белков);
2) Структурная (строительные компоненты клеточных и внеклеточных структур – коллаген, спектрин); архитектура кл-ки определяется белковым цитоскелетом и липидными бислойными мембранами
3) Энергетическая (форма запасания питательных веществ);
4) Транспортная (альбумин, транспорин, гемоглобин, ферритин,Na+, К+-АТФаза);
5) Сигнальная, или информ-ая – белки - сигнальные мол-лы(инсулин, факторы роста, цитокины, рецепторы) воспринимаемые клеточные сигналы. Белки образуют сигнальные каскады переноса информации в клетке – родопсин, G-белки);
6) Механическая, или двигательная - ф-ия мышечного сокращения (белки-моторчики – актин и миозин, гиразы);
7) Защитная (иммунная - антитело) - иммуноглобулины, МНС, рецепторы на иммунокомпетентных клетках.
8) Регуляторная (регуляторы многообразных клеточных процессов – роста, дифференцировки, пролиферации, экспрессию ген. инф-ии.).
11. Ферментативный катализ. Ферменты-биологические катализаторы, обеспечивающие превращение одних химических веществ в другие (превращение субстрата в продукт за счёт многоточечного связывания субстрата и его активации). Ферменты как биокатализаторы характеризуются чрезвычайно высокой эффективностью. Фермент способен ускорять реакцию в 108-109 раз. Фермент как катализатор участвует в реакции, но не изменяется в ходе ее. Фермент не сдвигает положения равновесия в реакции, а лишь ускоряет достижение равновесия. Ферменты работают в мягких физиологических условиях. Каталитические реакции протекают в активном центре фермента. В состав акт центра могут входить коферменты, а также 3-5 аминокислот. В активном центре про исходит связывание субстрата, его активация, разрыв одиночных связей и образование других. Механизм ферментации заключается в уменьшении энергии активации реакции в присуствии фермента. Это достигается за счет многоточечного связывания субстрата в активном центре фермента. Механизм ферментативного катализа заключ в конформац перестройке молекулы белка фермента в ходе ферментативной реакции. Акт центр ферментв обладает высокой специфичностью – способен связывать только определенный тип молекул субстрата. Фермент и субстрат в ходе реакции образ равновесныйферментно-субстратный комплекс. Все ферменты имеют белковую природу Е+ S ► Е S ► P + E Концентрация субстрата во много раз больше концентрации фермента.
Уравнение Михаэлиса-Ментен.
Уравнение: Сродство фермента к субстрату характеризуется константой Михаэлиса-Ментен.Км= ( k 2 + k 1 )/ k 1 Скорость ферментативной реакции = количеству молекул субстрата (или молей субстрата) превращенных в единицу времени. Уравнение Михаэлиса-Ментен описывает зависимость ферментативного процесса от концентрации субстрата. Любой ферментативный процесс характеризуется 2-мя параметрами: Макс скоростью ферментативной реакции, константой Михаэлиса.
График Михаэлиса-Ментен позволяет одновременно определить Км и Vmax . Км численно= концентрации субстрата, при которой скорость реакции = половине максимальной скорости реакции.
Вместо Графика Михаэлиса-Ментен для определения Км и Vmax используют график двойных обратных координат (график Лайнуивера-Бэрка).
В 90-е годы Фишер предложил теорию точного соотвествия молекулы субстрата активному центру фермента (ключ-замок). 1959г – Кошланд предложил теорию индуцированного соответствия активного центра в молекуле субстрата (рука-перчатка).
13. Механизмы ингибирования. Активность фермента регулируется факторами среды и различного рода эффекторами. Активность фермента зависит от:
· Температуры
· рН срыды
Существует большая группа эффекторов которая связывается с ферментом, блокирует одну из стадий реакции (ингибиторы), либо напротив активируют (активаторы). Ингибиторы бывают:
· обратимые
· не обратимые ( ионы ртути , кобальта, меди и т.д)
Неспецифическое регулирование происходит путем изменения физ-хим условий среды. Регуляция ферм.активности может достигатся также путем 1)экспрессии генов 2) фосфорилирования и дефосфорилирования. Типы ингибиторов:
Конкурентный ингибитор- это ингибитор напоминает молекуле субстрата и конкурирует с субстратом за связывание с активным центром. Конкурентный ингибитор уменьшает срадство фермента к субстрату не влияя на максимальную скорость реакции.
Ингибиторы смешенного типа.
На клеточном – эритроцит обеспечивает циркуляцию Hb в кровотоке предотвращая окисление Hb и обеспечивает необходимую концентрацию регуляторов (2,3ДФГ).
4. на тканевом (изменяя скорость кровотока).
Эритроцит передает иону Fe гемма информацию об обеспеченности организма О2.
Мед гемоглобин содержит Fe (///) не способен обратимо связывать мол. О2.
Формы молекулы Hb :
1. дезоксиформа (Hb)
2. оксиформа (Hb(O2)4)
Медформа (Hb(Fe( /// ))
Карбогемоглобин (HbCO)
Fe (//) способна образовывать 6 кординационных связей, 4 связи ион Fe гемма образует в плоскости гемма с 4 атомами азота. 5-ая кардиционная связь образуется ионами Fe гемма с атомами азота гистидина полипептидной цепи гемоглобина. 6-ая кординацционная связь образуется с молекулой О2
Связывание ионам Fe молекулы O 2 приводит к изменениям объёма иона Fe , выходу иона Fe из плоскости гемма это приводит к перемещению молекулы гистидина в гемоглобин. Вся структура молекулы белка гемоглобина претерпевает функционально-направленное изменение, дезокси -гемоглобин превращается в окси-гемоглобин.
НК содержат пентозы.
В первичной структуре ДНК нуклеотиды связываются между собой фосфодиэфирными мостиками, которые связывают 5’ гидроксильную группу одного нуклеотида и 3’ гидроксильную группу другого нуклеотида, т.е. состав молекулы ДНК представляет сахарный остаток фосфорной к-ты.
| Белки | Нуклеиновые к-ты |
| Молекулярная масса 100кД | Несколько тысяч кД |
| 4 уровня структурной организации | 3 уровня структурной организации |
| Выполняют много ф-ций | 1ф-ция – хранение и передача генетической информации. |
| Характерна разнообразная структура | 1структура – 2правазакрученная спираль. |
Исследование Э.Чаргоффа и других ученых сделавших след. выводы: 1)нуклеотидный состав ДНК разных тканей одного и того же вида одинаков. 2)нуклеотидный состав ДНК у разных видов различен. 3)нуклеотидный состав не зависит от возраста и питания. 4)в составе ДНК число остатков аденина всегда равно числу остатков остатков тимина, а число остатков гуанина равно числу остатков цитозина.
Вторичная стр-ра ДНК.В 1944 Эвери, Маклеод, Маккарти доказали, что ДНК – носитель генетической информации. 1953 – Уотсон и Крик предложили теорию двойной спирали, которая позволяет объяснить механизмы хранения, трансформации и реализации генетической информации.
Нуклеотиды связаны в молекуле ДНК фосфорноэфирной связью. Взаимодействие двух полинуклеотидных цепочек молекулы ДНК обеспечивается комплементарностью. Основную роль в этом играют водородные связи, так же важную роль играют гидрофобные взаимодействия, стэкинг взаимодействия, дипольные взаимодействия π-связей.
Молекулы ДНК представляют двойную правозакрученную спираль. При этом плоскости азотистых оснований лежат перпендикулярно оси спирали. На внешней стороне двойной спирали расположены остатки дезоксирибозы и фосфорной к-ты.
Полиморфизм – это разнообразие формы молекулы ДНК. Стандартная конформация мол-лы ДНК – это В-конформация. Основания располагается перпендикулярно оси спирали на расстоянии 0,36 нм. А-конформация получается из В-конформации при ее дегидротации. Z -конформация – это левозакрученная спираль. С-тип.
Денатурация происходит при действии химических факторов и физических факторов. Денатурированный белок приобретает свою нативную структуру – ренатурация. Денатурация при действии температуры – плавление ДНК. Температура плавления зависит от нуклеотидного состава.
Гиперхромный эффект – увеличение оптической плотности ДНК при плавлении ДНК. Максимальное повышение оптической плотности раствора ДНК при длине волны 260 нм приблизительно равно 80%, при полном распаде ее до мононуклеотидов.
Хроматин состоит из многих витков ДНК, присоединенных к гистонам – белкам основной природы. В период между делениями, хромосомы практически неразличимы в световом микроскопе как обособленные структуры, хотя материал, из которого они состоят, окрашивается некоторыми основными красителями и потому назван хроматином. На этой стадии хромосомы представляют клубок длинных тонких нитей.
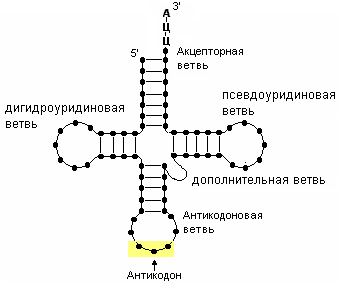 17. Нуклеосомы- структурная единица хроматина, связываются линкерными участками. Последовательность нуклеосом, соединенная гистоновым белком H1, формирует нуклеосомную нить. Гистоны – ядерные белки, на них навивается молекула ДНК, выполняющие две основные функции-они участвуют в упаковке нитей ДНК в ядре и регулируют такие ядерные процессы, как транскрипция, репликация и репарация. Существует пять различных типов гистонов H1/Н5(линкерные), H2A, H2B, H3, H4. Классификация РНК: информационная- Открыта в 1961 году Жакобом и Мано. Она составляет всего 2-3% от общего количества РНК клетки. Н есет информацию о первичной структуре белка служат матрицами для биосинтеза полипептидных цепей. Они содержат линейную последовательность кодонов, которые и определяют первичную структура белка.иРНК –одноцепочечные молекулы. Одна молекула иРНК может кодировать одну или несколько полипептидных цепей.Если иРНК несет информацию об одной полипептидной цепи, то ее называют моноцистронной (эукариот), если о двух или более – полицистронной (прокариот). В нерабочем состоянии м-РНК свернута в клубок, связана с белком; а во время функционирования цепь расправляется. Матричные РНК синтезируются на ДНК в ядре. Процесс называется транскрипция (списывание); транспортная- обеспечивает расшифровку ген. инф., записанной в иРНК и доставку АК к месту синтеза белка. На 3’-конце всех тРНК находится тринуклеотидная последовательность Ц-Ц-А. Более половины оснований тРНК образуют внутрицепочечные пары по принципу комплементарности. Т.о., формируется вторичная структура- клеверный листок.
17. Нуклеосомы- структурная единица хроматина, связываются линкерными участками. Последовательность нуклеосом, соединенная гистоновым белком H1, формирует нуклеосомную нить. Гистоны – ядерные белки, на них навивается молекула ДНК, выполняющие две основные функции-они участвуют в упаковке нитей ДНК в ядре и регулируют такие ядерные процессы, как транскрипция, репликация и репарация. Существует пять различных типов гистонов H1/Н5(линкерные), H2A, H2B, H3, H4. Классификация РНК: информационная- Открыта в 1961 году Жакобом и Мано. Она составляет всего 2-3% от общего количества РНК клетки. Н есет информацию о первичной структуре белка служат матрицами для биосинтеза полипептидных цепей. Они содержат линейную последовательность кодонов, которые и определяют первичную структура белка.иРНК –одноцепочечные молекулы. Одна молекула иРНК может кодировать одну или несколько полипептидных цепей.Если иРНК несет информацию об одной полипептидной цепи, то ее называют моноцистронной (эукариот), если о двух или более – полицистронной (прокариот). В нерабочем состоянии м-РНК свернута в клубок, связана с белком; а во время функционирования цепь расправляется. Матричные РНК синтезируются на ДНК в ядре. Процесс называется транскрипция (списывание); транспортная- обеспечивает расшифровку ген. инф., записанной в иРНК и доставку АК к месту синтеза белка. На 3’-конце всех тРНК находится тринуклеотидная последовательность Ц-Ц-А. Более половины оснований тРНК образуют внутрицепочечные пары по принципу комплементарности. Т.о., формируется вторичная структура- клеверный листок.
В ней выделяют: 1)дигидроуридиловую ветвь; 2)псевдоуридиловую ветвь, содержащую минорные азотистые основания псевдоуридина; 3) антикодоновую ветвь, в центре которой находится антикодон (комплементарен кодону); 4)дополнительную ветвь; 5)акцепторную ветвь с универсальной 3'-концевой последовательностью ЦЦА, служащей акцептором остатка аминокислоты; рибосомальная- входит всостав рибосом, определяют их структуру, обуславливает количество синтезируемого белка, занимают большую часть РНК в клетке 80-85%. Рибосомы представляют собой - крупный рибонуклеопротеидный комплекс с молекулярной массой около 2,5 мДа, состоящий из белков и молекул рРНК. Уэукариот они представлены 80S частицами, у прокариот – 70S . Рибосомы всех известных организмов построены из большой и малой субчастиц: прокариотические – 30S и 50S, а эукариотические – 40S и 60S. рРНК играют важную роль в структуре и биосинтетической функции рибосом.
Макромолекулярная структура РНК: линейный полимер нуклеотидов. Каждый мономер - нуклеотид - представляет собой фосфорилированный N-гликозид, построенный из остатка пятиуглеродного сахара - пентозы, несущего фосфатную группу (сложноэфирная связь) и азотистое основание при первом углеродном атоме (N-гликозидная связь). Азотистых оснований в РНК четыре вида: два пуриновых - аденин (А) и гуанин (G) -и два пиримидиновых - цитозин (С) и урацил (U).
18.Функции нуклеиновых кислот: хранение, передача и реализация генетической информации, так же участвуют в катализе некоторых химических реакций, осуществляют регуляцию реализации генетической информации, выполняют структурные функции и т.д. Роль хранителя генетической информации у большинства организмов (эукариот, прокариот, некоторых вирусов) выполняют двухцепочечные ДНК. Только у некоторых вирусов хранителем генетической информации являются одноцепочечные ДНК или одноцепочечные, а также двухцепочечные РНК. Генетическая информация записана в генах. Гены несут информацию о первичной структуре белков и о структуре некоторых типов РНК. Генетическая информация передается от родителей к потомкам. В результате реализации генетической информации происходит синтез белка: ДНК ® РНК ® белок . Основная догма в процессе размножения клеток генетическая информация передается от одного поколения клеток другому. Все клетки получают одинаковую информацию.
РЕГУЛЯТОРНЫЙ ГЕН (ген-регулятор)- это ген, регулирующий производство других генов. Регуляторные гены активизируют и угнетают группу соседних генов, называемую ОПЕРОН, которая функционирует как единое целое. Встречающиеся обычно у БАКТЕРИЙ, опероны отвечают за формирование ФЕРМЕНТОВ, регулирующие различные процессы обмена веществ. Оперон – группа следующих друг за другом генов, экспрессия которых одновременно регулируется определёнными участками молекулы ДНК-оператор.
Это возможно вследствие того, что перед делением клетки осуществляется репликация ДНК, в результате образуются две идентичные молекулы ДНК, которые и передаются потомкам.
Транскрибируемый участок ДНК ограничен со стороны 3’-конца промотором – участком с которым связывается РНК-полимераза, со стороны 5’-конца – терминатором – участком, в котором прерывается синтез РНК. Последовательность ДНК, ограниченная промотором и терминатором, представляет собой единицу транскрипции – транскриптон. Транскриптон прокариот называют опероном.
Механизм репликации. В основе лежит принцип комплементарности. В результате образуются дочерние молекулы НК, нуклеотидные последовательности которых идентичны между собой и с материнской молекулой. Типы репликации: 1)Полуконсервативный – вновь синтезированная молекула НК состоит из одной материнской и одной дочерней полинуклеотидных цепей НК.2)Консервативный – вновь синтезированная молекула НК состоит только из дочерних полинуклеотидных последовательностей.3)Дисперсный – вновь синтезированная полинуклеотидная цепь НК состоит из фрагментов дочерних и материнских полинуклеотидных последовательностей. Дляпрокариот и эукариот характерен полуконсервативный тип репликации. У вирусов встречаются все три типа репликации.
Механизм репликации требует наличие следующих компонентов: 4-х нуклеотидов; АТФ и Mg ; ДНК-полимераза(1-го типа, присоединяется очередной нуклеотид к 3’-гидроксильной группе растущей полинуклеотидной цепи); затравка (матричная молекула ДНК с разорванной в нескольких местах цепью).
19. Экспрессия генов включает транскрипцию (коп.инф. с ДНК на синтезируемую РНК) и послед. трансляцию (синтез на матрице РНК соотв. белка), репликацию (удвоение мол. ДНК при делении кл-ки). Возможен поток инф. и в напр. от РНК к ДНК, этот процесс носит название обратная транскрипция. Инф. от белков НК не передается. Ген - единица насл. инф., занимающая опред. положение в геноме и контрол. выполнение опр. ф-ций в ор-ме. Гены – уч-ки ДНК, кодир. полип.цепи или РНК. Белок, сост. из разл. полип.цепей, код. неск. генами.Гены могут быть уникальными – предст. одной копией – и повт-ся.Все гены можно разделить на две группы: 1)Конститутивные гены («гены домашнего хозяйства») постоянно включены: они функц. на всех стадиях онтогенеза и во всех тканях (тРНК, рРНК, ДНК-полимеразы, РНК-полимеразы). 2) Индуцибельные гены («гены роскоши») могут включ. и выкл-ся. Они контр.ход онтогенеза и гены, опред. ст-ру и ф-ции комп-в кл-ки и целостного орг-ма. Включ. индуц. генов назыв. индукцией, выкл. – репрессией. Генет. код св-ва:1)Триплетность. Кодон сост. из посл-ти, состоящей из трех нуклеотидов. Число кодирующих послед.из четырех нуклеотидов по три равно 43=64, из них 61 – смысловых кодонов, - 3 нонсен-кодона. 2)Выражденность. Каждый из 61 смысловых триплетов кодирует вкл. в белок одну из 20 станд. АК. Вкл. одной и той же АК в белок определяет неск. кодонов. 3)Специфичность (однозначность).Каждому кодону соотв. только одна опред. АК. 4)Неперекрываемостькода след.за иниц. кодоном АУГ триплеты читаются посл-но не перекрываясь без каких либо пропусков вплоть до стоп-кодона, на кот. синтез полип. цепи завершается. 5)Универсальность кода т.е. смысл кодов одинаков для всех орг-в . В пр-се транскр. выделяют три стадии: инициацию, элонгацию и терминацию. На стадии иниц. РНК-полимераза, взаимод. с промотором, вызывает расхождение цепей ДНК и начинает синтез мол. РНК. В ходе элон. новая синтезир. цепь РНК образует короткие отрезки гибридной двойной спирали ДНК-РНК, кот.необходимы для правильного считывания цепи ДНК. Как только РНК-полимераза достигнет терминирующих послед., запускается последняя стадия – терминация. По ее завершению происх. освоб. вновь синтез.цепи РНК.
20. Механизм трансляции. Разл-ют несколько стадий биосинтеза белка: активация АК, инициация, элонгация и терминация. Синтез белка хар-тся тем, что между матрицей (иРНК) и продуктом (белком) нет комплем-го соответствия. Для расшифровки нукл. послед.необходим генет. код. Он устан. соотв-ие между нукл. послед.иРНК и полип. цепью. Единицей ген. кода является кодон. Кодон предст. собой послед-ть, сост. из трех нуклеотидов, т.е. триплет. Три кодона служат сигналом для остановки синтеза полип.цепи - терминирующие, или нонсенс-кодоны. Каждому кодону (из 61) соотв. строго опред. АК. Тран-ия иРНК начинается с иниц-го триплета – АУГ. Далее расшифр-ся каждый послед.триплет в напр-ии от 5’-конца молекулы иРНК к 3’-концу. Закан-ся синтез полип-да на 1 из 3-х термин-их кодонов. Синтез полип.цепи нач-ся с N -конца.Активация АК 1.На этой стадии каждая из 20 АК присоединяется к опр-ой тРНК. При этом исп-ся энергия АТФ. 2.Эти р-ции катализ-ся 20 разл. аминоацил-тРНК-синтетазами. 3.Аминоацил-тРНК-синтетазы способны узнавать 3 разл. субстрата: АТФ, АК-у и тРНК.4.Каждая аминоацил-тРНК-синтетаза способна узнавать только 1 опр. АК и соотв-ие ей тРНК, в кл-е имеется неск. изоакцепторных тРНК5.Они прис-ют АК остаток к 2’- или 3’-гидроксильной группе 3’- концевого нукл-да. 6.Р-ция прот. в 2 стадии
Инициация белкового синтеза. Иниц-ия нач-ся с присоед. к малой субъ-це рибосомы иРНК и 1-ой аминоацил-тРНК (аа-тРНК), антикодон кот.ком-рен иниц. кодону АУГ. После связывания антикодона тРНК с иниц. кодоном происх. присоед. большой субъединицы рибосомы. Образ. инициирующий комплекс, в кот. иниц. а-тРНК находится в Р (пептидильном)-центре, а А (аминоацильный) – центр свободен.Для осущ. инициации трансляции необходима энергия. Ее поставляет ГТФ. Энергия высв-ся при гидролизе ГТФ до ГДФ и фосфата. Элон. белкового синтеза. В пр-се элон. происходит наращивание полип.цепи. В А-центре происх. связывание след.аа-тРНК, антикодон кот. ком-рен след. кодону. Далее происх.образов. пепт. связи за счет пептидилтрансферазной р-ции. В рез-те образ.дипетидил-тРНК. Катализирует этот процесс рРНК большой субъединицы рибосомы.
Далее рибосома пер-ся на один кодон в напр. от 5’- к 3’-концу мРНК. Дипептидил-тРНК из А-центра перем-ся в Р-центр А-центр освобождается, здесь оказывается следующий кодон. Иниц. тРНК покидает рибосому. Рибосома готова к новому циклу элон. Далее присоед. третий АК остаток, потом – четвертый и т.д. В пр-се транс.затрачивается энергия, освоб. при гидролизе ГТФ до ГДФ и фосфата. Терминация.Терм. белового синтеза наступает, как только в А-центре окажется один из термин. кодонов: УАГ, УГА, УАА. В этом пр-се участвуют специф. белки – ф-ры терм. В рез-те терм. происх.гидролит. отщепление полипептида от тРНК, тРНК отдел. от рибосомы, рибосома диссоциируют на субъединицы. Поставщиком энергии для терминации синтеза белка явл. ГТФ. Рибосомы. Риб-мы предст. собой - крупный рибонуклеопротеидный комплекс с молек-ой массой около 2,5 мДа, сост-ий из белков и молекул рРНК. Риб-мы прокарио-их и эукариот-их организмов разл-ся по размерам.
21.Хим с-в биомембран. Стр-ра и ф-ции липидов. Мембрана (лат.перепонка)- тонкая плаская ст-ра толщиной 7-10нм состоящая из бислоя фосфолипидов и отделяющая цитоплазму клетки от внешней среды и клеточные органеллы др. от др. Состав мембран зависит от их типа и функций, однако основными составляющими являются Липиды и Белки, а также Углеводы (небольшая, но чрезвычайно важная часть) и вода (более 20% общего веса).
Липиды – группа органических соединений, которая характеризуются: нерастворимостью в воде; растворимостью в неполярных растворителях (эфир, хлороформ, бензол); содержанием высших алкильных радикалов; распространенностью в живых организмах. Функции: 1. основные компоненты биологических мембран (влияют на их проницаемость, участвуют в передаче нервного импульса, создании межклеточных контактов); 2.эффективный источник энергии (непосредственное использование либо запасы жировой ткани); 3.создание термоизоляционных покровов у животных и растений; 4.защита органов и тканей от механических воздействий.
КЛАССИФИКАЦИЯ ЛИПИДОВ
A. Простые липиды: сложные эфиры жирных кислот с различными спиртами. 1.Глицериды представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. 2. Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов.
Б. Сложные липиды: сложнее эфиры жирных кислот со спиртами, дополнительно содержащие и другие группы. 1.Фосфолипиды: липиды, содержащие, помимо жирных кислот и спирта, остаток фосфорной кислоты. В их состав часто входят азотистые основания и другие компоненты: а)глицерофосфолипиды (в роли спирта выступает глицерол); б) сфинголипиды (в роли спирта - сфингозин). 2. Гликолипиды (гликосфинголипиды). 3.Стероиды.4.Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины.
Фосфолипиды представляют 3-атомный спирт глицерин, у которого 2-ОН группа этерифицирована остатками длинноцепочечных жирных кислот, а 3-ОН группа этерифицирована остатками фосфорной кислоты. В состав фосфолипидов входят также азотсодержащие соединения холин, этаноламин или серии. Фосфолипиды — амфифильные вещества. Они состоят из полярной «головки», в состав которой входит глицерин или другой многоатомный спирт, отрицательно заряженный остаток фосфорной кислоты и часто несущая положительный заряд группа атомов, и двух неполярных «хвостов» из остатков жирных кислот. Главная особенность фосфолипидов состоит в том, что «головка» у них гидрофильна, а «хвосты» гидрофобны. Это позволяет при нахождении в толще водной среды образовывать бислой — двойной слой фосфолипидных молекул, где гидрофильные головы с обеих сторон соприкасаются с водой, а гидрофобные хвосты упрятаны внутрь бислоя и тем самым защищены от контакта с водой.
Гидрофобность — это физическое свойство молекулы, которая «стремится» избежать контакта с водой. Сама молекула в этом случае называется гидрофобной. Гидрофобные молекулы обычно неполярные и «предпочитают» находиться среди других нейтральных молекул и неполярных растворителей. Гидрофильность — характеристика интенсивности молекулярного взаимодействия вещества с водой, способность хорошо впитывать воду, а также высокая смачиваемость поверхностей водой.
22. Физ-хим хар-ка липидов. Одна из важнейших функций липидов состоит в использовании их в качестве энергетического материала. Липиды обеспечивают 25-30% всей энергии, необходимой для организма. В процессе полного распада 1 г жира выделяется 38,9 кДж энергии. В процессе окисления жиров происходит высвобождение большого количества энергии, именно она и идёт на образование АТФ. Большая часть энергетических запасов организма хранится именно в форме липидов, а расходуется в случае недостатка питательных веществ. Так, например животные впадают в зимнюю спячку, а на поддержание жизнедеятельности идут жиры и масла предварительно накопленные. Благодаря высокому содержанию липидов в семенах растений развивается зародыш и проросток до тех самых пор, пока не будет самостоятельно питаться. Семена таких растений, как кокосовая пальма, клещевина, подсолнечник, соя, рапс - являются сырьём, из которого делают растительное масло промышленным способом.
23. Липидный бислой. Липосомы. Мембрана представляет двойной липидный бислой икрустированный интегральными белками, опирающийся на каркас из периферических белков. Толщина липидного бислоя 6-10нм. Снаружи л.б. окружен слоем гликокаликса, образованного углеводными фрагментами гликолипидов и гликопротеинов. Основу л.б. составляют молекулы фосфолипидов, представляющие ацелглицерол, у которого одна гидроксильная группировка этерифицирована остатком фосфорной к-ты. В свою очередь остаток фосфорной к-ты этерифицирован каким-либо спиртом (этанолом, холин, серин). Осн. св-во фосфолипидов это их амфифильность. В молекуле фосфолипида часть молекул обладает гидрофобными св-ми (неполярный хвост), часть обл. гидрофильными св-ми (полярная голова). Помимо фосфолипидов в липидный бислой входят молекулы холестерина, имеющие размеры близкие к размерам фосфолипидов. Холестерин заполняет пустоты в мембране придавая ей необход. жесткость. Самый важный структурный переход в мембране - это переход между твердым кристаллическим состоянием и жидко-кристалическим. Этот переход называется фазовым переходом в мембране. Зависит от состава мембраны и лежит в физиологическом диапазоне температур.
Липосомы, или фосфолипидные везикулы (пузырьки), получают обычно при набухании сухих фосфолипидов в воде или при впрыскивании раствора липидов в воду. При этом происходит самосборка бимолекулярной липидной мембраны. Минимуму энергии Гиббса отвечает замкнутая сферическая одноламеллярная форма мембраны. При этом все неполярные гидрофобные хвосты находятся внутри мембраны и ни один из них не соприкасается с полярными молекулами воды. Однако чаще получаются несферические многоламеллярные липосомы, состоящие из нескольких бимолекулярных слоев, — многослойные липосомы.
24. Природные мембраны. Классификация. Биологич. мембраны (БМ) обеспечивают протекание важнейших пр-сов в к-ке: рецепция внешнего сигнала, проведение нервных импульсов, деление к-ки, иммунная защита и др. Общ.площадь БМ в организме чел-ка – несколько десятков тысяч га. Мембрана (лат.перепонка) – тонкая квазикристалическая стр-ра, толщиной 7-10нм, состоящая из бислоя фосфолипидов, инкрустированного молекулами белка, которые отделяют цитоплазму клетки от внешней среды и клеточные органеллы друг от друга. Классификация: 1. Биологические; 2. Искусственные. БМ: плазматические (окружают всю клетку) - поверхностные, митохон., ядерн., микросомальные (окружают эндоплазматический ретикулум), специализированные мембраны (предназначены для выполнения специализир. функций: мембрана фоторецепторов, зрительных нервов, мембрана нефрона).
Основные ф-ции БМ: 1. Барьерная – обеспечивает избирательный перенос в-ва в к-ку; 2. Структурная – мембрана это важнейший структурный элемент к-ки. Любое повреждение м-ны приводит к нарушению функционирования и далее к гибели к-ки; 3. Матриксная – роль основы или матрицы для протекания большинства биохим пр-сов, в которую встроены важнейшие клеточные с-мы: рецепторы, ферменты, транспортеры; 4. Сигнальная, регуляторная, рецепторная – место локализации с-мы рецепторов воспринимающих внешний сигнал и обеспечивающих перенос сигнала внутрь клетки.
Активный транспорт – представляет перенос в-ва против градиента конц-ии, т.е. из области с меньшей конц-ей в область с большей. Т.к. такой перенос термодинамически невыгоден, он требует затрат энергии, т.е. гидролиза АТФ. Белки-переносчики, осущ-щие этот процесс – АТФ-азы.
H+-АТФаза – обеспечивает кислую среду желудка
Na+,K+-АТФаза– поддержание ионных градиентов на плазматич м-не к-ки.
До 30-40% клеточной энергии расходуется на активный транспорт.
Синапсы. Синапс – специализированная ст-ра, обеспечивающая передачу возбуждающих или тормозных влияний с одной возбудимой кл-ки на другую (контакт 2-х нервных клеток или нервной и моторной). Это может быть передача возбуждения или торможения с одной нервной кл-ки на другую, с нервной кл-ки на волокно скелетной или гладкой мышцы, а также с рецепторной кл-ки на нервное волокно.
В синапсе происходит преобразование электрического сигнала в химический.
Синапс состоит из 1)пресинаптической мембраны (внутри имеются везикулы, содержащие нейромедиаторы – норадреналин, ГАМК, ацетилхолин и т. д.) 2) синаптическая щель и 3)постсинаптическая мемб. (содержит специфические рецепторы, реагирующие с нейромедиаторами).
По механизму передачи возбуждения синапсы подразделяют на электрические, химические, смешанные. В электрических синапсах возбуждение передается электротонически, за счет локальных круговых токов м-ду пре- и постсинаптическими м-ми. Эти м-ны находятся очень близко друг к другу (на расстоянии 1-2нм), м-ду ними существуют целевые контакты, обладающие хорошей электропроводностью. Большинство синапсов в организме человека – химические.
По признаку медиатора (в-ва-посредника), выделяемого в синапсах, их подразделяют на: холинэргические – ацетилхолин, адренергические – адреналин и норадреналин и др. Медиаторами могут быть дофамин, аминокислоты глутамин и аспарагин, выполняющие возбуждающую функцию в нервных центрах. Тормозные влияния передаются чаще всего нейромедиаторами глицином и гамма-аминомасляной кислотой (ГАМК).
В передаче возбуждения в синапсах могут участвовать пептиды: в-во П, ВИП ( вазоинтестинальный пептид), соматостатин, эндорфины, энкефалины. Эти в-ва выделяются вместе с основным медиатором (ацетилхолином, норадреналином, серотонином) и оказывают модулирующее действие на передачу возбуждения в синапсе.
31. Биофизика регуляторных пр-сов. Нервная регуляция - координирующее влияние нервной системы (НС) на клетки, ткани и органы, приводящее их деятельность в соответствие с потребностями организма и изменениями окружающей среды; один из основных механизмов саморегуляции функций. Вследствие Н. р. деятельность клеток и органов может инициироваться, прекращаться, усиливаться, ослабляться; могут меняться функциональное и биохимическое состояние клеток и органов, особенности их строения. Возникшее в какой-либо из клеток возбуждённое состояние поверхностной мембраны может иногда распространяться, охватывая клетку за клеткой (так называемое нейроидное проведение — процесс, по ионному механизму схожий с проведением импульса нервного). Н. р. может быть быстрой и локальной. Это обеспечивается тем, что при Н. р. медиатор выделяется из нервных окончаний прямо на иннервированные клетки, а также тем, что выделение медиатора вызывается быстро распространяющимся сигналом — нервным импульсом. Между Н. р. и гормональной регуляцией нет резкой границы, некоторые нервные окончания выделяют активные вещества в кровь. Быстрота и адресованность Н. р. особенно важны при регуляции движений, поэтому НС хорошо развита у организмов с совершенной локомоцией. Под нервным контролем находятся как исполнительные (эффекторные), так и чувствительные (рецепторные) органы и клетки, а также все вегетативные функции. Н. р. распространяется и на ткани, обеспечивающие метаболические потребности организма (например, жировая ткань). Чтобы медиатор мог подействовать на клетку, она должна быть чувствительной к нему, т. е. иметь соответствующие рецепторы. Так, в скелетной мышце позвоночных на поверхности каждого мышечного волокна расположены так называемые холинорецепторы, которые вступают во взаимодействие с медиатором двигательных нервных окончаний — ацетилхолином. В результате реакции между медиатором и рецептором меняется ионная проницаемость поверхностной мембраны иннервированной клетки. При этом изменяются ионный состав цитоплазмы и мембранный потенциал, вследствие чего специфическая деятельность клетки усиливается или угнетается.
Гуморальная регуляция - координация физиологических и биохимических процессов, осуществляемая через жидкие среды организма (кровь, лимфу, тканевую жидкость) с помощью биологически активных веществ (метаболиты, гормоны, гормоноиды ионы), выделяемых клетками, органами и тканями в процессе их жизнедеятельности. У высокоразвитых животных и человека Г. р. подчинена нервной регуляции и составляет совместно с ней единую систему нейрогуморальной регуляции. Продукты обмена веществ действуют не только непосредственно на эффекторные органы, но и на окончания чувствительных нервов (хеморецепторы) и нервные центры, вызывая гуморальным или рефлекторным путём те или иные реакции. Так, если в результате усиленной физической работы в крови увеличивается содержание CO2, то это вызывает возбуждение дыхательного центра, что ведёт к усилению дыхания и выведению из организма излишков CO2. Гуморальная передача нервных импульсов химическими веществами, т. н. медиаторами, осуществляется в центральной и периферической нервной системе. Наряду с гормонами важную роль в Г. р. играют продукты межуточного обмена.
Мембранная регуляция. Плазматическая мембрана обеспечивает сохранение разности концентраций метаболитов и неорганических ионов между внутриклеточной и внешней средой. Контролируемый транспорт метаболитов и ионов определяет внутреннюю среду, что существенно для гомеостаза, т.е. поддержания постоянной концентрации метаболитов и неорганических ионов, и других физиологических параметров. Регулируемый и избирательный транспорт метаболитов и неорганических ионов через поры и посредством переносчиков становится возможным благодаря обособлению клеток и органелл с помощью мембранных систем.
В мембранах на границе между липидной и водной фазами локализованы ферменты. Именно здесь происходят реакции с неполярными субстратами. Примерами служат биосинтез липидов и метаболизм неполярных ксенобиотиков. В мембранах локализованы наиболее важные реакции энергетического обмена, такие, как окислительное фосфорилирование (дыхательная цепь) и фотосинтез.
Рецептор сод-т высокоспецифический центр связывания гормона. Взаим-е гормона с рецептором приводит к активации рецептора. Активированный рец-р взаим-ет с G-белком (GTP, ГТФ-связывающий белок). G-белок с ГТФ нах-ся в активном состоянии, а с ГДФ- в неактивном.
G-белок наз-т трансдуктором, т.к. переносит сигнал от рецептора к белку-эффектору (аденилатциклаза - А). А катализир-т цАМФ виз АТФ. цАМФ принадлежит ко вторичным мессенджерам. Помимо цАМФ в роли вторичных мессенджеров могут выступать: диацилглицерол (ДАГ), иназитолтрифосфат (IP3), Са2+, NO.
Специализацию сигнала,
Его многократное усиление
В итоге любой внеклеточный сигнал приводит к:
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано минимум пять хорошо изученных белков: 1) рецептор гормона; 2) фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ); 3) G-белок, осуществляющий связь между аденилатциклазой и рецептором; 4) цАМФ-зависимая протеинкиназа, катализирующая фосфорилирование внутриклеточных ферментов или белков-мишеней, соответственно изменяя их активность; 5) фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала.
Термодинамика стационарных состояний. Ур-е Онзагера. Идеальные пр-сы, протекающие в физических с-мах – пр-с, сост-щий из набора равновесных состояний. Равновесный пр-с – обратимый пр-с, при котором с-ма проходит через набор одних и тех же состояний двигаясь как в прямом, так и в обратном направлении. Биол. с-мы от простейших субклеточных органелл и биомолекул до биосферы не нах-ся в равновесном состоянии. Биос-мы – неравновесные открытые с-мы, поск. они явл. функционир с-ми. Равновесные с-мы могут нах-ся в неизмененном сост сколь угодно долго, т.к. они не взаимод с ОС. Равновесные с-мы описывают равновесной термодинамикой. Неравновесные с-мы, обменив с ОС, описыв неравновесной термодинамикой или биологич термод-кой.
Для описания с-м ненах-ся в равновесии вводят понятие термодин силы (X) и термодин потока ( J ). Термодин силы – чаще всего градиенты (концентрации, температуры, давления, хим потенциал), которые вызывают перенос в-ва, тепла, хим р-ции и т.д., т.е. различные пр-сы. Термодин поток – любой пр-с, протек в с-ме: хим превращ в-ва, диффузия, перенос теплоты.
Ур-е Онзагера (1931)Феноменологическое уравнение: термодинамический поток Ј прямопропорционален термодинамической силе Х, вызывающей этот поток. Онзагер док-л, что величина термодинам потока прямо пропорциональна термодин силе, его вызывающей: Ј = L * Х,где L – феноменологический коэффициент (коэф-т пропорциональности).В с-ме протекает і процессов, где і изменяется от 1 до n .
Ј і = L і * Х і; Ј і = L і k * Х k ; Ј k = Lk і * Х і.
Диссипативная система (или диссипативная структура, от лат. dissipatio — «рассеиваю, разрушаю») — это открытая система, которая оперирует вдали от термодинамического равновесия. Иными словами, это устойчивое состояние, возникающее в неравновесной среде при условии диссипации (рассеивания) энергии, которая поступает извне. Диссипативная система иногда называется ещё стационарной открытой системой или неравновесной открытой системой. Диссипативная система характеризуется спонтанным появлением сложной, зачастую хаотичной структуры. Отличительная особенность таких систем — несохранение объёма в фазовом пространстве, то есть невыполнение Теоремы Лиувилля. Термин «диссипативная структура» введен Ильёй Пригожиным.
38. Наружн и внутр м-на митохондрий. Митохондрии содержатся в цитоплазме клетки и представляют собой микроскопические палочковидные образования. Внутреннее пространство мит. окружено 2 мембранами: наружная-гладкая, внутренняя–кристы(складки). В митохондриях сосредоточено большое количество ферментов. Наружная мембрана не содержит не одного из компонентов дых.цепи. Внутр. Мембрана – ферменты дых.цепи. С внутренней мембраной митохондрии связано аккумуляция части освобождающейся энергии. Клетка использует хим. тип энергии, хранящийся в виде хим. связей. В митохондриях энергия окисления субстратов используется для синтеза макроэргических связей, к-рые используются для окислительного фосфорилирования (на внутр. мембране митохондрий). В 1961 Питер Митчелл сформулировал хемио-осматическую гипотезу. Смысл гипотезы: в ходе окисления субстратов происходит генерация трансмембранного электро-хим. потенциала, связанного с возникновением протонного градиента на мембране. Далее этот протон.градиент используется для синтеза АТФ. В ходе окисления субстратов электроны переносятся на молекулу кислорода и она восстанавливается до молекулы воды. О2+4е=Н2О Поток электронов вдоль внутр. мембраны митохондрий создает градиент протонов через митохондриальную мембрану. Трансмембранный протонный градиент используется для синтеза АТФ АТФ-синтетазой. r рН – протондвижущая сила или протонный градиент. В электрон- транспорт. цепь, обеспечивающую возникновение протонного градиента входят 4 комплекса переноса заряда локализованных во внутр. мембране митохондрий и несколько низкомолекул. переносчиков электронов свободно диффундирующих в мембране.
Q – убихинон, II – сукцинат-убихинон оксидредуктазы (электрон от сукцината переносит на убихинон), III – убихинон цитохром С оксидредуктаза, IV- цитохром С кислород оксидредуктаза (электрон с цитохрома С переносят на О2) или цитохромоксидаза.
АТФ-синтаза состоит из двух субъединиц (F0,F1) АДФ+Фн=АТФ. Электрон-транспорт. цепь работает практически без тепловых потерь. Электрохим. градиент создаваемый работой ЭТЦ равен r μн+ = F * φ+2,3RT r рН, где F – постоянная Фарадея, φ – электрический потенциал, R- универсал. газовая постоянная, r рН- протонный градиент.
Основные понятия и законы фотофизики и фотохимии. Одно из важнейших направлений современной биофизики – исследования молекулярных физических и физико-химических взаимодействий, лежащих в основе биологических явлений. Спектральные методы широко применяются для изучения разнообразных свойств и реакций биологических систем и макромолекул. Среди спектральных методов наибольшее распространение получили оптические методы, основанные на взаимодействии молекулярных систем с оптическим излучением. Основные параметры светового излучения:
-длина волны λ (нм) и частота излучения ν (Гц), связанные соотношением ν = с/λ (с - скорость света),
-энергия кванта света Е = ħ∙ν ( ħ – постоянная Планка),
- интенсивность излучения I = n∙E (n- число квантов в световом потоке).
Энергия квантов света в видимой области, вызывающих фотобиологические реакции, составляет 170-340 кДж/моль. Оптический диапазон длин волн включает ультрафиолетовое (200-400 нм), видимое (400- 800 нм), инфракрасное (800-10000 нм) излучение.
Поглощение света веществом – внутримолекулярный одноэлектронный физический процесс. Свет поглощается молекулами, при этом электрон переходит из основного в энергетически более высокое возбужденное состояние. Вся энергия кванта света поглощается сразу за время 10-15- 10-14с, поглощение света – процесс дискретный.
Свет представляет электромагнитную волну, при взаимодействии с веществом свет ведет себя подобно потоку частиц (квантов света или фотонов). Энергия фотонов определяется длиной волны излучения. Из квантов света с различными энергиями могут поглощаться только те, энергия которых соответствует энергии переходов между какой-либо парой уровней в молекуле вещества.
Каждый электрон в молекуле находится на опреде ленной орбитали и обладает определенной энергией. Таким образом, в молекуле существует система электронных энергетических уровней. Для химических и опти ческих свойств молекулы наиболее важны два уровня: это верхняя (по энергии) заполненная молекулярная ор биталь (ВЗМО) и нижняя свободная молекулярная орби таль (НСМО). ВЗМО обладает донорными свойствами. Потенциал иони зации – энергия, которую необходимо затратить, чтобы оторвать электрон от молекулы. Чем выше энергия ВЗМО, тем ниже потенциал ионизации молекулы и тем лучший она донор электронов. Например, высоким значением энергии ВЗМО обладает витамин Е, что обусловливает его антиоксидантные свойства.
Энергия НСМО определяет акцепторные свойства мо лекулы: чем ниже НСМО, тем охотнее данная молекула присоединяет электрон.
На каждом заполненном энергетическом уровне могут находиться только два электрона, имеющие противоположные собственные магнитные моменты (спины). Если молекуле сообщить энергию, например, в форме кванта света, то произойдет переход одного электрона с заполненного уровня (S0) на один из незаполненных уровней. Молекула окажется в электронно-возбужденном состоянии. УровниSо, S1, S2,…., называются синглетными, при переходах между ними спин электрона не меняется. Время жизни молекул в состоянии S1составляет 10-8- 10-9с. С определенной вероятностью реализуются пути превращения энергии состояния S1: 1) в тепло: S1→ S0 2) испускание кванта флуоресценции: S1→ S0 + h∙ νфл; 3) фотохимическая реакция: S1→ продукт; 4) передача энергии возбуждения другой молекуле; 5) обращение спина электрона и переход молекулы в триплетное возбужденное состояние Т1: S1→ T1. Переход из триплетного состояния в основное запрещен, так как спины электронов одинаковы. Поэтому в состоянии Т1молекула находится значительно дольше (10-4-10 с), чем в S1 (10-8-10-9 с).
Существует несколько путей растраты энергии из трип летного (Т1) состояния молекулы: 1) безизлучательный переход в Soс обращением спина: T1→S0; 2) испускание кванта фосфоресценции: T1→S 0+h∙ ν; 3) фотохимическая реакция; 4) передача энергии возбуждения другой молекуле.
Биофизические методы исследования. Спектральные методы Среди спектральных методов наибольшее распространение получили оптические методы, основанные на взаимодействии молекулярных систем с оптическим излучением. Основные параметры светового излучения:
-длина волны λ (нм) и частота излучения ν (Гц), связанные соотношением
ν = с/λ (с - скорость света),
-энергия кванта света Е = ħ∙ν ( ħ – постоянная Планка),
- интенсивность излучения I = n∙E (n- число квантов в световом потоке). Энергия квантов света в видимой области, вызывающих фотобиологические реакции, составляет 170-340 кДж/моль. Оптический диапазон длин волн включает ультрафиолетовое (200-400 нм), видимое (400- 800 нм), инфракрасное (800-10000 нм) излучение. Поглощение света веществом – внутримолекулярный одноэлектронный физический процесс. Свет поглощается молекулами (их комплексами, отдельными атомами, ионами, радикалами), при этом электрон переходит из основного в энергетически более высокое возбужденное состояние. В электронных переходах участвуют валентные или оптические электроны, располагающиеся на внешней электронной оболочке. Каждый электронный уровень представляет набор колебательных и вращательных подуровней, переходы между которыми связаны с энергией колебательных и вращательных движений атомов вокруг химических связей. Квантовая природа света выражается в том, что вся энергия кванта света поглощается сразу за время 10-15- 10-14с, поглощение света – процесс дискретный.
Физическая реакция поглощения света может быть записана в следующем виде:
М + ħ∙ν→ М ٭ , где
М ٭ – возбужденное состояние молекулы, отличающееся от основного состояния в первую очередь дополнительным запасом энергии и формой электронного облака.
Свет представляет электромагнитную волну, при взаимодействии с веществом свет ведет себя подобно потоку частиц (квантов света или фотонов). Энергия фотонов определяется длиной волны излучения. Поглощение света происх-т только электронами, находящимися на внешней эл оболочке (оптическими/валентными).
Из квантов света с различными энергиями могут поглощаться только те, энергия которых соответствует энергии переходов между какой-либо парой уровней в молекуле вещества. Способность молекул поглощать свет лежит в основе спектрофотометрии. Поглощение света проявляется в ослаблении светового потока после прохождения через исследуемый объект, и оно тем больше, чем выше концентрация вещества (с, моль∙л –1), толщина раствора (1, см), способность вещества к поглощению. Для монохроматического света эти закономерности выражаются законом Бугера — Ламберта — Бера:
Д=lg∙I0/I = εcl, где D — так называемая оптическая плотность образца, I0 и I — интенсивности падающего и прошедшего через раствор вещества света. Величину ε (моль-1 л см-1) называют молярным коэффициентом экстинкции. КМЭ численно равен оптической плотности раствора концентрации 1 моль/л. Пользуясь законом БЛБ можно оппппределить концентрацию.
Электронные спектры поглощения возникают в результате переходов электронов в возбужденные состояния и наблюдаются в ультрафиолетовой, видимой и ближней инфракрасной областях (120-1000 нм). Энергии переходов составляют 1000-120 кДж/моль (240-30 ккал/моль). При поглощении такой энергии одновременно происходит изменение в колебательных и вращательных состояниях, вследствие чего электронные спектры состоят из широких полос.
Интенсивность полос поглощения определяется вероятностью перехода молекул из основного в возбужденное состояние. Спектр поглощения представляет зависимость вероятности поглощения от длины волны (или частоты) света.
Помимо величины оптической плотности Д вещества используют величину пропускания Т=I/I0. Из определения оптической плотности видно, что Д=lg ∙1/Т.
Спектр поглощения вещества зависит от химической природы вещества, его состояния, характера окружения, температуры. Измерения электронных спектров поглощения позволяют делать заключение о характере исследуемого вещества, структуре и свойствах его молекул и т.д.
Функционирование биологических систем основано на реакциях атомов и молекул, протекающих в соответствии с теми же фундаментальными законами физики и химии, которые управляют их реакциями вне организма. Молекулы ДНК были первыми молекулами – они выполняли функции катализа, передачи и хранения генетической информации. Молекулы ДНК – первые молекулы жизни, так как обладают способностью к самокопированию. В основе всех биохимических и биофизических реакций лежат элементарные процессы переноса электрона и протона.
4. Структура воды. Все функциональные реакции клетки протекают в водном окружении. Вода обеспечивает правильную конформацию и функционирование всех клеточных биополимеров. Все вещества в клетке вступают в биохимические реакции только в растворённом виде.Вода наиболее распространённое и наиболее непонятное вещество на планете. В клетке выделяют 2 типа воды:
Свободную (жидкую)
Связанная (льдоподобная)
Уникальные свойства воды связаны со структурой молекулы воды. Молекула воды представляет диполь. Дипольный момент воды чрезвычайно высок м(мю)=1,84 D (Дебая).
Благодаря своей структуре молекула воды способна образовывать 4 водородные связи. Таким образом, вся структура воды пронизана сетью водородных связей.Водородные связи упорядочивают структуру H 2 O .
Существует 2 теории строения воды :
Квазикристаллическая
Микрокристаллическая
Согласно микрокристаллической модели происходит постепенное исчезновение порядка по мере удаления от рассматриваемой молекулы воды. Согласно квазикристаллической модели вода представляет собой набор кластеров (айсбергов, групп), пространство между которыми заполнено свободными молекулами воды. Внутри кластеров вода находится в кристаллическом состоянии. Согласно этой модели, вода представляет собой набор водородносвязанных кластеров и мономерных молекул воды.
Согласно теории кристаллической воды структура воды характеризуется ближним порядком, то есть соседствующие молекулы H 2 O строго ориентированы друг от друга. Дальше молекулы лишены этого порядка.
Молекула H 2 O находится в постоянном движении. Время перескока молекулы воды из одного положения в другое 10-8 секунд.
Дата: 2019-07-24, просмотров: 351.