Итак, в аксонном холмике возник потенциал действия и побежал к 10 000 аксонных окончаний. Каким способом это возбуждение передается другому нейрону (нейронам)?
Крах синцитщиков
Для нейробиологов XIX столетия вопрос не вызывал никаких сложностей. Они бы сказали, что в мозге плода есть великое множество нейронов, которые постепенно отращивают себе аксоны и дендриты. И в конце концов аксон утыкается в дендритный шипик следующего нейрона, они сливаются, формируя непрерывную мембрану между двумя клетками. Таким образом из отдельных нейронов плода постепенно слагается зрелый мозг, представляющий буквально непрерывную разветвленнейшую сеть единого супернейрона. Его назвали «синцитий» (это ткань с неполным разграничением цитоплазмы и, соответственно, многочисленными клеточными ядрами). По этому синцитию потенциал беспрепятственно перетекает от одного нейрона к следующему, потому что они, собственно, не являются отдельными клетками.
В конце XIX в. сформировалась альтернативная точка зрения. Согласно ей, каждый нейрон представляет собой обособленную единицу, а аксонное окончание не утыкается в прямом смысле слова в дендритный шипик. Между ними существует малюсенький промежуток. Эта концепция получила название «нейронная доктрина».
Среди приверженцев концепции синцития нейронная доктрина считалась полнейшей глупостью. «Покажите нам эти пресловутые промежутки, – требовали они от еретиков. – И скажите, как возбуждение перепрыгивает от одного нейрона к другому».
Но вот в 1873 г. трудами итальянского нейробиолога Камилло Гольджи все разрешилось. Он изобрел новый метод окраски нервных тканей мозга. А упомянутый выше Кахаль этим «методом по Гольджи» прокрасил у одного из нейронов каждый отросток, каждую веточку и сучочек, каждый шипик. И что важно, краска не перетекала от одного нейрона в другой. Значит, нет никакой непрерывной, слитой воедино супернейронной сети. А есть самостоятельные дискретные клетки. Адепты нейронной доктрины взяли верх над синцитщиками[1532].
Справились, молодцы! Дело закрыто. Действительно между аксонными окончаниями и дендритными шипиками существуют микрощелочки. Они получили название «синапсы» (до тех пор, пока в 1950-х гг. не был изобретен электронный микроскоп, сами щелочки разглядеть не получалось, так что последний гвоздь в гроб синцитщиков был забит не сразу). Но если это правда, как же сигнал возбуждения переходит от одного нейрона к другому, как он перепрыгивает через синапс?
Он и не перепрыгивает, хотя именно так считали всю первую половину XX столетия, просто электрический сигнал преобразуется в сигнал другого типа.
Нейромедиаторы
На самых кончиках аксонов, привязанные к клеточной мембране, сидят специальные пузырьки, они заполнены молекулами химического передатчика. И вот по аксону от далекого-далекого аксонного холмика бежит потенциал действия. Дойдя до кончика, он запускает процесс высвобождения этих химических передатчиков в щель синапса. Высвободившиеся молекулы плывут через щель и добираются до другого берега – дендритного шипика, возбуждая его. Эти химические передатчики называются нейромедиаторами.
Как же они, будучи выпущены с «пресинаптической» стороны синапса, инициируют сигнал в «постсинаптической» стороне дендритного шипика? На мембране шипика сидят рецепторы нейромедиаторов. О! Самое время познакомиться с одной из величайших биологических метафор! Молекула нейромедиатора имеет определенную трехмерную форму (одну и ту же у всех молекул конкретного нейромедиатора). А рецептор снабжен специальным слотом, куда как влитая вставляется молекула нейромедиатора. Таким образом, нейромедиатор подходит к рецептору – вот она, метафора, – как ключ к замку. Никакая другая молекула не вставится в скважину рецептора, и ни к какому другому рецептору наш нейромедиатор не подойдет[1533]. И когда нейромедиатор связывается с рецептором, то каналы открываются, поток ионов устремляется внутрь дендритного шипика, рождая потенциал.
Так описывается «транссинаптическая» передача с участием нейромедиаторов. За исключением одного неясного момента: что дальше происходит с молекулами нейромедиатора – после того как они связались с рецепторами? Они же не остаются в таком положении навсегда – вспомним, что потенциал действия длится порядка миллисекунды. Нейромедиаторы открепляются от рецепторов, и теперь нужно очистить от них пространство синапса. Для этого существует два способа. Вот первый. У заботящихся об экологии синапсов на мембране аксонного окончания работают «насосы обратного захвата». Они подтягивают к себе нейромедиаторы, перерабатывают их и отправляют обратно в пузырьки, откуда те могут вновь вступить в игру[1534]. Второй способ – разрушить нейромедиатор, а продукты его распада пусть отправляются в океан (т. е. во внеклеточное пространство, оттуда – в спинномозговую жидкость, а потом в кровоток и в конце концов – в мочевой пузырь).
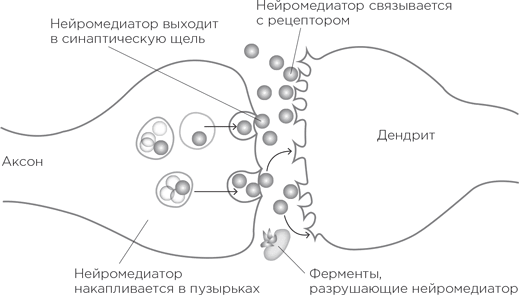
Оба способа ведения нейронного хозяйства чрезвычайно важны. Предположим, нам нужно увеличить количество нейромедиатора в синапсе. То есть, если перевести это в термины возбуждений и потенциалов, используемые в одном из предыдущих параграфов, требуется увеличить возбудимость синапса, чтобы потенциал действия в пресинаптическом нейроне погромче и поскорее отозвался в постсинаптическом; иными словами, чтобы увеличилась вероятность появления потенциала действия во втором нейроне. Можно увеличить количество нейромедиатора, высвобождаемого в синаптическое пространство, – получится погромче. А можно увеличить количество рецепторов на дендритном шипике – и получится более чуткий слух.
Но есть и другая возможность: снизить активность насоса обратного захвата. В результате больше молекул нейромедиатора останется в синапсе. И они дольше будут сидеть на рецепторах или, открепившись от них, будут снова и снова с ними связываться, усиливая сигнал. Или – что в принципе то же самое – можно ослабить активность ферментов, разрушающих нейромедиатор: меньше молекул будет переводиться в нерабочее состояние и больше – оставаться в рабочем. Эффект тот же – усиление сигнала. И, как мы неоднократно видели на страницах этой книги, исследования, связанные с количеством синтезированных и высвобожденных в синапсы нейромедиаторов, количеством и функционированием рецепторов, насосов обратного захвата и ферментов, разрушающих нейромедиаторы, помогают раскрывать интереснейшие индивидуальные различия в нашем поведении.
Типы нейромедиаторов
Что же представляют собой эти мифические молекулы нейромедиаторов, которые под нажимом потенциала действия выпускаются в синаптическое пространство сотнями миллиардов аксонных окончаний? Дело усложняется еще и тем, что существует не один тип нейромедиаторов.
Почему не один? Ведь в каждом синапсе идет единообразный процесс, в ходе которого нейромедиатор связывается с рецептором по принципу «ключ к замку» и тем самым открывает различные каналы; ионы перетекают по ним, и шипик получает чуть менее отрицательный заряд.
Но причины есть. Одна из них заключается в том, что разные нейромедиаторы дают разную длительность и степень деполяризации, т. е. обеспечивают возбуждение разной силы и продолжительности. А значит, появляется возможность усложнить проходящую от нейрона к нейрону информацию.
Вторая причина сразу удвоит поле обзора: есть нейромедиаторы, которые не деполяризуют шипики и не увеличивают вероятность появления потенциала действия в следующем нейроне, а делают все наоборот. Они как раз гиперполяризуют дендритный шипик, открывая для этого другие типы каналов и еще больше сдвигая потенциал покоя в отрицательную сторону (от –70 к –80 мВ). Перед нами т. н. тормозные нейромедиаторы или ингибиторы . Теперь понятно, как усложнились наши модели – мало того, что нейрон с 10 000 дендритных шипиков получает сигналы возбуждения различной силы от разных нейронов, так ведь при этом от других он получает сигналы торможения… И все это обрабатывается в бухгалтерии аксонного холмика.
Таким образом, у нас есть множество классов нейромедиаторов, и каждый связывается со своим рецептором с подходящей конфигурацией[1535]. И что – в любом окончании аксона сидят все эти нейромедиаторы и потенциал действия выводит в синапс полный их ассортимент? А теперь самое время познакомиться с принципом Дейла, названным по имени его первооткрывателя Генри Дейла, великого многостаночника нейробиологии. Этот принцип, предложенный в 1930-х гг., оказался настолько верен[1536], что до сих пор обеспечивает каждому нейробиологу чувство глубокой внутренней правоты. Вот этот принцип: в каждом аксонном окончании нейрона потенциал действия высвобождает в синаптическое пространство один и тот же тип нейромедиатора. Поэтому у каждого нейрона будет свой характерный нейрохимический профиль. «Данный нейрон является нейроном с нейромедиатором типа А . И это означает, что нейроны, с которыми наш нейрон связан, все имеют на дендритных шипиках рецепторы нейромедиатора А »[1537].
Сейчас известны десятки нейромедиаторов. Некоторые из них хорошо нам знакомы – это серотонин, норадреналин, дофамин, ацетилхолин, глутамат (самый частый возбуждающий нейромедиатор в мозге) и ГАМК (самый частый тормозный). Для студентов-медиков данная тема – настоящая пытка, им приходится выучивать все ступени синтеза[1538] этих нейромедиаторов: и предшественников, и последовательность промежуточных форм, через которые проходит молекула-предшественник, пока не дойдет до финальной рабочей молекулы, да еще безобразно длинные названия ферментов, катализирующих этапы синтеза. Но все же есть некоторые относительно простые правила, построенные на трех положениях:
а) Если бежишь со всех ног от тигра, то малоприятно, когда нейроны вдруг перестают передавать сигнал мышцам, потому что – вот ведь незадача! – у них закончился нейромедиатор. Это значит, что нейромедиаторы нужно синтезировать из таких предшественников, которых в организме много; зачастую ими являются простые компоненты пищи. Например, серотонин и дофамин производятся из пищевых аминокислот – триптофана и тирозина соответственно. А ацетилхолин – из холина и лецитина.
б) Нейрон может производить в секунду десятки потенциалов действия. При каждом нужно заново заполнить пузырьки нейромедиатором, потом запустить его в синаптическую щель, а затем забрать обратно внутрь аксонного окончания. Поэтому хотелось бы, чтобы молекула нейромедиатора не была огромной, слишком сложной и с затейливыми финтифлюшками, для которых потребовались бы специальные бригады строителей. Такие молекулы, наоборот, должны синтезироваться из предшественников на раз-два, за несколько шагов. Им следует быть дешевыми и простыми в исполнении. Так, синтез дофамина из тирозина идет всего в два несложных этапа.
в) И наконец – для пущей простоты и дешевизны – синтез многих нейромедиаторов начинается с одного и того же предшественника. Так, для синтеза дофамина дофаминергические нейроны имеют два фермента, по одному на каждый этап. А в нейронах, выделяющих норадреналин, вдобавок к этим двум есть еще один фермент, он превращает дофамин в норадреналин.
Все ради удешевления. И в этом есть смысл. Ведь ничто не выходит из употребления быстрее, чем нейромедиатор, выполнивший свою постсинаптическую работу. Так вчерашняя газета годится разве что на подстилки для еще необученных щенят.
Нейрофармакология
Когда возникло понимание работы нейромедиаторов, ученые занялись вопросами, как именно действуют «нейроактивные» и «психоактивные» препараты.
Эти препараты попадают в две широкие категории: увеличивающие или снижающие возбуждение в том или ином типе синапсов. Мы уже получили некоторое представление о стратегиях повышения эффективности передачи сигнала: а) стимуляция синтеза нейромедиатора (можно для этого, например, ввести его предшественник или с помощью лекарств увеличить активность ферментов его синтеза), например, при болезни Паркинсона в одном из участков мозга перестает вырабатываться дофамин, поэтому лечение предусматривает введение вещества L – DOPA, которое является непосредственным предшественником дофамина, и в результате уровень этого гормона в мозге увеличивается; б) введение искусственно синтезированного нейромедиатора или близкого по строению аналога, обладающего достаточным сродством к рецептору конкретного нейромедиатора: так, псилоцибин структурно соответствует серотонину и активирует те же типы рецепторов; в) повышение восприимчивости постсинаптического нейрона к нейромедиатору за счет увеличения количества его рецепторов, в теории выглядит неплохо, но на практике это сделать трудно; г) увеличение количества нейромедиатора в синапсе с помощью подавления ферментов, его расщепляющих; д) продление эффекта действия нейромедиатора в синапсе путем торможения его обратного захвата. Вот, к примеру, самый ходовой антидепрессант – прозак – именно этим и занимается в серотониновых синапсах. Поэтому его часто называют СИОЗС, т. е. селективный ингибитор обратного захвата серотонина.
Между тем среди использующихся лекарственных препаратов имеются и такие, которые уменьшают уровень передачи сигнала в синапсах; механизм действия подобных препаратов легко представить. Например, они могут блокировать синтез нейромедиатора, или его выход в синаптическую щель, или работу рецепторов и т. д. Вот показательный пример. Ацетилхолин активирует сокращение диафрагмы. Яд кураре, который в ходу у племен Амазонии, блокирует рецепторы ацетилхолина. И человек перестает дышать.
И еще один важный момент: точно так же, как пороговое значение возбуждения в аксонном холмике постепенно сдвигается по мере приобретения опыта, практически вся нейромедиаторная матчасть тоже меняется.
Три и более нейрона
Мы с честью вышли к рубежу, когда можно подумать уже о трех нейронах. А через малое число страниц мы осмелеем настолько, что возьмемся рассуждать сразу о нескольких. И в этом разделе мы должны будем понять, как работает нейронная сеть, т. е. подняться на промежуточную ступень между двумя нейронами и целыми отделами мозга, заправляющими нашим поведением – самым лучшим, добродетельным и самым худшим, а то и просто ужасным.
Нейромодуляция
Рассмотрим следующую диаграмму.
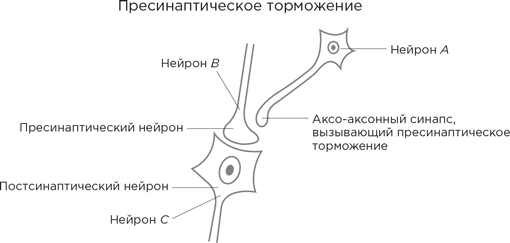
Аксонное окончание нейрона В формирует синапс с дендритным шипиком постсинаптического нейрона (назовем его нейрон С ) и выделяет в синаптическую щель возбуждающий нейромедиатор. Все как обычно. Однако есть еще нейрон А , чьи аксонные отростки идут к нейрону В . Но они заканчиваются не как у нормальных нейронов на дендритных шипиках, а на аксонном окончании нейрона В .
Что это дает? Нейрон А выделяет тормозный нейромедиатор ГАМК, и тот оказывается в том самом аксо-аксонном синапсе, а далее связывается с рецепторами на аксонном окончании В . В результате за счет смещения потенциала покоя –70 мВ еще больше в отрицательную сторону происходит торможение, теперь любой потенциал действия, поступающий от аксона В , гасится, не дойдя до конца, и выделение нейромедиатора в синаптическое пространство снижается. В этом случае говорят, что нейрон А оказывает нейромодулирующее действие на нейрон В .
Дата: 2019-07-24, просмотров: 422.