Вода является очень слабым электролитом и лишь в незначительной степени диссоциирует на ионы водорода и гидроксила:
 Н2О Н+ + ОН
Н2О Н+ + ОН 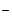 .
.
Этому процессу соответствует константа диссоциации:
 . (1)
. (1)
Константа диссоциации воды очень мала (КД.(Н 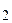 О)= 1,86ּ10
О)= 1,86ּ10 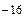 ), поэтому равновесная концентрация недиссоциированных молекул воды практически равна общей концентрации воды:
), поэтому равновесная концентрация недиссоциированных молекул воды практически равна общей концентрации воды:
[H2O] = СМ = 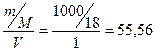 моль/л.
моль/л.
В разбавленных водных растворах концентрация воды меняется незначительно, так что ее можно считать постоянной. Тогда из формулы (1) получим:
[H+]ּ[OH 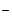 ] = КД.ּ[H2O] = 1,86ּ10
] = КД.ּ[H2O] = 1,86ּ10 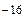 ּ55,56 = 10
ּ55,56 = 10 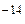 .
.
Таким образом, произведение концентраций ионов водорода и гидроксила представляет собой постоянную величину (при данной температуре) и называется ионным произведением воды КН 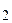 O. При стандартной температуре Т = 298К (250С)
O. При стандартной температуре Т = 298К (250С)
КН 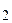 O = [H+]ּ[OH
O = [H+]ּ[OH 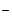 ] = 10
] = 10 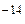 . (2)
. (2)



 В нейтральных растворах [H+] =ּ[OH
В нейтральных растворах [H+] =ּ[OH 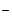 ] = Ö 10
] = Ö 10 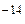 = 10
= 10 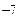 моль/л.
моль/л.
Для характеристики кислотности (щелочности) среды используется водородный показатель рН – десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
рН = - lg [H+].
В нейтральных растворах рН = 7. В кислых растворах [H+] > 10 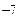 , следовательно, рН < 7; в щелочных растворах [H+] < 10
, следовательно, рН < 7; в щелочных растворах [H+] < 10 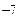 , поэтому рН > 7.
, поэтому рН > 7.
По аналогии с водородным показателем рН введен показатель рОН.
рОН = - lg [OH 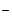 ]
]
Логарифмируя соотношение (2), получим: рН + рОН = 14.
Пример 1.
Определить концентрацию ионов водорода в растворе, если рН = 4,60.
Решение. По условию задачи рН = 4,60 = -lg [H+].
Отсюда [H+] = 10-4,60 = 2,5.10-5 моль/л.
Пример 2.
Определть концентрацию ионов [OH 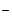 ] в расворе, если рН = 10,80.
] в расворе, если рН = 10,80.
Решение. Из соотношения рН + рОН = 14 находим:
ОН = 14 – 10,80 = 3,20.
Отсюда –lg [OH 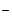 ] = 3,20. Следовательно [OH
] = 3,20. Следовательно [OH 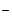 ] = 10-3,20 = 6,31.10-4.
] = 10-3,20 = 6,31.10-4.
Пример 3. Вычислить рН 0,01 М раствора гидроксида натрия.
Решение. Гидроксид натрия является сильным основанием, диссоциирует на ионы практически полностью:
NaOH = Na+ + OH 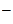 .
.
Из уравнения диссоциации следует, что из одного моля гидроксида натрия образуется один моль ионов OH 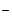 ,следовательно в 0,01 М растворе [OH
,следовательно в 0,01 М растворе [OH 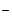 ] = 0,01. Найдем рОН = - lg [OH
] = 0,01. Найдем рОН = - lg [OH 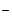 ] = -lg 0,01 = 2. Отсюда рН = 14 – рОН = 12.
] = -lg 0,01 = 2. Отсюда рН = 14 – рОН = 12.
КОНТРОЛЬНЫЕ ВОПРОСЫ
181. Определите рН раствора, в 0,5 л которого содержится 0,05 г NaOH.
Ответ: 11;40.
182. Во сколько раз концентрация ионов водорода в крови (рН = 7,36) меньше, чем в желудочном соке (рН = 1,00)?
Ответ: В 2,3∙10 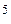 раз.
раз.
183. Определите [H+] и [OH 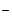 ] в растворе, рН которого равен 6,2.
] в растворе, рН которого равен 6,2.
Ответ: 6,3∙10 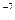 моль/л; 1,6∙10
моль/л; 1,6∙10 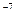 моль/л.
моль/л.
184. Рассчитайте рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10мл 0,5 М раствора NaOH и 15 мл воды.
Ответ: 0,82.
185. Как изменится рН 0,2 М раствора HCl, если его вдвое разбавить водой?
Ответ: Увеличится на 0,3.
186. Вычислите рН 0,5%-ного раствора азотной кислоты.
Ответ: 1,10.
187. К 500 мл воды прибавили 20 мл 0,1 н раствора НС1. Найдите рН полученного раствора.
Ответ: 2,4.
188. Вычислите рН 1,5%-ного раствора КОН.
Ответ: 13,43.
189. 25 мл 10%-ного раствора HCl (плотность 1,05) разбавили водой до 500 мл. Вычислите рН полученного раствора.
Ответ: 0,84.
190. К 250 мл нейтрального раствора прибавили 50 мл 0,5 н раствора КОН. Вычислите рН полученного раствора.
Ответ: 12,9.
191. 10,0 мл 20%-ного раствора КОН (плотность 1,18) разбавили водой до 250 мл. Вычислите рН полученного раствора.
Ответ: 13,23.
192. В мерную колбу на 250 мл налили 10,0 мл 24%-ного раствора HCl (плотность 1,12) и довели раствор водой до метки. Из полученного раствора 5,0 мл перенесли в мерную колбу на 100 мл и разбавили водой до метки. Найдите рН полученного раствора.
Ответ: 1,83.
193. К 25 мл 0,2 н раствора HCl прибавили 25 мл 0,1 н раствора NaOH.Вычислите рН полученного раствора.
Ответ: 1,3.
194. 20,0 мл 12%-ного раствора NaOH (плотность 1,14) разбавили водой до 500 мл. 50,0 мл полученного раствора перенесли в другую колбу и разбавили водой до 1000 мл. Найдите рН последнего раствора.
Ответ: 11,85.
195. К 100 мл 0,1 н раствора HNO3 прибавили 2 мл 6%-ного раствора NaOH (плотность 1,0). Найдите рН полученного раствора.
Ответ: 1,2
196. Найдите рН раствора, в 100 мл которого содержится 0,12 мг NaOH.
Ответ: 9,48.
197. К 100 мл 0,1 н раствора NaOH прибавили 5 мл 4%-ного раствора HCl (плотность 1,0). Найдите рН исходного и полученного раствора.
Ответ: 13; 12,6.
198. К 100 мл 0,2 н раствора HCl прибавили 5 мл 3%-ного раствора КОН. Найдите рН исходного и полученного раствора.
Ответ: 0,7; 0,78.
199. Какую массу NaOH следует растворить в 400 мл воды, чтобы получить раствор, рН которого равен 12?
200. Вычислите молярную концентрацию раствора гидроксида бария, если известно, что рН данного раствора равен 11.
Гидролиз солей
Гидролизом называется обменное взаимодействие ионов растворенной соли с водой, сопровождающееся обычно изменением рН среды. Причина гидролиза заключается в связывании ионов соли ионами воды в слабодиссоциирующие продукты (молекулы слабых кислот или оснований, анионы кислых или катионы основных солей).
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение. а) Цианид калия KCN — сольслабой кислоты HCN и сильного основанияKOH. При растворении в воде молекулы KCN полностью диссоциируют на катионы К+ и анионы CN 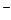 . Катионы К+ не могут связывать ионы ОН
. Катионы К+ не могут связывать ионы ОН 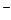 воды, так как КОН – сильный электролит. Анионы же CN
воды, так как КОН – сильный электролит. Анионы же CN 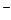 связывают ионы Н+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуетс я по аниону. Ионно-молекулярное уравнение гидролиза:
связывают ионы Н+ воды, образуя молекулы слабого электролита HCN. Соль гидролизуетс я по аниону. Ионно-молекулярное уравнение гидролиза:
 CN
CN 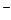 + Н2О HCN + ОН
+ Н2О HCN + ОН 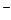
или в молекулярной форме:
 KCN + H2O HCN + KOH.
KCN + H2O HCN + KOH.
В результате гидролиза в растворе появляется некоторый избыток ионов ОН 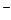 , поэтому раствор KCN имеет щелочную реакцию (рН > 7).
, поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО 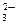 , связывая ионы воды Н+ , образуют аниионы кислой соли НСО
, связывая ионы воды Н+ , образуют аниионы кислой соли НСО 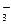 , а не молекулы Н2СО3, так как ионы НСО
, а не молекулы Н2СО3, так как ионы НСО 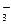 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидроли идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидроли идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
 СО
СО 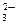 + Н2О НСО
+ Н2О НСО 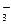 + ОН
+ ОН 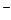
или в молекулярной форме:
 Na2CO3 + H2O NaHCO3 + NaOH.
Na2CO3 + H2O NaHCO3 + NaOH.
В растворе появляется избыток ионов ОН 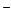 , поэтому раствор Na2CO3 имеет щелочную реакцию (рН>7).
, поэтому раствор Na2CO3 имеет щелочную реакцию (рН>7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуетс по катиону. Ионно-молекулярное уравнение гидролиза:
 Zn2+ + H2O ZnOH+ + H+
Zn2+ + H2O ZnOH+ + H+
или в молекулярной форме:
 2 ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4.
2 ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4.
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 2. Какие продукты образуются при смешивании растворов А1(NО3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль А1(NО3)3 гидролизуется по катиону, а К2СО3 — по аниону:
 Al3+ + Н2О АlOН2+ + Н+
Al3+ + Н2О АlOН2+ + Н+
 CO
CO 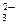 +Н20 НСО
+Н20 НСО 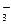 + ОН
+ ОН 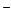
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, так как ионы H+ и ОН 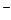 образуют молекулу слабого электролита Н20. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и CO2 (Н2СОз).
образуют молекулу слабого электролита Н20. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и CO2 (Н2СОз).
Ионно-молекулярное уравнение:
2 А13+ + 3 CO 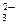 + З Н2О = 2 А1(ОН)3 + З СО2
+ З Н2О = 2 А1(ОН)3 + З СО2
молекулярное уравнение:
2 A1(N03)3 + З К2СО3 + З Н2О = 2 А1(ОН)3 + З СО2 + 6 KN03
КОНТРОЛЬНЫЕ ВОПРОСЫ
201. Составьте ионно-молекулярное и молекулярное уравнения гидролиза, происходящего при смешивании растворов K2S и СгС13. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
202. К раствору FеС13 добавили следующие вещества: а) НС1; б) КОН;
в) ZnCl2;r) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
203. Какие из солей — Аl2(SO4)3, K2S, Pb(NO3)2, KC1 — подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение (7 < рН < 7) имеют растворы этих солей?
204. При смешивании FеС13 и Nа2СО3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
205. К раствору Na2CO3 добавили следующие вещества: а) НС1;
б) NaOH; в) Cu(NО3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
206. Какое значение рН (7< рН < 7) имеют растворы солей Na2S, А1Сl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
207. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Рb(NО3)2, Na2CO3, Fe2(SO4)3. Какое значение рН
(7 < рН < 7) имеют растворы этих солей?
208. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, ZnSO4, А1(NО3)3. Какое значение рН
(7 < рН < 7) имеют растворы этих солей?
209. Какое значение рН (7< рН < 7) имеют растворы солей К3РO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
210. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CuCl2, Сs2СО3, Сг(NО3)3. Какое значение рН (7 < рН < 7) имеют растворы этих солей?
211. Какие из солей — RbCl, Сг2(SO4)3, Ni(NO3)2, Na2SO3 — подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН
(7< рН < 7) имеют растворы этих солей?
212. К раствору Al2(SO4)3 добавили следующие вещества: а) H2SO4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
213. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Nа2SO3; FеС13 или FeCl2? Почему? Составьте ионно-молекулярные уравнения гидролиза этих солей.
214. При смешивании растворов А12(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярные и молекулярное уравнения происходящего совместного гидролиза.
215. Какие из солей — NaBr, Na2S, К2СО3, CoCl2 — подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Определите рН (7 < рН < 7).
216. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaCIO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
217. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию.
218. Какое значение рН (7 < рН < 7) имеют растворы следующих солей: К3РО4, Рb(NО3)2, Na2S? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
219. Какие из солей – К2СО3, FeCl3, K2SO4, ZnCl2 — подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Определите рН (7 < рН < 7) растворов этих солей.
220. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
Дата: 2019-04-23, просмотров: 328.